Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ VI. БІОХІМІЯ ФІЗІОЛОГІЧНИХ ФУНКЦІЙ ТА СПЕЦІАЛІЗОВАНИХ ТКАНИН
ГЛАВА 30. БІОХІМІЯ ІМУННИХ ПРОЦЕСІВ
30.2. ІМУНОГЛОБУЛІНИ: СТРУКТУРА, БІОЛОГІЧНІ ФУНКЦІЇ
Імуноглобуліни — клас білків, що є ефекторами гуморального імунітету, які виконують функцію антитіл, взаємодіючи з генетично чужорідними макромолекулами — антигенами. У крові людини імуноглобуліни мають електрофоретичні властивості γ-глобулінів, становлячи до 20 % маси всіх білків плазми.
Імуноглобуліни синтезуються плазматичними клітинами, які є продуктами трансформації В-лімфоцитів, що відбувається при стимуляції імунної реакції організму на надходження чужорідних білків, клітин (мікроорганізмів, найпростіших), при інфекційних захворюваннях, за умов вакцинації, пересадки органів та тканин, переливання крові, злоякісного перетворення клітин власного організму.
Молекули імуноглобулінів — глікопротеїни, білкова частина яких є тетрамером, що складається з чотирьох поліпептидних ланцюгів: двох важких H-ланцюгів (від англ. heavy — важкий), та двох легких L-ланцюгів (від англ. light — легкий). У кожній окремій молекулі імуноглобуліну два важких та два легких ланцюги попарно однакові, тобто умовна формула будь-якого імуноглобуліну має такий вигляд — H2L2.
H-ланцюги імуноглобулінів складаються з близько 220 амінокислотних залишків, їх молекулярна маса становить 50-70 кД; L-ланцюги — із 110 амінокислотних залишків, їх молекулярна маса — 20-25 кД. Окремі поліпептидні ланцюги в молекулах імуноглобулінів сполучаються між собою дисульфідними S-S-зв’язками (рис. 30.1). Олігосахаридні залишки, що складаються з залишків манози та N-ацетилглюкозаміну, зв’язані з Н- ланцюгами з боку С-кінців.
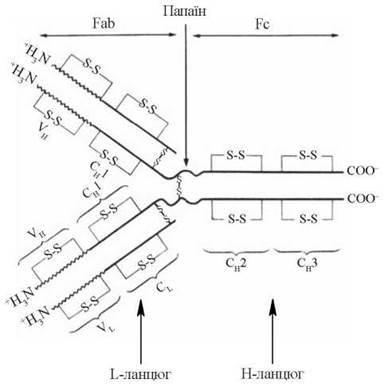
Рис. 30.1. Структурні компоненти молекул імуноглобулінів.
У кожному з H- або L-ланцюгів молекул імуноглобулінів можна виділити окремі домени, що відрізняються за структурою та мають певне функціональне значення.
Константні ділянки (С-ділянки) — домени, що характеризуються сталістю амінокислотного складу в різних класів імуноглобулінів. Вони розміщуються із С-кінців L- та H-ланцюгів, займаючи 1/2 довжини L-ланцюга (СL) та 3/4 довжини Н-ланцюга (ділянки СH1, СH2, СH3).
Варіабельні ділянки (V-ділянки) — розміщуються з N-кінців L- та Н-ланцюгів. Варіабельні ділянки займають приблизно 1/2 довжини L-ланцюга (VL) та 1/4 довжини Н-ланцюга (VH). V-ділянки характеризуються мінливістю амінокислотного складу. За допомогою амінокислотних залишків своїх гіперваріабельних кінцевих ділянок вони беруть участь у формуванні активного центру молекули імуноглобуліну (паратопу), який за своєю конформацією комплементарний детермінантним групам антигену і забезпечує зв’язування з ним, тобто специфічність імуноглобуліну.
За умов розщеплення імуноглобулінів папаїном, яке відбувається в шарнірній частині молекули, утворюються два антигензв’язуючі фрагменти Fab (antigen binding fragment) та фрагмент, що кристалізується, — Fc.
Різні типи важких та легких ланцюгів у молекулах імуноглобулінів позначають літерами грецького алфавіту. Відповідно до такої номенклатури, розрізняють п’ять типів H-ланцюгів (α, γ, μ, δ, ε) та два типи L-ланцюгів (χ, λ). Залежно від типу важкого ланцюга, виділяють п’ять класів імуноглобулінів (IgA, IgD, IgE, IgG, IgM), у складі кожного з яких певний тип H-ланцюга сполучається з одним із двох типів L-ланцюга. У біологічних об’єктах (сироватці крові, інших біологічних рідинах, тканинах) окремі класи імуноглобулінів утворюють надмолекулярні комплекси (n = 2 - 5).
Основними класами імуноглобулінів крові людини, що реалізують гуморальну імунну відповідь на вторгнення чужорідного антигену, є імуноглобуліни G та M. Імуноглобуліни А відіграють роль антитіл у складі інших біологічних рідин та секретів (молока, слізної рідини, секретів слизових оболонок легень, кишечника тощо). Імуноглобуліни класів D та E є мінорними компонентами сироватки крові, що виконують додаткові спеціалізовані функції в комплексі імунних та алергічних реакцій.
Властивості імуноглобулінів крові людини подано в табл. 30.1.
Таблиця 30.1. Біохімічні характеристики окремих класів імуноглобулінів людини
Клас імуноглобулінів |
Молекулярна структура |
Молекулярна маса, кД |
Концентрація в сироватці крові, г/л |
Ig G |
χ2γ2 або λ2γ2 |
150 |
10-15 |
Ig M |
(χ2μ2)5 абo (λ2μ2)5 |
800-960 |
1,5-3,5 |
Ig A |
(χ2α2)1-4 абo (λ2α2)1-4 |
180-720 |
1-5 |
Ig D |
χ2δ2 або λ2δ2 |
160-180 |
0,03 |
Ig E |
χ2ε2 або λ2ε2 |
185-190 |
0,0005 |