Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ II. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ МЕТАБОЛІЗМУ
ГЛАВА 6. ФЕРМЕНТИ I. СТРУКТУРА, ВЛАСТИВОСТІ
Ферменти (ензими) — біологічні каталізатори білкової природи, які синтезуються в клітинах живих організмів та забезпечують необхідні швидкість і координацію біохімічних реакцій, що становлять обмін речовин (метаболізм).
Розділ біохімії, що вивчає структуру, властивості та механізми дії ферментів, називається ензимологією. Прийняті в ензимології позначення:
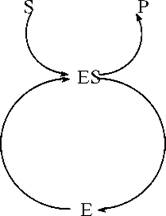
E — фермент, ензим(«enzyme»; англ.) — біологічний каталізатор;
S — субстрат(«substrate»; англ.) — хімічна речовина, сполука, перетворення якої каталізує фермент;
P — продукт(«product»; англ.) — сполука, що утворилася в результаті ферментативної реакції.
6.1. ВЛАСТИВОСТІ ФЕРМЕНТІВ ЯК БІОЛОГІЧНИХ КАТАЛІЗАТОРІВ
Ферменти — специфічні білки, в основі каталітичної дії яких лежать загальні фізико-хімічні та термодинамічні закономірності хімічної кінетики. Білкову природу ферментів беззаперечно довів Дж. Самнер (1926), який отримав перші кристалічні препарати ферменту уреази.

Рис. 6.1. Самнер (Sumner) Джеймс Б. (1887-1955) — американський біохімік, професор та завідувач лабораторії хімії ферментів Корнельського ун-ту. Нобелівська премія (1946).
Властивості ферментів
- ферменти значно підвищують швидкість перебігу біохімічних реакцій, але не входять до складу кінцевих продуктів реакції;
- ферменти забезпечують перебіг лише тих біохімічних реакцій, які можливі, виходячи із законів термодинаміки;
- ферменти прискорюють швидкість як прямої, так і зворотної реакції перетворення субстрату, не змінюючи константи рівноваги (Кр) реакції та зменшуючи термін часу до досягнення стану рівноваги (або стаціонарного стану у відкритій метаболічній системі);
- протягом реакції фермент певним чином взаємодіє із субстратом, що перетворюється, але до складу кінцевих продуктів реакції не входить. Під час перебігу біохімічної реакції, що каталізується, відбувається циклічний процес, в ході якого фермент та субстрат підлягають ступеневому перетворенню з утворенням продукту реакції та регенерацією ферменту;
- ферменти є високоспецифічними каталізаторами, тобто діють, як правило, на структурно близькі субстрати, що мають певний хімічний зв’язок, структурно подібні радикали або функціональні групи. Проявом високої специфічності ферментів є їх стереоспецифічність, тобто здатність перетворювати тільки певні стереоізомери, наприклад L- або D-амінокислоти, D- або L-моносахариди;
- відповідно до білкової природи, каталітична активність ферментів дуже чутлива до змін фізико-хімічних властивостей середовища (рН, температури), які можуть впливати на структурну організацію молекул ферментів, спричиняючи в певних умовах їх денатурацію;
- активність ферментів може суттєво змінюватися під впливом певних хімічних сполук, що збільшують (активатори) або зменшують (інгібітори) швидкість реакції, яка каталізується.
Одиниці виміру активності ферментів
Оскільки кількість ферменту в біологічному об’єкті в більшості випадків визначити неможливо, для характеристики швидкості біохімічної реакції, що каталізується певним ферментом, за умов сталості інших показників середовища (фізико-хімічних параметрів, концентрації активаторів та інгібіторів) користуються значеннями активності ферменту.
Одиниці активності ферментів — умовні величини, що базуються на лінійній залежності швидкості ферментативної реакції від кількості ферменту (або кількості його молекул, що перебувають у каталітично активному стані).
1. У біохімічній практиці загальноприйнятими є одиниці ферменту.
Одиницею ферменту (U — unit; англ.) є така його кількість, яка каталізує перетворення 1 мкмоля субстрату за 1 хв:
1 U = 1 мкмоль/хв.
2. При використанні одиниць системи СІ (SI) активність ферменту виражають в каталах (кат).
1 катал — така кількість ферменту, яка каталізує перетворення 1 моля субстрату за 1 с:
1 кат = 1 моль/c.
3. Розповсюдженою одиницею є питома активність ферменту, яка визначається кількістю одиниць ферментної активності, що припадають на 1 мг білка в біологічному об’єкті (U/мг білка).
У медичній ензимології активність ферменту часто виражають в одиницях (U) на 1 л біологічної рідини, що досліджується, — сироватки крові, слини, сечі тощо (U/л).