Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 18. МЕТАБОЛІЗМ АМІНОКИСЛОТ. ІІ. СПЕЦІАЛІЗОВАНІ ШЛЯХИ ОБМІНУ
18.2. СПЕЦІАЛІЗОВАНІ ШЛЯХИ ОБМІНУ АЦИКЛІЧНИХ АМІНОКИСЛОТ
Обмін гліцину та серину
Гліцин — α-амінооцтова кислота — важливий учасник багатьох біохімічних процесів. Двовуглецевий скелет гліцину використовується в різноманітних синтетичних реакціях утворення інших біомолекул, в тому числі фізіологічно активних сполук.
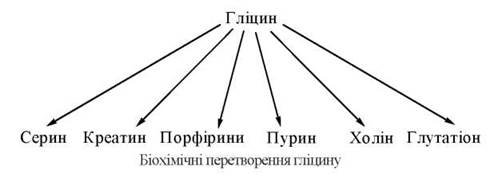
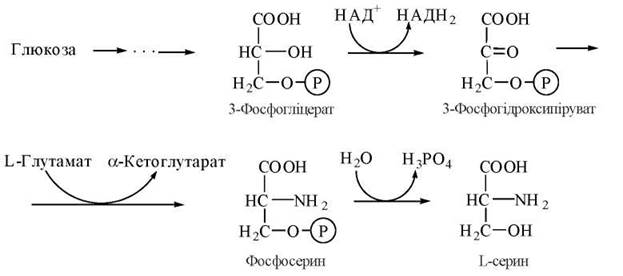
Гліцин у тваринному організмі синтезується з L-серину — замінної амінокислоти, вуглецевий скелет якої утворюється з глюкози за такою схемою:
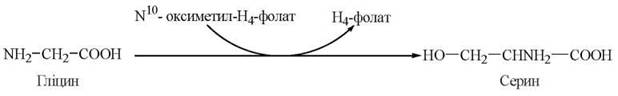
У біохімічних перетвореннях гліцину важливе місце займає коферментна форма вітаміну Вс — тетрагідрофолієва кислота (Н4-фолат).
1. Утворення гліцину із серину:
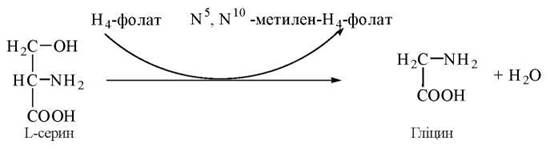
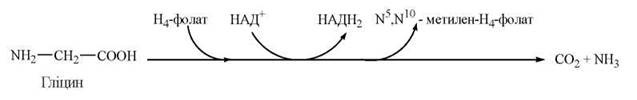
2. Окислення гліцину до діоксиду вуглецю та аміаку:
3. Зворотне перетворення гліцину до серину:
Тетрагідрофолат як переносник одновуглецевих радикалів
Розглянуті реакції метаболізму гліцину — це головне джерело одновуглецевих радикалів, що беруть участь у різноманітних реакціях синтезу амінокислот, нуклеотидів, фізіологічно активних сполук.
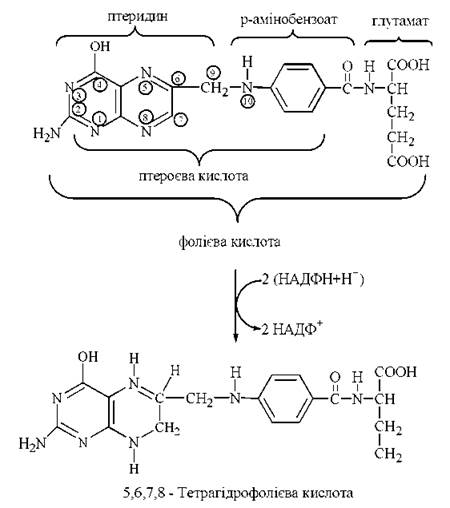
Міжмолекулярне транспортування одновуглецевих радикалів забезпечується коферментною формою фолієвої кислоти (птероїлглутамінової кислоти, вітаміну Вс) — 5,6,7,8-тетрагідрофолієвою кислотою (Н4-фолатом). Тетрагідрофолат утворюється в організмі з фолату, що надходить із продуктами харчування. Перетворення фолієвої кислоти на тетрагідрофолієву (акцептор та переносник одновуглецевих груп) відбувається при участі НАДФН-залежних редуктаз — фолатредуктази, що утворює 7,8-дигідрофолієву кислоту (Н2-фолат) та дигідрофолатредуктази, при дії якої генерується 5,6,7,8-тетрагідрофолієва кислота (Н4-фолат).
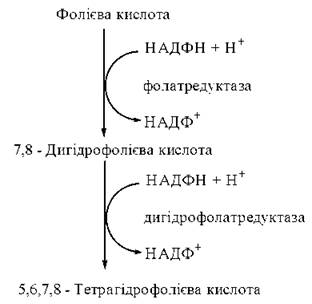
Перетворення фолату на тетрагідрофолат відбувається за рахунок приєднання атомів водню до атомів вуглецю і азоту птеридинового циклу в положеннях С-6, С-7 та N-5, N-8, відповідно.
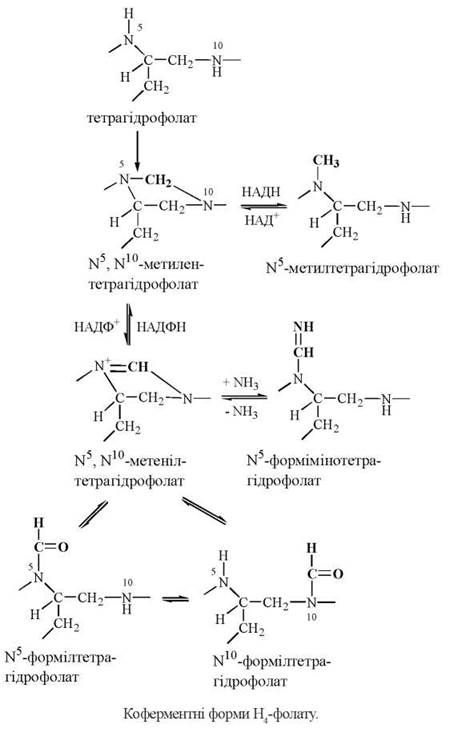
Тетрагідрофолат виконує біохімічну функцію коферменту в міжмолекулярному транспорті одновуглецевих груп різного ступеня окислення: метильних (-СН3), метиленових (-СН-), метенільних (-СН=), оксиметильних (-СН2ОН), формільних (-СНО), форміміно (CHNH)-груп.
Транспорт одновуглецевих радикалів молекулою тетрагідрофолату здійснюється за рахунок приєднання їх у положеннях N5 та N10 птероїлглутамату з утворенням взаємоперетворюваних коферментних форм:
Фізіологічно активні сполуки, що є інгібіторами дигідрофолатредуктази, пригнічують біосинтетичні реакції, в яких беруть участь коферментні форми Н4-фолату, і можуть застосовуватися як протипухлинні засоби (глава 19).
Слід зазначити, що тетрагідрофолат бере участь здебільшого в міжмолекулярному транспортуванні окислених одновуглецевих радикалів, а в переносі метильних груп, крім тетрагідрофолату, значну роль посідає активна форма амінокислоти метіоніну - S-аденозилметіонін (див. нижче).
Обмін сірковмісних амінокислот
Метіонін та реакції метилювання
L-Метіонін — амінокислота, що є важливим учасником внутрішньоклітинного метаболізму і донором метильної (-СН3) групи в численних реакціях метилювання.
Метіонін синтезується в організмі з амінокислоти L-гомоцистеїну: донором метильної групи в цій реакції є N5-метилтетрагідрофолат:
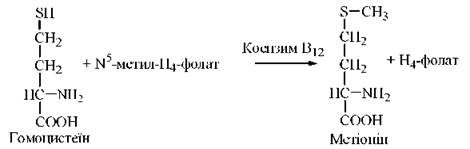
Фермент, що каталізує цю реакцію — гомоцистеїн-метилтрансфераза; коензимом в цій реакції (проміжним переносником метильної групи) є коферментна форма вітаміну В12 — метилкобаламін.
Реакції метилювання
Біохімічно активною формою метіоніну, тобто безпосереднім донором —СH3-групи в реакціях трансметилювання, є S-аденозилметіонін, який синтезується в організмі людини з метіоніну при дії ферменту метіонінаденозилтрансферази.
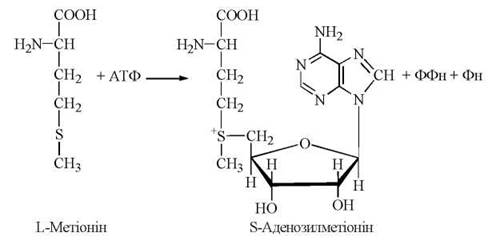
S-Аденозилметіонін, що втрачає активну метильну групу в реакціях метилювання біомолекул, перетворюється на S-аденозилгомоцистеїн, а далі — на гомоцистеїн і знову на метіонін. Оскільки відбувається втрата метіоніну в катаболічних реакціях (через утворення сукциніл-КоА), функціонування цього циклу активного метилу (рис. 18.2) залежить від постійного надходження метіоніну з їжею, як незамінної амінокислоти.
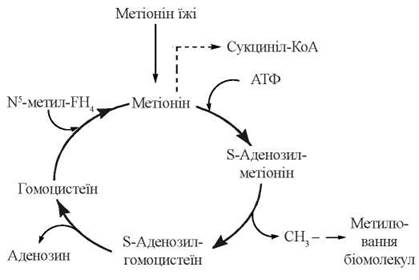
Рис. 18.2. Цикл активного метилу.
Реакціями, що перебігають за участю S-аденозилметіоніну, є синтез креатину, утворення холіну з аміноспирту етаноламіну, адреналіну з норадреналіну, метилювання азотистих основ нуклеотидів тощо.
Синтез креатину
Креатин — азотиста сполука, яка у вигляді креатинфосфату має важливе значення в енергозабезпеченні функції м’язів.
Біосинтез креатину відбувається за участю амінокислот гліцину, аргініну та метіоніну. Процес синтезу складається з двох стадій:
1-ша стадія — відбувається в нирках і полягає в утворенні глікоціаміну (гуанідинацетату) із аргініну та гліцину (фермент гліцинамідинотрансфераза):
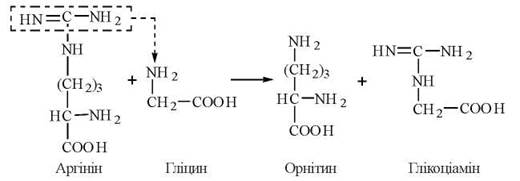
2-а стадія — відбувається в печінці, куди глікоціамін надходить з током крові, і полягає в метилюванні глікоціаміну до креатину за участю S-аденозилметіоніну (ферментгуанідинацетатметилтрансфераза):
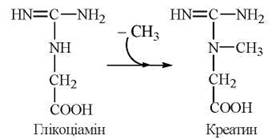
Фосфорилювання креатину при дії креатинфосфокінази генерує креатинфосфат — джерело термінової регенерації АТФ при м’язовому скороченні. Незворотна неферментативна дегідратація і дефосфорилювання креатинфосфату призводить до утворення ангідриду креатину — креатиніну:
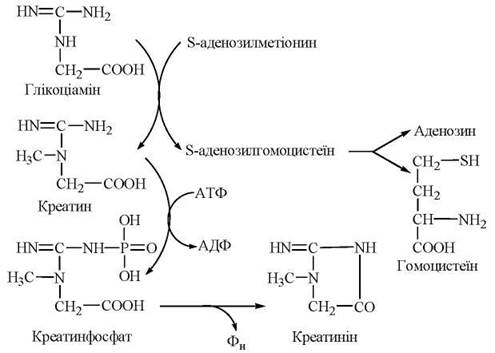
Схема перетворень глікоціаміну до креатину та креатиніну.
У формі креатиніну з організму людини виділяється із сечею значна частина азоту амінокислот; у здорової людини виділення креатиніну пропорційне масі м’язової тканин і значно збільшується за умов травматичних пошкоджень м’язів.
Цистеїн і глутатіон
L-Цистеїн — амінокислота, біологічні функції якої полягають, переважно, в підтриманні у відновленому стані SH-груп багатьох біорегуляторів та ферментів, зокрема, за рахунок синтезу глутатіону.
Глутатіон — трипептид γ-глутамініл-цистеїніл-гліцин, що має в своєму складі вільну сульфгідрильну групу:
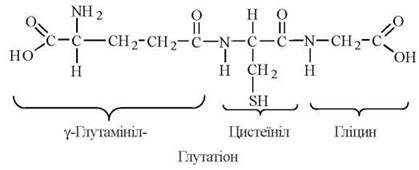
Глутатіон міститься в клітинах тваринного організму у високій концентрації (близько 5 мМ). Глутатіон зворотно перетворюється з відновленої (Г-SH) до окисленої (Г-S-S-Г) форми, відіграючи роль буфера SH-груп.
Біохімічна функція глутатіону в організмі пов’язана з відновленням і детоксикацією органічних пероксидів — похідних пероксиду водню НО-ОН, у молекулі якого один (гідропероксиди) або обидва атоми водню (алкілпероксиди) заміщені на алкільні радикали:
![]()
При взаємодії глутатіону з гідропероксидом утворюються нешкідливі органічні спирти, що підлягають подальшому окисленню:
![]()
Реакція каталізується ферментом глутатіонпероксидазою, що містить в активному центрі атом селену (Se).
Зворотне відновлення T-SS-Г до Г-SH каталізується НАДФН-залежною глутатіонредуктазою:
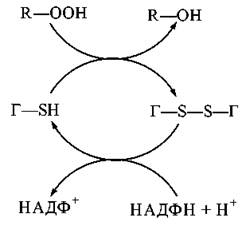
Гідропероксиди та алкілпероксиди утворюються внаслідок діоксигеназних реакцій безпосереднього включення атома кисню в біомолекули. Виникнення органічних пероксидів є результатом активації в біологічних системах реакцій вільно-радикального окислення; головним субстратом таких реакцій є ненасичені жирні кислоти мембранних фосфоліпідів — перекисне окислення ліпідів біологічних мембран.
Активація реакцій перекисного окислення ліпідів є одним з фундаментальних біологічних механізмів пошкодження біоструктур і розвитку клітинної патології при дії пошкоджуючих факторів різного генезу, особливо за умов дії іонізуючої радіації, чужорідних хімічних сполук — ксенобіотиків. Прикладом пошкодження клітинних мембран внаслідок утворення продуктів ліпопереокислення є також перекисний гемоліз еритроцитів, що настає в результаті спадкової недостатності глюкозо-6-фосфат-дегідрогенази — генератора НАДФН, необхідного для функціонування глутатіонредуктази і підтримання глутатіону у відновленій формі.
Сполуки, подібні глутатіону, що знешкоджують органічні пероксиди або протидіють їх утворенню, дістали назву антиоксидантів. Біологічно важливими антиоксидантами є α-токоферол (вітамін Е), аскорбінова кислота, урати.
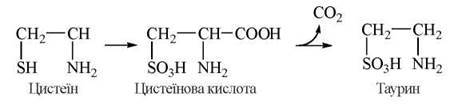
Таурин
Фізіологічно важливою реакцією обміну цистеїну є утворення таурину — аміноетанолсульфату, що, поряд із гліцином, використовується в організмі для утворення кон’югованих форм жовчних кислот — глікохолевої та таурохолевої, відповідно.
Обмін амінокислот з розгалуженими ланцюгами
Відповідно до структурної подібності амінокислот L-валіну, L-лейцину та L-ізолейцину, перші етапи їх катаболізму відбуваються за подібними шляхами і мають спільні механізми:
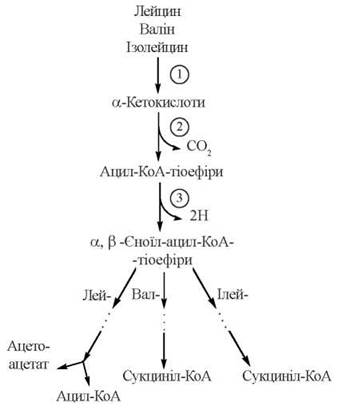
Як випливає з наведеної схеми, загальними реакціями для перетворення амінокислот з розгалуженими ланцюгами є:
(1) трансамінування до відповідних α-кетокислот з розгалуженим ланцюгом; реакція каталізується амінотрансферазою, що може трансамінувати будь-яку з розгалужених L-амінокислот;
(2) окислювальне декарбоксилювання з утворенням ацил-КоА-тіоефірів; реакція каталізується мультиферментним комплексом мітохондрій дегідрогеназою розгалужених α-кетокислот; дегідрогеназний комплекс за структурою та молекулярними механізмами каталітичної дії є аналогічним мітохондріальним дегідрогеназам піровиноградної та α-кетоглутарової кислот;
(3) дегідрогенування з утворенням α,β-ненасичених тіоефірів ацил-КоА; реакція каталізується ферментом (або ферментами), подібними до ФАД-залежної ацил-КоА дегідрогенази лінійних жирних кислот.
Подібність перших етапів катаболізму L-валіну, L-лейцину та L-ізолейцину випливає з механізмів зазначених трьох реакцій їх перетворення:
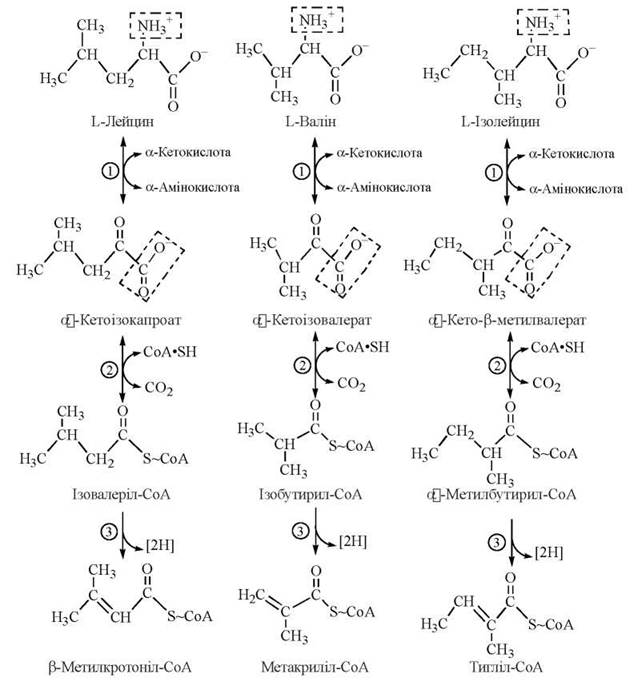
Хвороба кленового сиропу (лейциноз) — спадкова ензимопатія метаболізму амінокислот із розгалуженим ланцюгом.
Захворювання спричиняється дефектом гена, що контролює синтез дегідрогенази розгалужених α-кетокислот. У зв’язку з блоком ферментної реакції (2) окислювального декарбоксилювання лейцину, валіну та ізолейцину, ці амінокислоти та відповідні їм α-кетокислоти накопичуються в крові та внутрішніх органах хворих (інша назва ензимопатії — кетоацидурія кислот із розгалуженим ланцюгом); сеча хворих має специфічний запах кленового сиропу (maple syrup urine disease, англ.). В разі, якщо хвора дитина з раннього віку не буде переведена на спеціальну дієту з низьким вмістом розгалужених амінокислот, патологія призводить до затримки загального розвитку, важких психічних зрушень.
Коензими вітамінів Н та В12 у метаболізмі амінокислот
Сукциніл-КоА є пунктом вступу в цитратний цикл двох розгалужених амінокислот — валіну, ізолейцину та переносника метильних груп амінокислоти метіоніну (рис. 18.1).
Катаболізм цих трьох амінокислот дивергує шляхом утворення спільних інтермедіатів пропіоніл-КоА та метилмалоніл-КоА. Перетворення пропіоніл-КоА, який також утворюється при β-окисленні жирних кислот з непарною кількістю атомів вуглецю, складають значний біохімічний інтерес:
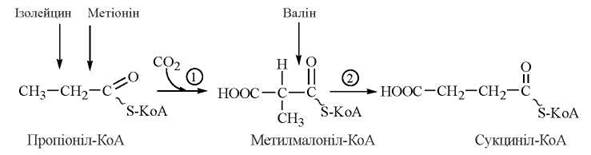
- реакція (1) каталізується пропіоніл-КоА-карбоксилазою — біотин (вітамін Н)-залежним ферментом, механізм дії якого є аналогічним для каталітичної дії карбоксилаз, що приєднують СО2 до ацетил-КоА (в реакції утворення малоніл-КоА) та пірувату (в реакції утворення оксалоацетату);
- реакція (2) каталізується ферментом метилмалоніл-КоА-мутазою, коензимом якого є коферментна форма вітаміну В12-дезоксиаденозилкобаламін.
Як уже зазначалося (глава 6, п. 6.3.) вітамін В12 утворює два коензими: метилкобаламін та дезоксиаденозилкобаламін. У тканинах ссавців ці коферментні форми вітаміну В12 беруть участь у двох ферментних реакціях:
1) метилюванні гомоцистеїну з утворенням метіоніну — коферментом є метилкобаламін як переносник метильної групи в реакції метіоніну з N5-метил-Н4-фолатом (див. вище);
2) ізомеризації метилмалоніл-КоА до сукциніл-КоА — каталітичну функцію виконує дезоксиаденозилкобаламін як коензим метилмалоніл-КоА-мутази; механізм реакції полягає у внутрішньомолекулярному обміні двох хімічних груп, що сполучені із сусідніми атомами вуглецю — атомами водню та радикалу, який може бути заміщеним вуглеводнем, гідроксильною або аміногрупою:

Обмін аргініну
Участь аргініну в утворенні сечовини як кінцевого продукту амінного метаболізму у ссавців була розглянута вище. В останні роки значну увагу привернула метаболічна роль аргініну як попередника в генерації оксиду азоту(NO) — короткоживучої молекули, яка виконує функцію внутрішньоклітинного месенджера сигналів фізіологічно активних сполук.
Утворення оксиду азоту з аргініну відбувається в реакції, що каталізується NO-синтазою (NOS):
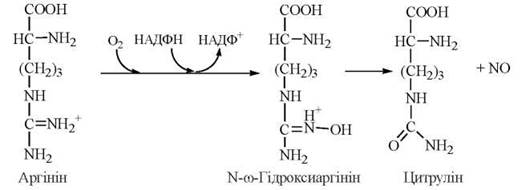
Ідентифіковано три ізоформи NO-синтази, які названі за типом клітин, де вони були вперше виявлені: NOS-1 — нейрональна, або мозкова, NOS-2 — макрофагальна, NOS-3 — ендотеліальна ізоформа.
Біологічна роль NO в організмі реалізується шляхом його участі в модуляції таких фізіологічних функцій, як регуляція тонусу гладких м’язів, зокрема вазодилатація, імунні процеси, нейротрансмісія тощо.