БІОНЕОРГАНІЧНА ТА БІООРГАНІЧНА ХІМІЯ - М.В. Яцков - 2014
І. ПРЕДМЕТ, ЗАВДАННЯ, МЕТОДИ ТА ОСНОВНІ НАПРЯМКИ ДОСЛІДЖЕНЬ БІОНЕОРГАНІЧНОЇ ХІМІЇ
1.6. Оптимізація мікроелементної динаміки у живих організмах
Максимальна ефективність тваринництва можлива тільки при умові, що продуктивна здатність організму генетично обумовлена і є специфічною для тварин кожного виду також технологія годування і вмісту будуть приведені у найбільш повну відповідність.
Забезпеченість тварин життєво важливими мікроелементами - одна з неодмінних умов підвищення їх продуктивності. Тільки в цьому випадку тварини можуть повністю розкрити свій потенціал і досягнути максимальної продуктивності, високої репродуктивної здатності, інтенсивного росту і розвитку (табл. 8).
Таблиця 8
Середній вміст мікроелементів в рослинах злакових, бобових та різнотрав’я пасовищ та лугів біогеохімічних зон, мг/кг сухої речовини (за В. Ковальським)
Біогео-хімічна зона |
Рослина |
Мікроелементи |
||||||
I |
Co |
Mo |
Cu |
Zn |
Mn |
Fe |
||
Тайгово- лісова нечорноземна |
Злаки |
0,11 |
0,22 |
0,51 |
6,30 |
16 |
57 |
60 |
Бобові |
0,22 |
0,29 |
1,00 |
8,00 |
29 |
61 |
106 |
|
Різнотрав’я |
0,20 |
0,26 |
0,76 |
6,70 |
17 |
69 |
38 |
|
Лісостепова і степова чорноземна |
Злаки |
0,14 |
0,33 |
0,71 |
5,30 |
15,4 |
40 |
224 |
Бобові |
0,22 |
0,28 |
1,40 |
7,20 |
24 |
54 |
- |
|
Різнотрав’я |
0,14 |
0,34 |
1,10 |
8,50 |
7 |
59 |
- |
|
Сухостепова, напівпустельна і пустельна |
Злаки |
0,11 |
0,26 |
2,80 |
6,60 |
16 |
48 |
142 |
Бобові |
0,37 |
0,44 |
3,10 |
8,70 |
15 |
37 |
142 |
|
Різнотрав’я |
0,32 |
0,45 |
1,40 |
7,30 |
- |
52 |
- |
|
Надходження мікроелементів в живий організм залежить від наявності цих речовин в довкіллі. Вміст мікроелементів у грунтах, природних водах має вплив на накопичення їх в кормових рослинах, що в свою чергу позначається на забезпеченні мікроелементами тварин і людини.
Важливим етапом аналітичної діагностики є визначення мікроелементів в різних пробах, взятих з організму тварини і порівняння їх з оптимальним показником у відповідних органах і тканинах, а також в крові та молоці. Наприклад, оптимальні дані мікроелементного складу крові представлені в табл. 9.
Аналізуючи механізм виникнення дефіциту мікроелементів в організмах тварин, В. Самохін відмічає три причини: недостатнє надходження з кормами, недостатнє засвоєння з кормів і підвищене виділення з організму. При організації збалансованого забезпечення тварин мікроелементами повинні бути, по можливості, враховані всі ці положення.
Таблиця 9
Оптимальні дані мікроелементного складу крові
Тварина |
Купрум |
Цинк |
Манган |
Кобальт |
Йод |
Корови |
80-100 |
350-500 |
5-70 |
3-6 |
4,5-8,0 |
Свині |
90-140 |
400-490 |
10-20 |
2-8 |
- |
Вівці |
60-90 |
300-500 |
10-30 |
1-4 |
- |
Птиця |
10-20 |
500 |
8-10 |
4-6 |
- |
В наш час нестача мікроелементів в тваринному організмі усувається в більшості випадків шляхом підкорму тварин мінеральними солями мікроелементів. їх додають до кормів або вводять в склад комбікормів, змішують з силосом, подрібненими коренеплодами. Солі мікроелементів попередньо розчиняють у воді і приготованим розчином рівномірно обробляють корма.
З врахуванням вказаних факторів останнім часом інтенсивно розвиваються дослідження біологічної активності сполук мікроелементів, які мають хелатну структуру. В якості лігандів використовуються як синтетичні, так і природні хелатоутворювачі. Найбільш перспективними є хелати з природними лігандами, оскільки вони можуть бути готовими структурними утворювачами для будови металоферментів, білків тощо.
Ферум. Зі всіх сільськогосподарських тварин недостатність Феруму частіше всього проявляється в поросят. Анемія, пов’язана з дефіцитом Феруму, характеризується зі зниженням рівня гемоглобіну в крові. Усувають анемію парентеральним введенням Fе-декстрана, який являє собою слабкий комплекс Феруму з високомолекулярним полісахаридом (C6H10O5)n. При цьому вирішальне значення набуває відносно великий розмір молекул декстрину (молекулярна маса вираховується десятками мільйонів). Водні розчини декстрину виконують роль тимчасових замінювачів плазми крові, оскільки володіють в’язкістю, близькою до в’язкості крові. З декстрину Ферум поступово, по мірі необхідності, звільняється для поповнення крові гемоглобіном (рис. 2).
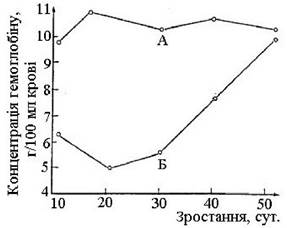
Рис. 2. Концентрація гемоглобіну в крові поросят при ін’єкціях (А) і без ін’єкцій (Б) декстрину Феруму (за А. Хеннігу)
Хоча Ферум займає четверте місце серед найбільш розповсюджених в земній корі елементів, проблема залізного токсикозу зустрічається надзвичайно рідко. Однак, при великому надлишку Fe2+ окиснюється в крові до Fe3+, які утворюють дуже міцні комплекси з білками плазми (трансферином, γ-глобуліном). Якщо вміст Fe3+ перевищує концентрацію, необхідну для зв’язування трансферину, надлишкову його кількість піддають гідролізу, що веде за собою зниження pH крові. Малорозчинні колоїдні часточки основних солей Fe(III), які утворились, сприяють розвитку тромбозів і підвищують згортання крові.
Цинк. Потреба у Цинку для нормальної репродуктивності значно вища у птахів, ніж у інших видів сільськогосподарських тварин. Тому додавання в раціон курчат комплексонатів Zn-ЕДТА позитивно впливає на їх розвиток і фізіологічний стан. У складі комплексонатів Цинк захищений від сполук фітином, що сприяє його засвоєнню організмом тварини.
Покращенню засвоєнню Цинку сприяють деякі антибіотики. В основі найпростіших антибіотичних речовин лежать амінопеніцилінова кислота, яка складається з двох конденсованих гетероциклічних кіл - амінотиозолідинового (А) і Д-лактатного (В). Наявність карбоксильних груп надає молекулі кислотних властивостей, тому пеніциланова кислота і її похідні легко
утворюють солі, а наявність аміногрупи обумовлює здатність утворювати координаційні зв’язки з біометалами і з Цинком зокрема:
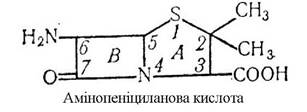
Цинк необхідний також для утворення сперми. В спермі дорослої тварини Цинку міститься 750-2000 мг/кг. При цинковій недостатності порушується репродуктивна функція організму.
Купрум. Засвоєння Купруму тваринними організмами помітно покращується внаслідок утворення хелатних сполук з різними лігандами, переважно карбоновими кислотами, які входять у склад харчових раціонів. Встановлено, що з оксалатів і фумаратів Купрум засвоюється на 20% краще, ніж з сульфату:
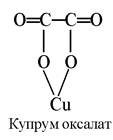
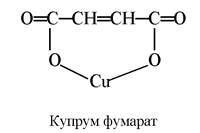
Найкращі у цьому відношенні амінокислоти. Сполуки Купруму з амінокислотами дуже стійкі. Тільки сірководень здатний осаджувати купрум(ІІ) сульфід з амінокислотних комплексів. Так, підкормлення телят синтетичним метіоніном покращував засвоєння Co, Mn, Zn, Cu з раціонів, особливо в перші місяці життя:
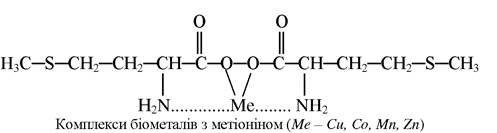
У місячному віці при отриманні телятами синтетичного метіоніну ступінь використання Купруму в раціоні зросла на 37%, у телят двомісячного віку - на 19,5, тримісячного віку - на 6,4%. Метіонінат купруму під назвою «Пабусан» використовується як добавка до корму для відгодівлі свиней.
Манган. Дія, яку проявляє Манган, в живих організмах пов'язана з його комплексоутворенням з нітрато- і кисловмісними лігандами. Крім того, перетворення цього біометалу в різних ступенях окиснення обумовлює його участь в багатьох окисно-відновних процесах. Рівновага Mn(II) ↔ Mn(III) з біохімічної точки зору є найбільш важливою, однак нестабілізований у складі комплексонів Мn(III) у водному середовищі є нестійкий і піддається диспропорціонуванню:
![]()
При наявності специфічних лігандів, наприклад білків, переважаючою формою є Мn(III). Сполуки Мn(III) з біолігандами є аналогом сполук Fe(III) і здійснюється, в основному, кисневими донорними групами - карбоксильними, фенольними і одночасно одним і декількома імідазолами.
Потрапляючи в організм у вигляді мінеральних солей, Манган швидко з нього виводиться, однак якщо Манган потрапляє у вигляді розчинних стійких хелатів, то через нирки його виділяється тільки 6%. Високоефективні у цьому відношенні хелати Мангану з гліцином і метіоніном.
Великий вміст Мn(ІІ) затримує ріст і сприяє виведенню з організму Кальцію. Однак поріг токсичності цього біометалу достатньо високий і різні тварини добре переносять його надлишкову кількість. У зв’язку з цим комплексонати мангану не знайшли широкого застосування у тваринництві як засоби, що регулюють баланс цього елементу.
Кобальт. Найбільше значення для організму тварини має Кобальт у складі цианкобаламіну (вітаміну В12), який або надходить у корм, або синтезується бактеріями харчового каналу. При нестачі Кобальту у тварин скорочується численність бактерій в рубці і змінюється їх склад, внаслідок чого зменшується кількість доступного білка і енергії за рахунок послаблення бактеріального переварювання кормів.
Поряд з неорганічними солями (сульфатами, хлоридами) широкого застосування у тваринництві знаходять комплексони кобальту. Останнім часом розробляють синтези комплексних сполук кобальту на основі амінокислот з передбачуваною біологічною активністю.
В промисловому масштабі здійснений синтез нікотинової кислоти і нікотинаміду (вітамін РР), які утворюють комплексні сполуки з йонами кобальту:
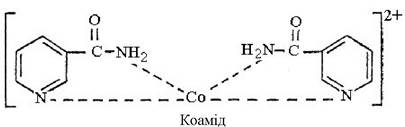
Цей препарат називається коамідом і знаходить ефективне застосування у складі преміксів для крупної рогатої худоби. При введенні коаміду телятам в кількості 0,32 мг на 1 кг живої ваги приріст ваги за 6 місяців складав 22,5%, в той же час як в контрольному досліді при використанні еквівалентної кількості CoCl2 цей показник складав 6,6%.
Є відомості, що підкорм телят синтетичним метіоніном покращує використання Кобальту.
Комплексні сполуки кобальту з новокаїном, новокаїнамідом (сульфати основ новокаїну і новокаїнамиду) є стимуляторами кровотворення у тварин:
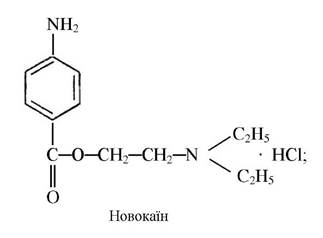
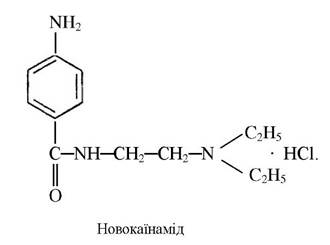
Для лікування гіпсохромних анемій використовують препарат ферковен, до складу якого входить глюконат кобальту (С6Н1107)2Со (табл. 10).
Таблиця 10
Склад крові і продуктивність піддослідних кролів (за А. Карнауховим та ін.)
Ріст, сут |
Контрольна група |
Дослідна група |
||||||
жива вага, г |
середньодобовий приріст, г |
кількість еритроцитів, Т/л |
кількість гемоглобіну, г/л |
жива вага, г |
середньодобовий приріст, г |
кількість еритроцитів, Т/л |
кількість гемоглобіну, г/л |
|
90 |
1685 |
- |
6,20 |
98,0 |
1690 |
- |
6,15 |
95,8 |
100 |
1995 |
31,0 |
- |
- |
2068 |
37,8 |
- |
- |
110 |
2175 |
18,0 |
- |
- |
2308 |
24,0 |
- |
- |
120 |
2280 |
10,5 |
6,52 |
101,1 |
2477 |
18,9 |
7,45 |
112,0 |
130 |
2381 |
10,1 |
- |
- |
2628 |
15,1 |
- |
- |
140 |
2496 |
11,5 |
- |
- |
2735 |
10,7 |
- |
- |
150 |
2721 |
22,5 |
7,23 |
103,3 |
2926 |
19,1 |
8,49 |
120,0 |
160 |
2966 |
24,5 |
- |
- |
3115 |
18,9 |
- |
- |
170 |
3090 |
12,4 |
- |
- |
3273 |
15,8 |
- |
- |
180 |
3131 |
4,1 |
9,36 |
107,5 |
3385 |
11,2 |
11,56 |
130,0 |
Таблиця 11
Вплив купрум(І) йодиду на продуктивність курей-несучок (за А. Карнауховим та ін.)
Групи птахів |
Препарат і доза, мг/кг сухої речовини корму |
Несучість на 5 місяців, шт. |
Маса яйця, г |
|
Контрольна |
KI |
0,43 |
66 |
55,3 |
CuSO4 · 5H20 |
0,64 |
|||
Дослідні |
||||
1 |
Cul |
0,1 |
75 |
56,1 |
2 |
0,3 |
77 |
58,3 |
|
3 |
0,5 |
77 |
59,5 |
|
4 |
0,8 |
75 |
58,7 |
|
5 |
1,0 |
72 |
55,4 |
|
При використанні купрум(І) йодиду в кількості 0,5 мг на 1 кг сухої речовини в кормах в раціоні курок-несучок (табл. 11) несучість збільшилась на 17,4%, маса яєць - на 7,6%.
Купрум(І) йодид має сприятливий вплив на м’ясну продуктивність курчат-бройлерів (табл. 12). Порівняно з контрольною групою жива вага бройлерів збільшилась на 6,9%.
Таблиця 12
Вплив купрум(І) йодиду на продуктивність курок-несучок (за А. Карнауховим та ін.)
Група птахів |
Маса 1 гол. на початок досліду, г |
Середньодобова вага на початок досліду, г |
Маса 1 гол. в кінці досліду, г |
Приріст ваги за дослідний період, г |
Середньодобовий приріст ваги 1 гол., г |
Контроль (20000 гол.) |
290 |
13,8 |
898 |
608 |
16,9 |
Дослід (20020 гол.) |
290 |
13,8 |
960 |
670 |
18,6 |