БІОНЕОРГАНІЧНА ТА БІООРГАНІЧНА ХІМІЯ - М.В. Яцков - 2014
І. ПРЕДМЕТ, ЗАВДАННЯ, МЕТОДИ ТА ОСНОВНІ НАПРЯМКИ ДОСЛІДЖЕНЬ БІОНЕОРГАНІЧНОЇ ХІМІЇ
1.2. Роль хімічних елементів в будові біосфери
З більш ніж ста хімічних елементів періодичної системи Д.Менделєєва до складу всіх живих організмів входять вісімнадцять. Такі елементи як Карбон, Оксиген, Гідроген, Нітроген, Фосфор і Сульфур - є основою всіх біологічних систем, оскільки входять до складу білків і нуклеїнових кислот і складають основу життя на Землі. їх загальна назва - органогени.
Дванадцять інших елементів також необхідні для нормальної життєдіяльності організмів. До них відносяться два елемента- неметали - Хлор та Йод - і десять елементів-металів - Натрій, Калій, Магній, Кальцій, Манган, Ферум, Кобальт, Купрум, Цинк і Молібден. Ці десять елементів-металів отримали назву «металів життя», або біометалів, і вивчення їх ролі в живих організмах складає основне завдання біонеорганічної хімії.
В природі постійно існує колообіг хімічних елементів під впливом живої речовини. Живі організми безперервно викликають переміщення хімічних елементів - це їх геометрична функція. Будь- яке переміщення хімічних елементів в навколишньому середовищі називається міграцією хімічних елементів, а якщо міграція здійснюється за участю живої речовини, її називають біогенною (табл. 1).
Таблиця 1
Розповсюдженість хімічних елементів в земній корі
(за декадами В, Вернадського)
Декади |
Масова частка, % |
Елементи |
І |
> 10 |
0 (49,13), Si (26,00) |
II |
1 - 10 |
A1 (7,45), Fe (4,20), Ca (3,25), Na (2,40) K (2,35), Mg (2,35), H (1,00) |
III |
10-1 - 1 |
Ti (0,61), C (0,35), Cl (0,20), P (0,12), S (0,10), Mn (0,10) |
IV |
10-2 — 10-1 |
F, Ba, N, Sr, Zr, V, Ni, Zn, B, Cu, Cr |
V |
10-3 - 10-2 |
Rb, Li, Y, Be, Ce, Co, Th, Nd, Pb, Ga, Mo, Br |
VI |
10-4 - 10-3 |
U, Yb, Dy, Gd, Sm, Er, La, Sn, Sc, W, Cs, Cd, As, Pr, Hf, Ar, Lu, Hg, Tu, Ho, Tb, I, Ge |
VII |
10-5 - 10-4 |
Se, Sb, Nb, Ta, Eu, In, Bi, Ti, Ag |
VI |
10-6 - 10-5 |
Pd, Pt, Ru, Os, Po, Au, Rh, Ir, Te, He |
IX |
10-7 - 10-6 |
R, Tc |
X |
10-8 - 10-7 |
Kr |
XI |
10-9 - 10-8 |
Xe |
XII |
10-10 - 10-9 |
Ra |
Та частина планети, в якій проявляється життя у всьому своєму різноманітті, називається біосферою. Хімічні елементи знаходяться в біосфері у постійному русі. Це залежить від геохімічних і біохімічних процесів, які протікають в біосфері, а також від виробничої діяльності людини. У зв’язку з цим хімічні елементи зустрічаються в грунтах, водах, повітрі, організмах рослин, тварин і людини. Хімічні елементи вибірково концентруються живими організмами в залежності від розчинності сполук елементів в середовищі існування живого організму. Геохімічна функція елемента визначається тим, який хімічний елемент здатний накопичуватися.
Силіцій, Алюміній, Титан є досить розповсюдженими елементами в земній корі, однак внаслідок малої розчинності їх природних сполук вони в досить малих кількостях містяться в організмах. Інші елементи, такі як Йод, Сульфур, Фосфор, Молібден, хоча й знаходяться в земній корі в невеликих кількостях, але концентруються організмами в значній мірі (табл. 2).
Таблиця 2
Вміст хімічних елементів в земній корі, грунтах, морській воді, рослинах, тваринах, % (за А. Виноградовим)
Елемент |
Земна кора |
Грунти |
Морська вода |
Рос лини |
Тварини |
1 |
2 |
3 |
4 |
5 |
6 |
Оксиген |
49,4 |
49,0 |
85,82 |
70 |
62,4 (вираховано) |
Силіцій |
27,6 |
33,0 |
510-5 |
0,15 |
110-5 |
Алюміній |
8,5 |
7,12 |
110-6 |
0,02 |
110-5 |
Ферум |
5,0 |
3,8 |
5-10-6 |
0,02 |
0,01 |
Карбон |
0,01 |
2,0 |
0,002 |
18 |
21 |
Кальцій |
3,5 |
1,37 |
0,04 |
0,3 |
1,9 |
Калій |
2,5 |
1,36 |
0,038 |
0,3 |
0,27 |
Натрій |
2,6 |
0,63 |
1,06 |
0,02 |
0,1 |
Магній |
2,0 |
0,6 |
0,14 |
0,07 |
0,03 |
Титан |
0,6 |
0,46 |
1·10-7 |
1·10-7 |
1·10-61-1·10-5 |
Нітроген |
0,02 |
0,1 |
110-5 |
0,3 |
3,1 |
Гідроген |
0,15 |
— |
10,72 |
10 |
9,7 |
Фосфор |
0,08 |
0,08 |
5·10-6 |
0,07 |
0,95 |
Сульфур |
0,05 |
0,05 |
0,09 |
0,05 |
0,16 |
Манган |
0,09 |
0,085 |
4·10-7 |
1·10-3 |
1·10-5 |
Стронцій |
0,04 |
0,03 |
1·10-3 |
~10-4 |
1·10-3 |
Флуор |
0,027 |
0,02 |
1·10-4 |
1·10-5 |
1·10-5 1·10-4 |
Ванадій |
0,03 |
0,01 |
5·10-8 |
1·10-4 |
1·10-5 |
Хлор |
0,048 |
0,01 |
1,89 |
~10-2 |
0,08 |
Рубідій |
0,03 |
510-3 |
2·10-5 |
5·10-4 |
~10-5 |
Цинк |
5·10-3 |
510-3 |
5·10-6 |
3·10-4 |
1·10-3 |
Нікель |
1·10-2 |
510-3 |
3·10-7 |
5·10-5 |
1·10-6 |
Купрум |
1·10-2 |
2-10-3 |
2·10-6 |
2·10-4 |
1·10-4 |
Кобальт |
4·10-3 |
110-3 |
1·10-7 |
2·10-5 |
1·10-6 1·10-5 |
Літій |
6,5·10-3 |
310-3 |
1,5·10-5 |
1·10-5 |
~10-4 |
Плюмбум |
1,5·10-4 |
510-4 |
5·10-7 |
~10-5 |
1·10-6 |
Бор |
3·10-4 |
510-4 |
5·10-4 |
1·10-4 |
1·10-5 |
Йод |
3·10-5 |
510-4 |
1·10-6 |
1·10-5 |
1·10-5 1·10-4 |
Молібден |
1,5·10-2 |
3-10-4 |
1·10-7 |
2·10-5 |
1·10-6 1·10-5 |
Арсен |
5·10-4 |
410-4 |
1,5·10-6 |
3·10-5 |
1·10-6 1·10-5 |
Бром |
1,5·10-4 |
2-10-4 |
7·10-3 |
- |
1·10-4 |
Кадмій |
5·10-5 |
510-6 |
- |
1·10-6 |
1·10-4 |
Торій |
1·10-3 |
610-4 |
4·10-8 |
6·10-4 |
1·10-7 |
Вольфрам |
- |
110-4 |
- |
- |
- |
Уран |
2·10-4 |
110-4 |
2·10-7 |
- |
1·10-8 |
Селен |
6·10-5 |
110-6 |
4·10-7 |
1·10-7 |
- |
Бісмут |
1,7·10-6 |
- |
2·10-8 |
- |
2·10-6 |
Меркурій |
7·10-6 |
110-6 |
310-9 |
~10-7 |
10-6 - 10-7 |
Аргентум |
1·10-5 |
— |
~10-9 |
— |
3·10-5 - 5·10-6 |
Аурум |
5·10-7 |
— |
4·10-10 |
— |
1·10-7 |
Радій |
2·10-10 |
8·10-11 |
1·10-14 |
~10-14 |
1·10-12 |
На основі природного відбору впродовж міліардів років природа визначила необхідні для побудови живих систем шість основних елементів-органогенів (Карбон, Оксиген, Гідроген, Нітроген, Фосфор, Сульфур), загальна масова частка яких в організмі складає 97,5 %.
Особлива роль в побудові всього живого належить Карбону. На відміну від всіх інших елементів, число валентних електронів Карбону дорівнює числу валентних орбіталей. Це одна з основних причин утворення достатньо тісних і енергоємних зв’язків і виключної схильності Карбону до утворення гомоланок.
Порівняльна характеристика зв’язків Карбону, Нітрогену, Оксигену та Флуору:
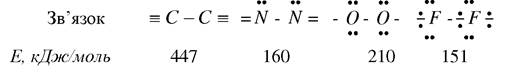
Атоми Гідрогену в структурі живих організмів здатні переміщуватись від однієї молекули до іншої у вигляді йонів Н+. Йон Гідрогену може віддати свій електрон в ланцюжок так званих переносників (наприклад, білкових сполук феруму - цитохромів). Рухаючись по цьому ланцюжку, електрон втрачає енергію і сприяє утворенню багатих енергією макрооргічних сполук (АТФ). Такий спосіб використання енергії розповсюджений в природі і є важливим механізмом життєдіяльності, в значній мірі він визначає біологічну цінність Гідрогену.
Оксиген в живих організмах під впливом ферментів здатний приєднувати електрони, перетворюючись у негативно заряджені йони. Ці йони з йонами Гідрогену утворюють воду або гідроген пероксид.
Таким чином, Гідроген і Оксиген є носіями окисно-відновних властивостей живих систем. Входячи до складу органічної молекули, вони забезпечують рухому єдність протилежних властивостей, які належать лише сполукам Карбону. Нітроген, Фосфор і Сульфур входять до складу нуклеїнових кислот, за допомогою яких здійснюється передача спадкових ознак і відтворення клітин і організмів.
Класифікація хімічних елементів в біонеорганічній хімії
За вмістом хімічних елементів в живих організмах А. Виноградов поділив всі елементи на три групи: макроелементи (масова частка їх в живій речовині складає від 10 до 0,01%-відсотка), мікроелементи (масова частка від 10-2 до 10-5%-відсотка) і ультрамікроелементи (масова частка менше 10-5 %-відсотка).
В. Вернадський поділив всі хімічні елементи, які містяться в живих організмах, по декадах (табл. 3).
Вчений В. Ковальський вдосконалив поділ і поділив всі хімічні елементи на три групи за такими ознаками:
I група - елементи, які беруть участь в обміні речовин і є незмінними, — O, C, H, N, Ca, P, K, S, Cl, Na, Mg, Zn, Fe, Cu, I, Mn, V, Mo, Co, Se;
II група - елементи, біологічна роль яких або вивчена недостатньо, або не вивчена взагалі, - Sr, Cd, Br, F, B, Si, Be, Ni, Li, Cs, Cn, Al, Ba, Rb, Ti, Ag, Ga, Ge, As, Hg, Pb, Bi, Sb;
III група - елементи, біологічна роль яких зовсім не вияснена, — Sc, Tl, Nb, Te, W, Au, La і лантаноїди тощо (табл. 3).
Таблиця 3
Середня масова частка хімічних елементів в живій речовин (за В, Вернадським)
Декади |
Масова частка, % |
Елементи |
І |
101 |
О, H |
II |
100 - 101 |
C, H, Ca |
III |
10-1 -10 |
S, P, Si, K |
IV |
10-2 - 10-1 |
Mg, Fe, Na, Cl, Al, Zn |
V |
10-3 - 10-2 |
Cu, Br, I, Mn, B |
VI |
10-4 - 10-4 |
As, F, Pb, Ti, V, Cr, Ni, Sr, Li |
VII |
10-5 - 10-5 |
Ag, Co, Ba, Rb, Sn, Mo |
VI |
10-6 - 10-5 |
Au |
IX |
10-7 - 10-6 |
Hg |
… |
… |
|
XIII |
10-12 - 10-11 |
Ra |
А. Вєнчиков здійснив класифікацію всіх елементів незалежно від кількісного вмісту їх в живих організмах за фізіологічними і біохімічним ознаками. За цією класифікацією всі елементи, фізіологічна роль яких точно встановлена, отримали назву біотичних елементів. Основними ознаками біотичності хімічних елементів є: 1) сталий вміст елемента в живому організмі; 2) існування дефіциту елемента для нормальної функції організму;
3) знаходження елемента в структурі біологічно активних речовин або участь у виконанні їх функцій; 4) фізіологічна і біохімічна активність елементів в реальних кількостях в природних умовах життєдіяльності організму (табл. 4).
Таблиця 4
Розміщення біометалів в періодичній системі елементів
Період |
Група, підгрупа, хімічний елемент |
|||||||
I |
II |
III |
IV |
|||||
A |
B |
A |
B |
A |
B |
A |
B |
|
3 |
Na |
- |
Mg |
- |
- |
- |
- |
- |
4 |
K |
Cu |
Ca |
Zn |
- |
- |
- |
- |
5 |
- |
- |
- |
- |
- |
- |
- |
- |
Період |
V |
VI |
VII |
VIII |
||||
A |
B |
A |
B |
A |
B |
A |
B |
|
3 |
- |
- |
- |
- |
(Cl) |
- |
- |
- |
4 |
- |
- |
- |
- |
- |
Mn |
- |
Fe, Co |
5 |
- |
- |
- |
Mo |
(1) |
- |
- |
- |