БІОНЕОРГАНІЧНА ТА БІООРГАНІЧНА ХІМІЯ - М.В. Яцков - 2014
III.ПРИРОДНІ КАТАЛІЗАТОРИ, РЕГУЛЯТОРИ ТА СТИМУЛЯТОРИ БІОХІМІЧНИХ ПРОЦЕСІВ
3.1. Ферменти
3.1.1. Швидкість ферментативних реакцій
Швидкість (v) ферментативної як і будь-якої хімічної реакції визначається:
![]()
де s - кількість речовини, що ферментується або концентрація субстрату.
Оскільки в більшості випадків кількість ферменту не може бути виміряна в абсолютних величинах, наприклад в міліграмах або молях, то їх виражають в умовних ферментативних одиницях
[Е] = мікромоль/хв або [s]. В 1972 р. комісія з біохімічної номенклатури запропонувала виражати швидкість ферментативної реакції кількістю молів за секунду і ввели нову одиницю активності ферментів - катал. 1Е = 16,67 нкат (нанокаталів).
Для каталітичної реакції nА + mВ →рС згідно закону діючих мас
![]()
де k - визначається експериментально за молекулярністю реакції.
Ферментативну реакцію з одностороннім перетворенням субстрату виражають
![]()
де Е - фермент, S - субстрат, ES - комплекс фермент-субстрат або комплекс Міхаеліса, Р - продукт, k + 1 - константа швидкості утворення комплексу, k-1 - константа швидкості розпаду комплексу, k + 2 - константа розпаду комплекс+фермент з утворенням продуктів.
Відношення цих констант прийнято об’єднувати єдиною величиною Кm, яка називається константою Міхаеліса
![]()
Вона має розмірність як концентрація субстрата в моль/л. Для характеристики процесу утворення комплексу Міхаеліса прийнята субстратна константа або константа дисоціації комплексу Міхаеліса (Ks)
![]()
Для визначення швидкості ферментативної реакції використовують Кm - константу Міхаеліса, яка в більшості випадків дорівнює константі дисоціації або субстрактній константі Кm = Ks. Отже, швидкість ферментативної реакції найпростіше описується кінетичним рівнянням
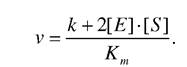
Графічно цю залежність швидкості ферментативної реакції (v) від концентрації субстрату (S) при незмінній концентрації ферменту можна виразити кривою, яку називають графічним рівнянням Міхаеліса-Ментен.

З графіка видно, що при досягненні деякої концентрації субстрата [S] швидкість реакції повинна досягнути максимального значення (Vmax) і при подальшому збільшенні [5] не змінюється.
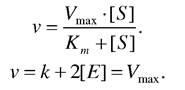
З цього графіка визначають константу Міхаеліса при умові, що ![]() тоді Km = [S], Константа Міхаеліса чисельно дорівнює концентрації субстрата, при якій початкова швидкість дорівнює половині від максимальної.
тоді Km = [S], Константа Міхаеліса чисельно дорівнює концентрації субстрата, при якій початкова швидкість дорівнює половині від максимальної.
Рівняння Міхаеліса-Ментен використовується не тільки для визначення співвідношення між концентрацією субстрату і швидкістю, а й для визначення залежності між V і концентрацією кофактора. В тому випадку, коли активність фермента проявляється лише в присутності кофактора, то рівняння можна використати для вивчення залежності між швидкістю ферментативної реакції і концентрацією кофактора. При цьому встановлюється така залежність
![]()
Комплексом фермента з кофактором можна потім зв’язувати субстрат, що призводить до утворення потрійного комплексу
![]()
Концентрація цього комплексу визначає загальну швидкість ферментативної реакції. За допомогою Km можна охарактеризувати спорідненість фермента до субстрата і до кофактора. Субстрат взаємодіє з ферментом тільки в точно визначеній частині - активний центр або активна зона фермента. Під активною зоною розуміють ту частину молекули ферментативного білка, яка з’єднана з субстратом і обумовлює ферментативні властивості молекули. Активний центр визначає специфічність і каталітичну активність фермента, він об’єднує всі контактні групи, які беруть участь в утворенні активованого комплексу.
Властивості ферментів
Ферменти мають однакові властивості з білками: високу молекулярну масу; здатні гідролізуватись до амінокислот; утворюють при взаємодії з водою колоїдні розчини; нестійкі до високих температур, кислот, лугів, йонів важких металів - відбувається процес денатурації. Особливістю є залежність їх дії від концентрації йонів H+, а також від температури.
Вплив концентрації йонів гідрогену на швидкість ферментативної реакції
Кожний фермент максимально проявляє свою дію при визначених значеннях pH, яке називається pH -оптимумом. Незначна зміна pH сповільнює дію ферментів або зовсім зупиняє її.
Вплив температури на швидкість
При підвищенні температури до 30-500С швидкість ферментативної реакції досягає максимального значення і при зростанні температури, від 60 і більше, швидкість різко спадає. Отже, оптимальна температура для ферментативних реакцій від 40 до 500С, при якій підвищується активність ферментів, що відповідає закону Вант-Гоффа. Цю властивість використовують в харчовій, фармацевтичній промисловостях, в технологічних процесах бродіння, розщепленні білків та вуглеводів.
Специфічність дії ферментів
Білкова природа ферментів обумовлює одну з специфічних властивостей - селективність, яка полягає в тому, що кожний фермент каталізує окрему хімічну реакцію або окремий тип хімічних реакцій, тобто ферменти є специфічними до окремого субстрату. Завдяки цьому вони вибирають з ряду термодинамічно можливих хімічних реакцій лише деякі і тому не тільки прискорюють, а й визначають напрям метаболічного процесу.
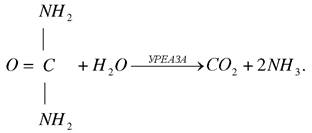
Класичний приклад абсолютної специфічності є уреаза (К.Ф.3.5.1.5), яка розщепляє сечовину і не діє на інші сполуки, в тому числі похідні сечовини. Амілаза розщепляє полісахариди (крохмаль) і не діє на дисахариди (сахарозу).
Хімічні властивості ферментів
Дія амілази
Амілаза - це фермент, який каталізує гідроліз α-глікозидного зв’язку а-1-4 крохмалю та глікогену до проміжних продуктів, які називаються декстринами. Крохмаль володіє здатністю утворювати з йодидом сполуки синього кольору, амілодекстрин - фіолетового, еритродекстрин - червоно-бурого, ахродекстрин - жовтого.
Дія сахарази
Сахараза каталізує гідроліз сахарози до глюкози та фруктози
![]()
Утворені моносахариди визначаються реакцією Фелінга. Сахараза не має вільної альдегідної групи і тому не має відновлюючих властивостей, тоді як глюкоза має такі властивості.
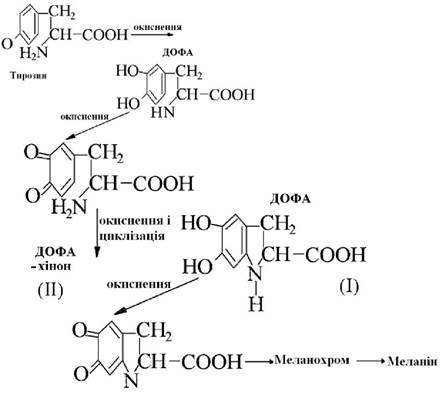
Дія тирозинази
Перетворення тирозину в меланін (чорний нітрогенвмісний пігмент) через зафарбовування в червоний колір утворює проміжний продукт 3,4-диоксифенілаланін (ДОФА), який внаслідок окиснення перетворюється в 2,3-дигідро-5,6-диокси-β-індол-карбонову кислоту (І). Сполука (1) окиснюючись перетворюється в 2,3-дигідро-5,6-дикето-β-індолілкарбонову кислоту(ІІ) - пігмент червоного кольору.