Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Лекарственные препараты, получаемые в фармацевтической промышленности биотехнологическими методами
Витамины
Витамины представляют низкомолекулярные органические соединения, необходимые для жизнедеятельности организма, синтез которых в организме либо ограничен, либо отсутствует. Не подлежит сомнению исключительно высокая биологическая активность витаминов. Потребность в них для организма человека вполне достаточна в очень небольших количествах (от нескольких микрограммов до нескольких десятков миллиграммов в день).
Витамины, не являясь пластическим материалом или источником энергии, служат активными биокатализаторами разных метаболических процессов в организме. Почти все водорастворимые витамины, а также жирорастворимый витамин К являются коферментами или кофакторами биохимических реакций. Витамины A, D, Е регулируют генетический аппарат клетки. Помимо этого абсолютно каждому витамину свойственна своя, специфическая функция в организме. Все это указывает на незаменимость витаминов для жизнедеятельности организма.
В современных социально-экономических условиях вследствие индустриализации и достижений цивилизации человек изменил характер питания и стал употреблять много рафинированных и консервированных продуктов, обладающих меньшей витаминной ценностью. В качестве примера можно привести муку высших сортов, при производстве которой теряется до 80—90 % всех витаминов. Другой пример, при операции экстрагирования, дезодорирования и осветления растительных масел разрушаются жирорастворимые витамины. Витамины А, Е, К и каротин достаточно устойчивы к термообработке, но весьма чувствительны к свету и кислорода воздуха.
Для стран со слабо развитой экономикой дефицит витаминов приобретает массовое явление вследствие достаточно низкого прожиточного минимума для большинства населения этих стран, одновременно с этим снижается качество питания из-за отсутствия в нем свежих овощей, фруктов, мяса, рыбы.
Широкое распространение полигиповитаминозов, снижение резистентности организма к болезнетворным микроорганизмам, сопровождающееся вредными экологическими факторами (радиацией, канцерогенами, промышленными токсинами) — все это повышает роль витаминов в профилактической и лечебной работе врачей, поэтому в экономически развитых странах стали реализовываться государственные программы искусственной витаминизации пищевых продуктов (муки, хлеба, молока, соков и др.).
В основе классификации витаминов (табл. 1) находятся их физико-химические свойства, в соответствии с которыми все витамины делят на водо- и жирорастворимые.
Известно, что водорастворимые витамины в тканях не накапливаются (за исключением витамина В12), из чего следует необходимость их ежедневного поступления в организм. Жирорастворимые витамины способны накапливаться в тканях, поэтому их недостаточность или дефицит встречаются реже. Для них не свойственна и коферментная функция (кроме витамина К). Интересно, что, выполняя функцию индукторов синтеза белков, представители жирорастворимых витаминов проявляют сходство со стероидными гормонами, особенно это имеет отношение к витамину D. И, наконец, все жирорастворимые витамины являются структурными компонентами клеточных мембран, проявляя антиоксидантное действие. Обращаясь к источникам витаминов, можно сказать, что приоритет в этом случае остается за растениями. Не секрет, что на содержание витаминов в пищевых продуктах существенно влияет тот или иной сезон календарного года и кулинарная обработка, что опять нас возвращает к вопросу организации рационального и сбалансированного питания.
Таблица 1
Классификация витаминов
Буквенное обозначение |
Химическое название |
Активная форма витамина |
Лечебный эффект |
Водорастворимые витамины |
|||
В1 |
Тиамин |
Тиаминпирофосфат (ТПФ), кокарбоксилаза, тиаминтрифосфат (ТТФ) |
Антиневритный |
B2 |
Рибофлавин |
ФМН, ФАД |
Витамин роста |
В3 |
Пантотеновая кислота |
KoA-SH, дефосфоКоА, 4-фосфопантетеин |
Антидерматитный |
В5 (РР) |
Ниацин |
НАД+ и НАДФ+ |
Антипеллагрический |
В6 |
Пиридоксин |
Пиридоксальфосфат, пиридоксаминофосфат |
Антидерматитный |
В12 |
Кобаламин |
Метилкобаламин, дезоксиаденозинкобаламин |
Антианемический |
С |
Аскорбиновая кислота |
Аскорбиновая и дегидроаскорбиновая кислоты |
Регулятор метаболических процессов, иммуностимулятор |
Жирорастворимые витамины |
|||
А |
Ретинол |
Ретинол /ретиналь |
Антиксерофтальмический |
D |
Кальциферол |
Эргокальциферол |
Антирахитический |
Е |
Токоферол |
a-, ß-, у-, δ-токоферолы, токотриенолы |
Антиоксидантный |
К |
Филлохинон |
Дифарнезилнафгохинон |
Анти геморрагический |
Научные исследования последних лет показали не только высокую биологическую активность витаминов, но и то, что, как правило, этой активностью обладают не сами витамины, а их производные — коферменты, которые нашли широкое применение в медицинской практике.
Если говорить о производстве основной части витаминной продукции, то ведущее положение здесь занимают химические методы, но в ряде производств в качестве их полноправного конкурента как в нашей стране, так и за рубежом, выступают биотехнологические методы, использование которых более предпочтительно в связи с ужесточением экологических требований к фармацевтическому производству. Кроме того, при применении биотехнологических методов появляются возможности сокращения части стадий химического синтеза за счет использования высокоактивных штаммов микроорганизмовпродуцентов. Например, производство витаминов В12, В2, В3 и D (эргостерина) осуществляется в одну стадию. Также микроорганизмы нашли свое применение и в синтезе витамина С, убихинонов, каротиноидов.
Витамин В12 (кобаламин)
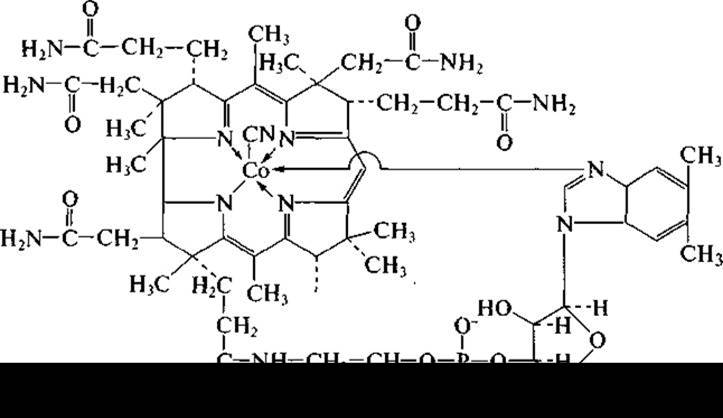
В1 настоящее время витамин В12 получают чисто биотехнологическими методами. Витамин Выявляется производным внутреннего кобальтового комплекса нуклеотида бензимидазола и макроциклической корриновой системы. Способность синтезировать соединения корриноидной природы широко распространена среди прокариотических микроорганизмов. Так, некоторые мутантные штаммы пропионовых бактерий из рода Propionibacterium способны продуцировать свыше 50 мг витамина В12 на 1 л среды, а в присутствии его предшественника 5,6-диметилбензимидазола (5,6-ДМБ) накапливать до 200 мг на 1л культуральной жидкости. Культивируют продуценты витамина В12 на средах, приготовленных из пищевого сырья (кукурузный и мясной экстракты, соевая и рыбная мука). В настоящее время успешно ведется поиск активных продуцентов, образующих достаточное количество витамина на средах, из непищевого сырья, когда в качестве источника углерода и энергии используются изопропиловый спирт, метанол и др. Пропионовые бактерии выращивают периодическим методом в анаэробных условиях на среде, содержащей кроме пищевого сырья глюкозу, соли кобальта и сульфат аммония.
В процессе ферментации образуются кислоты, которые затем нейтрализуют, непрерывно подавая в ферментер раствор щелочи. Через 72 ч после начала ферментации в питательную среду вносят предшественник (5,6-ДМБ), так как без добавления последнего вместо витамина В12 синтезируются фактор В (кобинамид) и не обладающий терапевтическим эффектом псевдовитамин В12, у которого азотистым основанием служит аденин. Общее время ферментации — 6 сут. По ее окончании витамин В12 остается в клетках бактерий, т.е. в биомассе, которую далее сепарируют, а целевой продукт экстрагируют подкисленной водой.
Необходимо отметить, что в качестве новых перспективных разработок создан высокопродуктивный штамм Propionibacterium ari, способный в отличие от ранее известных продуцентов выделять витамин В12 в культуральную среду. Для предотвращения образования коферментной формы витамина В12 в качестве стабилизатора добавляют нитрит натрия. Далее следуют стандартные стадии выделения и очистки, поэтому подробно на них останавливаться не будем. Полученный продукт используется для изготовления разных лекарственных форм препарата и в производстве поливитаминных препаратов.
Витамин В2 (рибофлавин)
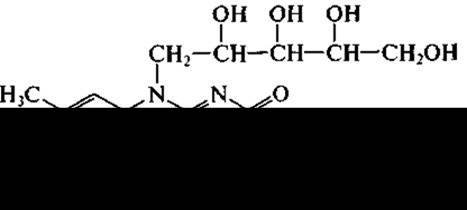
Биосинтез флавинов осуществляется как растительными, так и многими бактериальными клетками, а также плесневыми грибами и дрожжами. Благодаря именно микробному биосинтезу рибофлавина в желудочно-кишечном тракте жвачные животные не нуждаются в этом витамине. У человека синтезирующихся флавинов недостаточно для предупреждения гиповитаминоза.
Витамин В2 хорошо растворим в воде, устойчив в кислой среде, но легко разрушается в нейтральной и щелочной средах, а также под действием УФ-облучения. Для этого витамина характерно функционирование в коэнзимных формах: флавиномононуклеотид (ФМН) и флавиноадениндинуклеотид (ФАД). Именно на примере выделения рибофлавина в культуральную жидкость было открыто явление сверхсинтеза. При промышленном получении рибофлавина используют культуры дрожже подобных грибов Eremothecium ashbyii и Ashbya gossipii, синтезирующих до 3,8 и 6,4 т/л рибофлавина соответственно. Однако серьезным недостатком этих культур является их нестабильность при хранении на твердых средах во всем диапазоне температур — от комнатной до температуры лиофилизации, в результате чего они теряют способность к сверхсинтезу рибофлавина. Поэтому для сохранения активности штамма приходится систематически проводить рассев на твердые среды, отбирая колонии с высокой активностью.
Сейчас вместе с вышеуказанными культурами при промышленном получении рибофлавина в помощью методов используется мутантный штамм продуцент Bacillus subtilis с нарушенной регуляцией синтеза витамина В2. Этот штамм устойчив к наиболее сильному антиметаболиту рибофлавина — его аминоаналогу розеофлавину и обладает способностью к сверхсинтезу витамина В2. При культивировании его на среде с мелассой и дрожжевым экстрактом в культуральной жидкости накапливается 3,5—4,5 г/л рибофлавина. При этом время ферментации сократилось в 3 раза. Рибофлавин получают и химическим методом, используя в качестве биокатализатора сухие клетки бревибактерий. Причем, если биосинтез с нативными клетками занимает несколько суток, то при биосинтезе с суспензией сухих клеток время синтеза ФАД составляет всего 15 — 17 ч.
Витамин В3 (лантотеновая кислота)
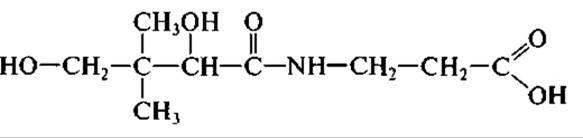
В основном в условиях промышленного производства пантотеновую кислоту получают методом химического синтеза. Наиболее важной коферментной формой витамина В3 является кофермент ацетилирования (КоА). Способностью продуцировать в значительных количествах КоА обладают многие микроорганизмы, в частности актиномицеты. Активно внедряются в промышленное производство способы получения пантотеновой кислоты и ее структурных компонентов из ß-аланина и пантотеата калия с помощью иммобилизованных клеток бактерий, а также достигнуты существенные успехи при получении КоА с использованием мутантных штаммов Brevibacterium ammoniagenes, которые позволяют получать КоА в количестве до 3 г на литр.
Витамин РР (никотиновая кислота)
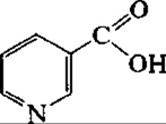
Одним из наиболее распространеных биотехнологических способов получения коферментной формы никотиновой кислоты — никотинамидадениндинуклеотида (НАД) является выделение (экстракция) его из микроорганизмов, как правило, из пекарских дрожжей. Для повышения содержания НАД в дрожжевых клетках культивирование проводят на средах с предшественниками синтеза никотиновой кислоты. Так, при добавлении в среды культивирования аденина или самой никотиновой кислоты получают до 12 мг НАД на І г клеток (по сухой массе). Использование мутантных штаммов Brevibacterium ammoniagenes с одновременным изменением проницаемости мембраны клеток микроорганизмов (коферменты через биомембраны не проникают) с помощью поверхностно-активных соединений (цетилсульфата натрия, цетилпиридина хлорида) позволяет получать НАД до 6 г/л.
Аскорбиновая кислота (витамин С)
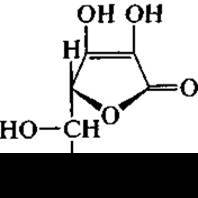
Аскорбиновая кислота в мировом промышленном производстве витаминной продукции в целом занимает наибольшую долю — около 40 тыс. т в год. Ее синтез был разработан швейцарскими учеными А. Грюсснером и С. Рейхштейном в 1934 г. и используется до настоящего времени. Синтез аскорбиновой кислоты является многостадийным химическим процессом, в котором только одна стадия представлена биотрансформацией. Эта стадия трансформации d-сорбита в L-сорбозу при участии ацетатных бактерий. Для получения сорбозы используют глубинную ферментацию, когда культуру продуцента Gluconobacter oxydans выращивают в ферментерах периодического режима с мешалкой и барботером для усиления аэрации и массообмена в течение 20 — 40 ч с результатом по выходу сорбозы до 98% исходного количества сорбита в среде. Обычно для достижения такого высокого выхода целевого продукта в питательную среду вносят кукурузный или дрожжевой экстракт в количестве около 20%. По окончании ферментации сорбозу выделяют из культуральной жидкости. Помимо оптимизации среды можно совершенствовать и технологическую аппаратуру. Например, переход от периодического культивирования продуцента Gluconobacter oxydans к непрерывному в аппарате колоночного типа увеличивает скорость образования сорбозы в 1,7 раз.
В настоящее время широкое использование биотехнологических процессов позволяет совершенствовать синтез аскорбиновой кислоты, сокращая многоэтапные и дорогие химические стадии. Например, синтез витамина С осуществляют енолизацией его важнейшего промежуточного продукта — 2-кето-L-гулоновой кислоты, которую, в свою очередь, получают методом двухстадийного микробиологического синтеза, состоящего из окисления d-глюкозы в 2,5-дикето-d-глюконовую кислоту (2,5-ДКДГК) и биотрансформации последней в 2-кето-L-гулоновую кислоту (2-КГК).
Основными продуктивными микроорганизмами, обеспечивающими процессы окисления d-глюкозы в 2,5-ДКДГК и восстановление последней до 2-КГК, являются мутантные штаммы Erwinia punctata и Corynebacterium sp., при использовании которых выход целевого продукта составляет около 90 % количества глюкозы.
Однако данная технология имеет существенные недостатки, так как при совместном культивировании продуцентов происходит ингибирование синтеза 2-КГК. Поэтому культуральную жидкость после выращивания продуцента 2,5-ДКДГК стерилизуют, применяя поверхностно-активные вещества (ПАВ), что позволяет значительно сократить потери при получении гулоновой кислоты.
Существует и другой биотехнологический способ получения гулоновой кислоты, основанный на синтезе этого продукта штаммом микроорганизмов рода Gluconobacter из сорбозы, производство которой имеет высокую рентабельность. Способность к синтезу целевого продукта обусловлено наличием у этого микроорганизма видоспецифических дегидрогеназ.
Витамин D (кальциферол)
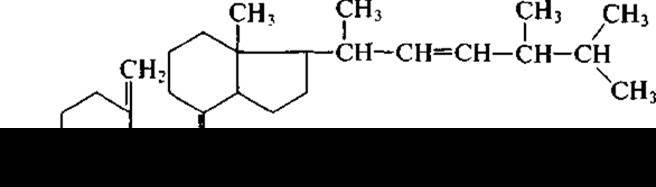
Впервые кальциферол был выделен из рыбьего жира в 1936 г. А. Виндаусом и применен при лечении рахита. Он получил название витамина D3, так как ранее из растительных масел был выделен эргостерин под названием витамин D1, при облучении которого получили витамин D2 — эргокальциферол (кальциферол — в переводе «несущий кальций»),
В настоящее время кальциферол производят из эргостерина с применением УФ-облучения биотехнологическим методом. В процессе преобразования эргостерина в эргокальциферол принимают участие микроорганизмы. Особенно богаты эргостерином клетки дрожжей всех видов и плесневые грибы. В сухой биомассе дрожжей содержится 5—10% эргостерина.
В качестве промышленного источника эргостерина используют дрожжи Saccharomyces cerevisiae вследствие высокого содержания в них эргостерина. В анаэробных условиях культивирования происходит накопление в клетках дрожжей сквалена (предшественника эргостерина). Индукция синтеза эргостерина начинается при строго определенной концентрации кислорода от 0,03 до 2 %. При этом среда должна содержать избыток углеводов и малое количество азота. По окончании процесса спиртового брожения дрожжи отделяют от барды и вносят в питательную среду необходимое количество источников углерода, азота и фосфора. Ферментацию ведут в аэробных условиях 12 —20 ч, по окончании которой клетки дрожжей отделяют от культуральной жидкости, добавляют антиоксиданты и сушат. Обычно в такой биомассе содержание эргостерина достигает 1,5 %.
При дальнейшем УФ-облучении эргостерина получают витамин D2, который либо используется как пищевая добавка, либо подвергается дальнейшей обработке с целью получения кристаллического витамина D2.
При получении эргостерина из дрожжеподобных грибов рода Candida сухую массу грибов экстрагируют петролейным эфиром для извлечения остаточных углеводородов. Полученная таким образом липидная фракция называется «микробный жир» и является побочным продуктом микробиологической промышленности. Эта фракция может быть использована как источник не только эргостерина, но и убихинона, а также других жирорастворимых соединений. Для грибов рода Candida характерно, что при переходе от периодического культивирования на углеводородах к непрерывному в клетках сохраняются как уровень образования стеринов, так и относительное содержание в них эргостерина.
Витамин А (ретинол)
Витамин А — циклический, непредельный одноатомный спирт, образуемый в слизистой кишечника и печени из провитаминов: a-, ß- и у-каротинов (наибольшей активностью обладает ß-каротин, так как образует две молекулы ретинола; другие — только одну) под воздействием фермента каротиноксидазы. Каротиноиды — широко распространенная группа природных пигментов, образуемых высшими растениями, водорослями и некоторыми микроорганизмами. У животных эти пигменты не образуются, а поступают с продуктами питания и служат источником витамина А.
Получение ß-каротина осуществляется химическим и микробиологическим (с использованием штаммов мицелиальных грибов Blakslea trispora) методами. В настоящее время химический синтез ß-каротина более рентабелен. Микробиологический метод получения ß-каротина многостадиен и требует использования достаточно сложной по составу и дорогой кукурузно-соевой среды с растительными маслами, ПАВ и специальными стимуляторами. Разнополые штаммы выращивают сначала отдельно, затем — совместно в ферментере в течение 6 — 7 сут при интенсивной аэрации и 26 ◦С. Если из измельченного мицелия экстрагировать ß-каротин подсолнечным маслом, то можно использовать его в виде масляных растворов. Применяя экстракцию органическим растворителем с последующей кристаллизацией, получают ß-каротин в кристаллическом виде.
Использование отходов крахмало-паточного производства — кукурузного экстракта и зеленой патоки позволяет снизить себестоимость получаемой продукции, а применение в качестве источника углерода целлобиозы, образующейся при утилизации отходов целлюлозы, позволяет в несколько раз увеличить синтез каротиноидов у штаммов культуры Blakslea trispora.
Убихиноны (коферменты Q)

Убихиноны в последнее время вызывают интерес как перспективные лечебные препараты. С одной стороны, они синтезируются в организме животных и человека, делая необязательным их поступление с пищевыми продуктами, что отличает их от группы витаминов.
С другой стороны, недостаток убихинонов ведет к нарушениям в обменных процессах, характерных для проявлений недостаточности витаминов групп В и К. Убихиноны являются регуляторами тканевого дыхания, окислительного фосфолирирования в цепи транспорта электронов и за счет высокой специфичности проявляют свой регуляторный эффект.
С практической стороны наибольший интерес вызывают высшие гомологи: убихинон-9 (KoQ9) и убихинон-10 (KoQ10). Убихинон-10 является коферментом организма человека, вследствие чего на его основе создан лекарственный препарат Ubichynon compositum, проявляющий общетонизирующее, антиоксидантное и иммуностимулирующее действие.
В производстве убихинонов применяются биотехнологические методы, в основе которых лежит экстракция KoQ из биологического материала. В промышленном производстве убихинонов в качестве субстрата используются как растительные ткани (каллус риса или опухолевые ткани Carthamus tinctorius), так и микроорганизмы с высоким содержанием убихинонов, например дрожжи Cryptococcus curvatus и грибы Candida maltosa.
В настоящее время используется биотехнология получения убихинона-9 и эргостерина из микробных липидов, являющихся побочным продуктом крупного производства белково-витаминного концентрата при выращивании грибов Candida maltosa.
Установлено, что биомасса уксуснокислых бактерий (Gluconobacter oxydans), которые используются в производстве аскорбиновой кислоты на этапе окисления d-сорбита в L-сорбозу, содержит значительное количество KoQ10 без примеси его гомологов. Причем, с одной стороны, эта биомасса является отходом производства аскорбиновой кислоты, с другой стороны, штаммы Gluconobacter oxydans в биомассе характеризуются наибольшей окислительной активностью по сорбиту. Этот уникальный факт позволил разработать и внедрить совместную технологию получения L-сорбозы и экстракции убихинона-10 из отсепарированной биомассы с последующей очисткой и с выходом целевого продукта до 85 %.