Биотехнология - Ю.О. Сазыкин 2006
Частная биотехнология
Лекарственные препараты, получаемые в фармацевтической промышленности биотехнологическими методами
Аминокислоты
Все более ухудшающиеся экологические условия создают для населения планеты новую тяжелую проблему — выживание. Одновременно к этой проблеме добавляются такие факторы, как бедность, плохое питание, неуверенность в завтрашнем дне, стрессы. Хорошо изучено благоприятное действие аминокислотных смесей на иммунную систему и различные органы. Помимо этого аминокислоты заменяют насыщенные белком пищевые продукты, недоступные для большинства населения низкоразвитых стран. Таким образом, аминокислоты становятся в настоящее время одним из важнейших факторов выживания населения Земли.
Все 20 аминокислот хорошо изучены (методы их синтеза давно подробно описаны) и являются составными элементами белков или мономерами для построения природных полипептидов. Известно также, что эти соединения существуют в виде оптических изомеров. При этом надо отметить, что аминокислоты в белках находятся в L- и D-формах (L,D-стереоизомеры), причем биологически активны в основном L-формы, а D-стереоизомеры могут быть даже токсичными. Все аминокислоты делятся на незаменимые и заменимые, в зависимости от того, синтезируются они в организме человека или нет. Приблизительно половина из 20 аминокислот являются незаменимыми, а остальные, соответственно, заменимыми.
Незаменимые аминокислоты имеют широкий спектр применения как в сельском хозяйстве (кормовые балансирующие добавки), так в пищевой (биологически активные добавки) и медицинской (лекарственные препараты и смеси для парентерального питания) промышленности.
В сельском хозяйстве аминокислоты используются для балансировки кормов по аминокислотному составу, чтобы в организм животных и птиц они поступали в том соотношении, в каком они находятся в белках этих животных и птиц. Введение аминокислот в корма обеспечивает максимальную скорость синтеза белка и, соответственно, рост биомассы животного. Это очень важно в случае «скороспелого» животноводства, свиноводства и птицеводства.
В питательные продукты для человека также можно добавлять незаменимые аминокислоты. Это целесообразно делать или по медицинским показаниям, или в силу каких-либо соображений, когда человек питается только растительной пищей (растительными белками). Эту пищу можно оптимизировать и улучшить ее питательные свойства, сбалансировав ее по аминокислотному составу путем добавления туда лизина, треонина, метионина (например, в пищу для вегетарианцев). Кроме того, что аминокислоты имеют огромное значение для нашей пищи, они также широко используются и в традиционной клинической практике (табл. 2).
Таблица 2
Моно- и комплексные лекарственные препараты на основе аминокислот
Препарат |
Действие |
Применение |
Глицин |
Обладает ноотропным и седативным эффектом; снижает проявления абстиненции у больных алкоголизмом |
В клинике нервных и психических заболеваний; в наркологии — для стимуляции умственной деятельности (некоторые студенты проводят терапию глицином перед экзаменами) |
Глутамин |
Обеспечивает формирование высших психических функций; участвует в многообразных реакциях переаминирования, т. е. обеспечивает синтез других заменимых аминокислот; активно связывает образующиеся в процессе метаболических реакций ионы аммония, которые являются токсичными и накопление их в клетках головного мозга вызывает процесс возбуждения |
В клинике нервных и психических заболеваний, а также при задержке умственного развития у детей; входит в состав комплексных препаратов для профилактики стресса, например препарат глутамивит наряду с витаминами и микроэлементами содержит также и глутаминовую кислоту |
Метионин |
Является донором метальной группы в разных биохимических реакциях. В частности, при участии метионина осуществляется синтез холина (соединение, входящее в состав клеточных мембран) из жиров; обладает липотропным и гепатропным эффектом |
При циррозах и гепатитах печени и лицам преклонного возраста, у которых имеются признаки атеросклероза |
Цистеин |
Приостанавливает процесс помутнения хрусталика |
В начальных стадиях развития катаракты; входит в состав глазных капель — витайодурола и др. |
Тимоген |
Иммуностимулирующее; усиливает неспецифическую резистентность организма |
Для стимуляции репаративных процессов после тяжелых травм (в том числе переломов костей) |
Церебролизин |
Регулирует процессы регенерации в головном мозге |
После травм головного мозга; инсультов и ишемического голодания головного мозга, а также при задержке умственного развития у детей |
Румалон |
Корректирует метаболизм костной и хрящевой ткани |
При артритах и артрозах |
Раверон |
Регулирует обмен веществ в предстательной железе |
Воспалительные болезни и гиперплазия предстательной железы |
Эмбриобласт |
Усиливает метаболические процессы |
Для профилактики и коррекции возрастных изменений кожи лица и шеи |
Препарат NCTC-109 |
Создает благоприятную среду для метаболических процессов |
Для ускорения заживления и восстановления кожных покровов |
Перечень препаратов на основе аминокислот и их комплексов постоянно растет и расширяется. Очень хорошую перспективу для успешного развития имеют препараты для парентерального питания, содержащие комплексы аминокислот. Они назначаются, когда питание «естественным» образом противопоказано, так как стимулирует секрецию пищеварительных желез. Например, при остром панкреатите человек не должен ни пить, ни есть, поскольку любая стимуляция секреции может привести к самоперевариванию поджелудочной железы.
Тенденция сегодняшнего дня — использование препаратов, содержащих весь комплекс аминокислот (или, по меньшей мере, 18 из них), т.е. в оптимальном для человеческого организма соотношении. В основном это импортные препараты: аминоплазмаль, кетостерил, валин (Германия); аминостерил КЕ (Финляндия); аминосол (Югославия). Некоторые из этих препаратов помимо аминокислот содержат также глюкозу и витамины. Соотношение аминокислот в них оптимальное. В организме человека в зависимости от возраста синтезируются белки соответствующего состава, например аминокислотный состав этих препаратов для детей приближается к составу грудного молока матери, для взрослых он несколько иной.
Установлено, что в любом органе и ткани имеются свои пептиды — соединения, состоящие из небольшого количества аминокислотных остатков, которые образуются и выделяются при их разрушении, стимулируют, как правило, и процессы их регенерации. В соответствии с этим из того или иного органа животных готовят экстракты и на их основе — лекарственные препараты, которые используют для терапии заболеваний этих органов. Общим для всех этих препаратов является то, что действующим началом у них являются пептиды, В частности, в препарате на основе тимуса — тимогене таким действующим началом является глутамилтриптофан (дипептид, состоящий из глутаминовой кислоты и триптофана). Аминокислоты также входят в состав комплексных препаратов, применяемых в косметологии.
Существуют так называемые космоцевтические медицинские препараты, для получения которых используется фармацевтическое сырье, к чистоте которого предъявляют повышенные требования. При этом известно, что особочистыми являются вещества, полученные биотехнологическими методами, например с помощью специально выведенных штаммов-микроорганизмов.
Иллюстрацией может служить препарат эмбриобласт, получаемый из эмбриональной зубной ткани овец, содержащий как биостимуляторы (факторы роста, цитокины и др.), так и необходимый «строительный материал» — аминокислоты, нуклеотиды, витамины, минералы.
В настоящее время аминокислоты получают методами:
✵ биологическим (применение гидролиза белоксодержащих субстратов);
✵ химическим (тонкий органический синтез);
✵ химико-энзиматическим (энзиматическая трансформация химически синтезированных предшественников аминокислот с образованием биологически активных L-изомеров);
✵ микробиологическим (получение L-аминокислот).
Древнейший способ получения аминокислот — кислотный,
щелочной или ферментативный гидролиз белоксодержащих субстратов (мясо, молоко и т.д.). При высокой температуре белок расщепляется на соответствующие аминокислоты или фрагменты, состоящие из нескольких аминокислот. При этом образуется смесь аминокислот и пептидов. Извлечение из этой смеси какой- либо определенной аминокислоты — довольно сложная, но тем не менее выполнимая задача.
Само по себе сырье (мясо и белок молока — казеин) — дорогостоящий продукт, и этот метод применяется, когда имеют дело с «бросовым» сырьем, т.е. с отходами производства (таким сырьем являются рога, копыта, волосы, перья и пух, состоящие из кератина, в котором содержится очень много серосодержащей кислоты цистеина, и — в небольших количествах — других аминокислот).
Следующий способ получения чистых аминокислот — химический синтез. Их синтезируют подобно другим органическим кислотам, это не сложно. Однако в процессе химического синтеза получается смесь D- и L-стереоизомеров (иногда получается и большее количество изомеров), а как известно, в белках человека биологически активны только L-стереоизомеры аминокислот, поэтому существуют трудности разделения этих изомеров. Кроме того, химическое производство аминокислот, как правило, связано с использованием дорогостоящего оборудования и нередко агрессивных токсических соединений в качестве исходного сырья. Процесс протекает при высокой температуре, требует дорогостоящих катализаторов и как всякое химическое производство сопровождается образованием побочных продуктов, загрязняет окружающую среду, небезопасно и небезвредно для обслуживающего персонала.
Тем не менее некоторые аминокислоты получают химическим синтезом, например глицин, а также D-, L-метионин, D-изомер которого малотоксичен, поэтому медицинский препарат на основе метионина содержит D- и L-формы, хотя за рубежом в медицине используется препарат, содержащий только L-форму метионина. Там рацемическую смесь метионина разделяют биоконверсией D-формы в L-форму под влиянием специальных ферментов живых клеток микроорганизмов.
Следующий способ получения аминокислот — химико-энзиматический, как видно из названия, этот метод получения аминокислот предполагает два этапа. Сначала химическим методом синтезируется «предшественник» — соответствующая карбоновая кислота, а затем эта карбоновая кислота (обычно в присутствии аммиака) превращается в соответствующую аминокислоту. Эта биотрансформация (биоконверсия) осуществляется ферментами живых клеток. Причем полученные L-стереоизомеры аминокислот сами по себе необходимы для жизнедеятельности этих клеток, т. е. фактически этот способ наполовину биотехнологический. Таким методом получают, например, аспарагиновую кислоту (на основе фумаровой кислоты). Раствор фумаровой кислоты пропускают через колонки, в которых иммобилизованы или ферменты, или клетки микроорганизмов с высокой активностью аспартазы, например, Escherichia coli или Serratia marcesceus; туда же подается аммиак и осуществляется биотрансформация.
Аналогичным образом на основе коричной кислоты получают фенилаланин (L-стереоизомер):
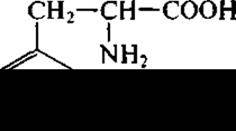
используя для этого дрожжевые клетки. Химико-энзиматически можно производить практически все аминокислоты, однако из-за дороговизны и сложности получения соответствующих органических кислот-предшественников этот метод не всегда экономически выгоден и в большинстве случаев уступает методу прямого микробиологического синтеза.
Четвертый способ получения аминокислот — их прямой микробиологический синтез — целиком основан на использовании биообьектов (т.е. является полностью биотехнологическим). В качестве биообъектов в нем применяются штаммы-продуценты аминокислот. Этим методом аминокислоты чаще всего получают на основе Escherichia coli (кишечная палочка — симбионт человека), Bacillus subtilis (сенная палочка — почвенный микроорганизм) и Corynebacterium glutamicum (почвенный микроорганизм).
Все эти микроорганизмы на сегодняшний день прекрасно изучены. Известна полная нуклеотидная последовательность всего их генома. Для кишечной палочки разработаны многообразные способы генетического обмена, позволяющие легко комбинировать разные гены и изменять процесс метаболизма. В меньшей степени это относится к Bacillus subtilis, и еще в меньшей степени к Corynebacterium glutamicum.
Использование этих микроорганизмов для получения аминокислот основано на их способности самостоятельно синтезировать все 20 аминокислот. Также они являются гетеротрофными бактериями, которые в качестве источника углерода используют органические соединения (углевод или какую-нибудь органическую кислоту), а все остальные компоненты получают из неорганических соединений.
Применение микроорганизмов гетеротрофов позволяет существенно сократить по времени процесс ферментации. Так, кишечная палочка в богатой питательной среде делится каждые 20— 30 мин, коринебактерии — каждый час. В бедных средах — время регенерации в два раза больше (1 ч для кишечной палочки, 1,5 — 2 ч для коринебактерий и сенной палочки).
Вместе с тем существуют бактерии, так называемые ауксотрофные мутанты — микроорганизмы, которые, с одной стороны, утратили способность самостоятельно синтезировать необходимые для построения всех компонентов своей клетки разные аминокислоты, а с другой — приобрели способность к сверхсинтезу целевой аминокислоты. Такие мутанты получают либо воздействием различных мутагенов физической и химической природы на исходную культуру микроорганизма с последующей селекцией штамма по заранее заданным признакам, либо методами генной инженерии.
Известно, что клетки бактерий синтезируют аминокислоты для удовлетворения собственных потребностей (синтез белка и другие метаболические процессы); синтезируется их в клетках бактерий определенное количество. В процессе эволюции (естественного отбора) выживали только те формы, в которых метаболические процессы протекали наиболее экономно, и это обеспечивалось за счет механизмов регуляции этих процессов.
Известно, что в регуляции и управлении метаболическими процессами используется принцип обратной связи. Существуют два уровня (механизма) регуляции биосинтеза конечного (целевого) продукта — ретроингибирование и репрессия. На первом уровне образующаяся в цепи последовательных реакций аминокислота ингибирует активность одного из начальных ферментов собственного синтеза. Если этого механизма недостаточно и конечный продукт (аминокислота) все равно присутствует в избытке, то включается второй механизм регуляции и в результате подавляется (репрессируется) образование всего комплекса ферментов соответствующей биосинтетической цепи. На примере биосинтеза аминокислоты треонина:
![]()
можно показать, как реализуются эти принципы в клетках кишечной палочки. Треонин, а также лизин и метионин относятся к семейству аспарагиновой кислоты. В клетках бактерий сначала синтезируется аспарагиновая кислота:
![]()
а затем на ее основе синтезируются треонин, метионин и лизин (поэтому они и объединены в семейство аспарагиновой кислоты). Синтез каждой из этих аминокислот осуществляется в несколько этапов с образованием промежуточных соединений. Каждый из этих этапов катализируется белком-ферментом, синтез которого контролируется (кодируется) соответствующим геном, в нуклеотидной последовательности которого записана структура этого белка.
Первая реакция синтеза этих аминокислот — превращение аспарагиновой кислоты в аспартил-фосфат под влиянием фермента аспартокиназы (киназы — ферменты, «навешивающие» фосфорную группу).
Следующий этап — превращение аспартил-фосфата в полуальдегид аспарагиновой кислоты (промежуточное соединение). Эту реакцию катализирует фермент дегидрогеназа полуальдегида аспарагиновой кислоты. Ген, контролирующий синтез этого фермента, локализуется в другом участке хромосомы и называется ASD. Под влиянием фермента гомосерин-дегидрогеназы, кодируемого геном треонин А-2, синтезируется гомосерин, который является предшественником для синтеза треонина и метионина. В свою очередь гомосерин под влиянием фермента гомосерин-киназы превращается в гомосерин-фосфат (ген, кодирующий эту реакцию, — треонин В). И, наконец, гомосерин-фосфат под воздействием фермента треонин-синтетазы превращается в треонин. Ген, кодирующий образование (синтез) этого фермента, — треонин С. При добавлении в среду пирувата из треонина образуется изолейцин (рис. 15).
Все структурные гены в хромосоме кишечной палочки расположены в определенной последовательности в общей регуляторной области, которая включает промотор (участок связывания PHК-полимеразы, которая считывает информацию, в результате чего образуется информационная РНК, которая затем присоединяется к рибосомам и транслируется, при этом образуется каждый из указанных белков-ферментов) и так называемый аттенуатор — регуляторный элемент, который воспринимает сигналы обратной связи.
Необходимо подчеркнуть, что синтез треонина происходит одновременно с ростом биомассы и после остановки ее роста синтез треонина замедляется и постепенно прекращается (рис. 16, кривая I). Регулируется биосинтез треонина в клетках кишечной палочки следующим образом: когда треонин в клетках бактерий накапливается в количестве большем, чем его нужно для метаболических процессов и синтеза белка, и появляется в свободном состоянии, — он подавляет активность фермента аспартокиназы. Фермент аспартокиназа — аллостерический фермент (alios — другой), имеющий кроме активного центра еще один, так называемый аллостерический центр, который может взаимодействовать с низкомолекулярными эффекторами. И таким эффектором в данном случае является треонин. При присоединении к аллостерическому центру треонин изменяет конформацию аспартокиназы, в результате чего активный центр становится недоступным для субстрата, и фермент утрачивает активность.
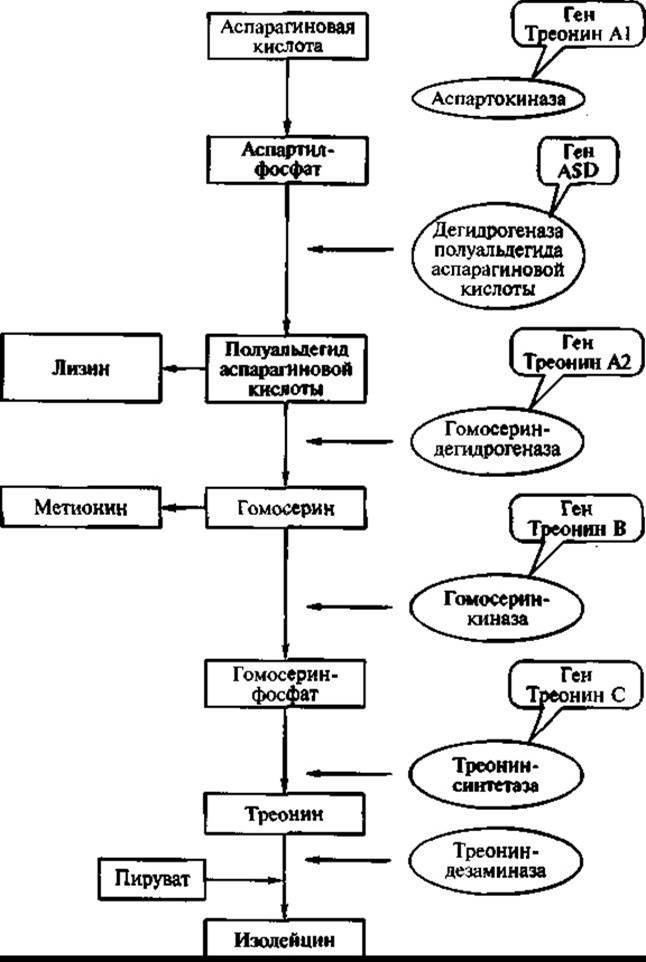
Рис. 15. Схема биосинтеза треонина у бактерий Escherichia coli
В свою очередь подавление активности аспартокиназы ведет к прекращению синтеза аспартил-фосфата и, соответственно, прекращается синтез всех промежуточных соединений пути биосинтеза треонина.
Когда одного механизма оказывается недостаточно и треонин продолжает накапливаться в избытке, у кишечной палочки включается еще один механизм регуляции биосинтеза — репрессия. При этом, если треонин накапливается в избытке, он превращается в изолейцин, который, в свою очередь, также накапливается в избытке. В тот момент, когда треонин и изолейцин накапливаются в избытке одновременно, они опосредованно взаимодействуют с аттенуатором и подавляют транскрипцию, вызывая ее терминацию. В этом случае синтез всех белков-ферментов данного синтетического пути прекращается.
Как уже отмечалось, у природных микроорганизмов контроль за скоростью биосинтеза аминокислот исключает их перепроизводство, поэтому выделение аминокислот из клетки в среду возможно лишь у культур с нарушенной системой регуляции. Советскими учеными в конце XX в. был создан штамм-суперпродуцент треонина. Использование его в промышленных масштабах позволило увеличить синтез треонина до 100 г/л, а время ферментации сократилось до одних суток.
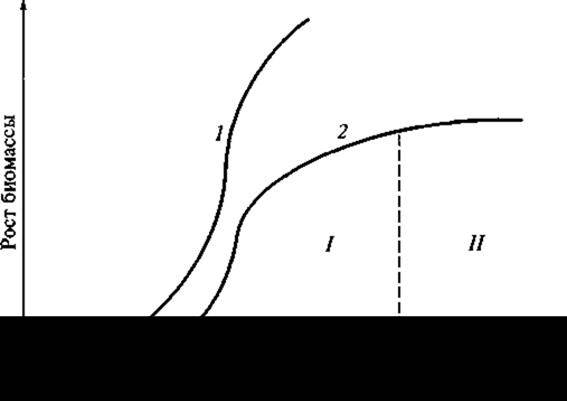
Рис. 16. Зависимость синтеза треонина и лизина от роста биомассы: I — треонин; 2 — лизин (I, II — стадии процесса)
В промышленном производстве лизина в настоящее время используется штамм-суперпродуцент коринебактерий (Corynebacterium glitamicum). Продолжительность ферментации 2 — 3 сут. Уровень накопления целевого продукта составляет 50— 100 г/л.
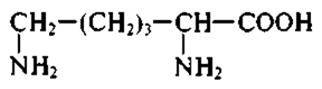
Коринебактерии являются грамположительными, более древними в эволюционном отношении микроорганизмами, отличаются от грамотрицательной кишечной палочки также тем, что у них очень низкая активность внутриклеточных протеиназ, поэтому синтезированные клеткой белки-ферменты долго остаются в активном состоянии.
Схема биосинтеза лизина представлена на рис. 17. У штамма Corynebacterium glitamicum существует только один механизм регуляции биосинтеза по принципу обратной связи — совместное (согласованное) ретроингибирование активности аспартокиназы. Это единственный фермент, активность которого регулируется совместно треонином и лизином. Когда треонин и лизин одновременно избыточно накапливаются в клетке, они вместе присоединяются к аллостерическому центру; в результате, активность аспартокиназы подавляется, и этот биосинтетический путь блокируется.
Итак, синтез лизина контролируется треонином и лизином, а чтобы получить штамм-суперпродуцент лизина, нужно «убрать» треонин, так как треонин и лизин, находясь в избытке, подавляют активность аспартокиназы. Поэтому нужно блокировать синтез треонина. Для этого необходимо получить мутацию, блокирующую этот ген, но в этом случае в питательную среду необходимо добавлять чистый треонин (так как большинство продуцентов лизина неспособны синтезировать гомосерин или треонин — они являются «ауксотрофами» по этим аминокислотам).
Если блокировать в другом месте цепи биосинтеза, то мутант будет нуждаться в метионине и треонине, тогда в среду добавляют гомосерин. Если добавить в среду треонин и метионин в ограниченном количестве, то штамм будет расти до тех пор, пока они не будут израсходованы, но в клетках этого штамма будут присутствовать также ферменты, необходимые для синтеза лизина, которые длительно сохраняются в клетках коринебактерии в активном состоянии. И штамм начнет синтезировать лизин, т. е. синтез лизина штаммом Corynebacterium glutamicum будет осуществляться, только когда исчерпан треонин. Экспериментально подбирают такое количество треонина и метионина, которое при внесении в питательную среду обеспечило бы максимальный синтез лизина. Как только треонин исчезает из среды и рост биомассы прекращается, начинается активный синтез лизина. Таким образом, данный процесс имеет две стадии развития: рост биомассы и синтез лизина (рис. 16, кривая 2).
Биотехнологи при разработке микробиологической технологии получения аминокислот в процессе культивирования продуцентов подбирают такие условия, при которых скорость синтеза аминокислоты клетками продуцента являлась бы максимально высокой и сохранялась максимально долго, а также образование побочных продуктов биосинтеза сводилось бы к минимуму.
Максимально высокая скорость синтеза достигается при создании оптимальных условий выращивания высокоактивной биомассы. Для этого в ферментере поддерживаются определенные (оптимальные) концентрации источников углерода, аммонийного азота, минеральных солей, ростовых факторов, pH и температура.
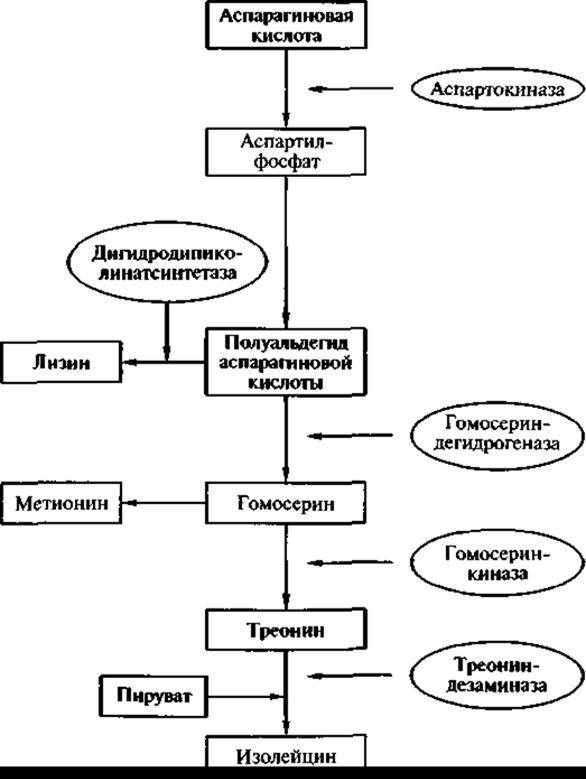
Рис. 17. Схема биосинтеза лизина у коринебактерий
Все процессы с высоким уровнем накопления аминокислоты (порядка 50—100 г/л) ведутся при дробной подаче субстратов — источников углерода и азота. В качестве источников углерода при биосинтезе аминокислот используют углеводы или органические кислоты (например, ацетат), а в качестве источника азота, необходимого для построения аминогруппы, — аммонийные соли и аммиак.
Несмотря на то, что аминокислоты в целом нейтральны, в процессе их биосинтеза происходит сильное закисление среды вследствие нарушения ионного баланса культуральной жидкости. Дело в том, что микроорганизмы-продуценты преобразуют ионы аммония NH4, присутствующие в питательных средах в форме аммонийных солей (NH4CI, (NH4)2SО4 И др.), в аминные группы аминокислоты. При этом в среде остаются несбалансированными «лишние» радикалы Cl-, SО2-4. Для поддержания в среде оптимальной концентрации ионов аммония и оптимальной величины pH биосинтез аминокислот ведут при автоматическом рН-статировании аммиаком.
Оптимальную концентрацию источников углерода в среде можно поддерживать, подавая в ферментер раствор углеводов с той скоростью, которая отражает темп потребления сахаров культурой продуцента. При промышленном производстве аминокислот широко применяют также автоматический режим подачи углеводов по сигналу от датчика pH. При этом рН-статирование ведут не аммиаком или аммиачной водой, а смесью аммиачной воды и углеводов. При правильном выборе соотношения между ними на постоянном уровне поддерживается концентрация не только ионов аммония, но и источников углерода.
Для ауксотрофов типа продуцента лизина чрезвычайно важным параметром является начальная дозировка в среде источников ростовых факторов (тех аминокислот, которые штамм не может синтезировать самостоятельно). Их избыток приводит к угнетению биосинтеза; при их дефиците концентрация клеток продуцента в ферментере будет недостаточна для обеспечения высокой скорости накопления аминокислоты. Поэтому у продуцентов, аналогичных продуценту лизина, существует оптимальная концентрация ростовых факторов. Эта величина не постоянна. Она может варьировать в зависимости от сырья, аэрационных возможностей аппаратуры, температуры культивирования.
Процессы биосинтеза аминокислот являются энергоемкими, в связи с чем ферментация при получении аминокислот обязательно должна проводиться в аэробных условиях при интенсивной аэрации и перемешивании, обеспечивающих скорость растворения кислорода 3 — 7 г/(л ∙ ч).
После образования в ферментере активной биомассы, синтезирующей аминокислоту, необходимо создать условия, при которых клетки микроорганизмов «работали» бы как можно дольше. В процессе биосинтеза по разным причинам они теряют жизнеспособность, и для продления активного участка ферментации применяют разные методы. В частности для ауксотрофных продуцентов аминокислот (например, продуцента лизина) продолжительность биосинтеза и выход целевой аминокислоты могут быть увеличены, если по ходу ферментации в питательные среды вносить подпитки, содержащие источники углерода в смеси с источниками ростовых факторов (белковыми гидролизатами).
Синтез целевой аминокислоты может прекращаться из-за воздействия на продуцент токсичных метаболитов синтезируемых самим же продуцентом. Примером сказанному может служить биосинтез фенилаланина продуцентом Bacillus subtilis. Бациллярные продуценты в процессе роста на средах с углеводами синтезируют ацетоин и бутандиол - вещества, необходимые клеткам для образования спор. При этом клетки начинают лизировать, спороваться и прекращают вырабатывать фенилаланин.
Избежать накопления побочных примесей удается, если процесс ферментации ведут, лимитируя источник углерода. Раствор сахара, служащий для этого продуцента источником углерода, подают в среду с постоянной скоростью, но меньшей, чем скорость его утилизации культурой. Вследствие этого в культуральной среде поддерживается очень низкая «фоновая» концентрация источника углерода, и весь подаваемый сахар расходуется на синтез фенилаланина. В результате рабочий цикл ферментации возрастает в 1,5—2 раза, а доля примесей (не только ацетоина, но и побочных аминокислот) снижается. При этом выход фенилаланина и конверсия источника углерода в целевую аминокислоту увеличивается почти в два раза.
Эффективность использования субстрата при биосинтезе целевой аминокислоты зависит также от продуктивности биомассы. Если синтез аминокислоты разобщен с ростом биомассы (как у продуцента лизина), то эффективность использования субстрата будет тем выше, чем дольше культура будет работать после остановки роста. Если же синтез идет параллельно росту (как у продуцента треонина), то продуктивность биомассы можно увеличить, перераспределив потоки субстратов внутри клетки, расширяя поток предшественников на биосинтез аминокислоты, одновременно сужая все остальные потоки. Однако не всегда этого удается достичь с помощью таких технологических приемов, как в примере с продуцентом фенилаланина.
Для этой цели наиболее действенны методы генетической инженерии — введение в клетку микроорганизма многокопийных гибридных плазмид, содержащих гены, контролирующие биосинтез аминокислоты, что приводит к увеличению количества соответствующих ферментов в клетке. У генно-инженерных продуцентов ферментативная система действует наподобие «вакуумного насоса», мобили зующего все ресурсы клетки на образование целевой аминокислоты в ущерб росту биомассы и синтезу других клеточных компонентов. При введении гибридных плазмид побочные примеси, как правило, автоматически исчезают, при этом продуктивность биомассы и коэффициент использования субстрата существенно возрастают.