Практическая химия белка - А. Дарбре 1989
Аффинная хроматография белков
Примеры
Выделение и очистка антител
Аффинная хроматография успешно применяется для выделения и фракционирования популяции антигенов, характеризующихся структурной гетерогенностью. Например, после гипериммунизации кролика обработанными формалином микроорганизмами Pneumococcus (штамм VIII) были получены антитела, специфические к антигену клеточной стенки, и синтезирован ряд иммунных сорбентов на основе полисахарида из клеточных стенок. Наиболее простой способ получения сорбента заключается в конденсации полисахарида с сефарозой 4В после введения аминогрупп в одно из этих соединений, имеющих полисахаридную природу. Активация бромоцианом неаминированного компонента и его взаимодействие с полиаминопроизводным приводит к получению сорбента. Обработка таких сорбентов в кислой и щелочной средах позволяет получить ряд аффинных сорбентов, которые могут быть использованы для разделения различных популяций антител.
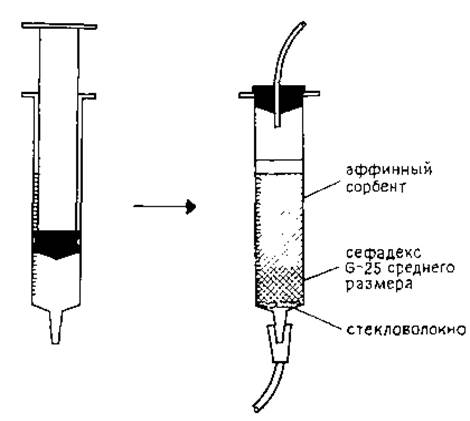
РИС. 5.3. Простой способ изготовления колонки для аффинной хроматографии.
В то же время было показано, что прямая конденсация нативного антигена па носителе приводит к получению сорбента со слишком сильным сродством и элюирование антител возможно только в жестких условиях [4], например в присутствии 6 М гуанидин-HCl. В таких условиях наблюдается денатурация или нежелательные изменения в структуре антител. Для уменьшения сродства аффинных сорбентов в качестве исходного материала целесообразно использовать клеточные стенки родственных микроорганизмов, дающих перекрестную реакцию с исследуемым микроорганизмом, или изменить структуру исходного полисахарида путем обработки в кислых или щелочных условиях, аминированием и т. п.
На рис. 5.2 приведен простой способ изготовления аффинной колонки на основе обыкновенного шприца объемом 5 мл. Стенки шприца обрабатывают ацетоном, резиновый наконечник поршня используют в качестве верхней насадки. Перед заполнением колонки аффинным сорбентом (3 мл) на слой стекловолокна помещают 2 мл сефадекса G-25 среднего размера. Слой сефадекса препятствует смешиванию аффинного сорбента со стекловолокном.
Полученный сорбент проверяют на примере хроматографии функции иммуноглобулинов, выделенной из сыворотки путем высаливания сульфатом аммония. Элюирование специфически сорбированных антител проводят, последовательно сменяя различные буферные растворы. С целью оценки эффективности полученного аффинного сорбента на каждой стадии подсчитывают выход иммуноглобулинов. Для постепенной десорбции различных фракций: антител обычно используют плавный градиент концентрации соли, гаптена или обоих компонентов. На завершающем этапе сорбент, как правило, промывают кислотным буфером (0,2 М глицин-НСl, pH 2,2) или растворами 6 М мочевина-HCl или 4 М гуанидин-HCl. Следует обратить внимание па необходимость немедленной нейтрализации и промывки сорбента после элюирования, а также нейтрализации и диализа полученных белковых фракций.
Концентрированные солевые растворы, например 3 М NaCI, не относят к специфическим элюентам, по они могут быть использованы для ослабления электростатических взаимодействий между антителами и иммобилизованным на носителе антигеном. В качестве более специфичных элюентов используют гаптены, например моносахариды (фукоза, манноза), дисахариды (целлобиоза, лактоза) или смесь олигосахаридов, полученных в результате мягкого кислотного гидролиза полисахарида.