Практическая химия белка - А. Дарбре 1989
Разделение смесей белков и пептидов методом высокоэффективной жидкостной хроматографии
Гель-хроматография
Химические факторы
Гели на основе полисахаридов или полиакриламида, используемые в обычной гель-фильтрации, очень слабо взаимодействуют с белками и пептидами. Иная картина наблюдается при работе на носителях, применяемых в ВЭЖХ.
На поверхности сорбентов на основе диоксида кремния присутствуют кислые силанольные группы, которые могут взаимодействовать как с положительно заряженными группами белка, вызывая его адсорбцию, так и с отрицательно заряженными группами, что приводит к отталкиванию молекул белка. В результате таких взаимодействий снижается эффективность проникновения молекул в поры геля. Для предотвращения этого силанольные группы модифицируют нейтральными соединениями, содержащими гидрофильные цепи. Обычно модификация бывает неполной, и поэтому непрореагировавшие силанольные или другие заряженные группы влияют на элюирование белка, и степень этого влияния зависит от состава подвижной фазы и рI данного белка.
В настоящее время чаще всего используются колонки двух фирм Waters (колонки для анализа белка 1-60, 1-125, 1-250) и Toyo Soda серии TSKSW (2000, 3000, 4000), продаваемые по лицензиям многими фирмами. Кроме того, существуют колонки Synchropak GPC (Synchrom), Lichrosorb и Lichrosphere DIOL (Merck), Glycophase GPC (Pierce), Aquapore-OH (Brownlee). Superose (Pharmacia) и Spheron (Lachema).
Проводилась оценка колонок с учетом влияния химических факторов, особенно в отношении сорбента Synchropak [19]. Опубликованы результаты детального исследования колонок Lichrospere DIOL [27]. Выводы, полученные при изучении этих колонок, в разной степени применимы к колонкам других фирм. Следует иметь в виду, что для предотвращения разрушения носителя колонки на основе диоксида кремния следует использовать только при 2<рН<7,7.
Влияние ионной силы на объемы элюирования четырех белков, имеющих разные рI, показано на рис. 6.1. Хроматографическому разделению подвергались пепсин (рI 1), лизоцим (рI 11,0), овальбумин (рI 4,7), химотрипсиноген (рI 9,5); работа проводилась на Lichrosphere DIOL при pH 5. По мере увеличения ионной силы снижалось влияние ионного отталкивания на кислый белок пепсин и ионной адсорбции — на основные белки-химотрипсиноген и лизоцим, тогда как объем элюирования овальбумина (рI 4,7) остался неизменным. Для солей, создающих более высокую ионную силу (при одинаковых молярных концентрациях), подавление ионных эффектов носителя выражено сильнее, чем для растворов с меньшей ионной силой (например, фосфат более эффективен по сравнению с ацетатом).
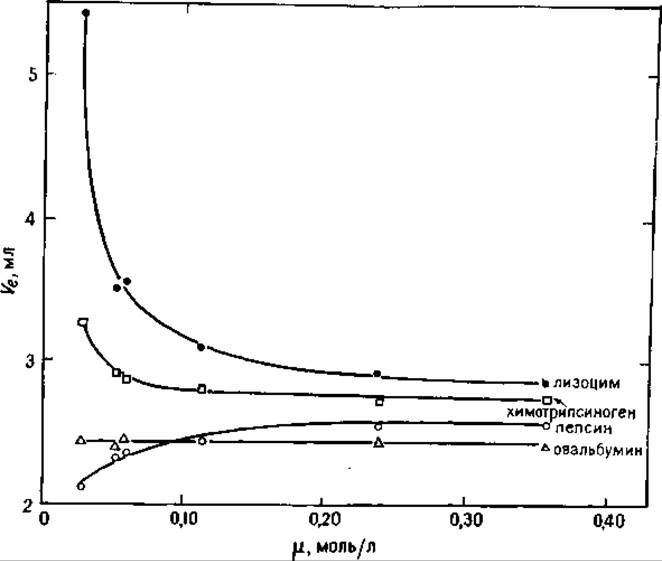
РИС. 6.1. Влияние ионной силы на объемы элюирования белков с различными значениями рI при гель-хроматографии на колонке Lichrosorb DIOL. Ионную силу создавали при помощи ацетата и сульфата натрия при pH 5 [27].
При отсутствии взаимодействия между сорбентами и белком должна наблюдаться линейная зависимость между логарифмом молекулярной массы и объемом элюирования, что подтверждается для колонки Lichrosphere DIOL (рис. 6.2) [27]. В этом случае анализ проводили в растворе с ионной силой μ = 0,36 моль/л. Изданных, представленных па рис. 6.2, следует, что лизоцим и химотрипсиноген при указанной ионной силе элюируются в объеме, не соответствующем общей закономерности [27]. Такое отклонение отчасти можно объяснить гидрофобными взаимодействиями, так как добавление этиленгликоля к подвижной фазе снижает Ve. Наблюдаемое аномальное элюирование цитохрома с и гемоглобина связано с агрегацией белков. Так, для цитохрома с (0,05 М фосфат натрия, 0,1 М хлорид натрия, pH 7,5) Ve соответствует М 12,5∙103, тогда как при pH 5 (0,1 М ацетат натрия) Vе коррелирует с М 20∙103. Для сравнения приведены также градуировочные графики для разделения некоторых эталонных белков (с указанием условий разделения) на колонках Synchropak GPC, Waters (серия I), Toyo Soda (рис. 6.3—6.5).
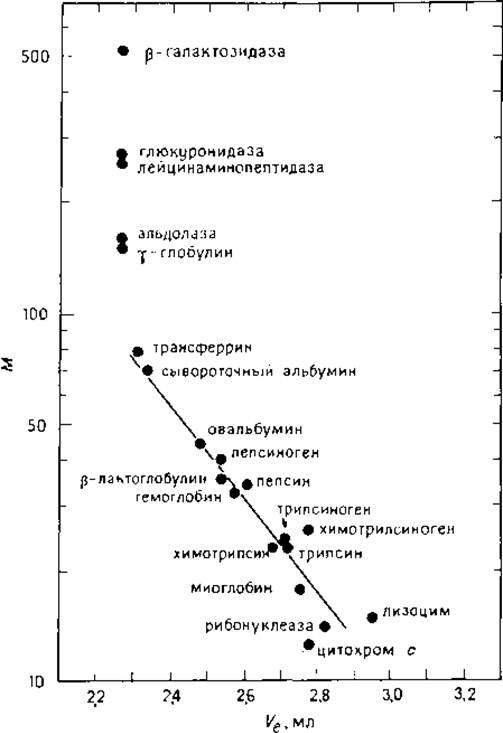
РИС. 6.2. Корреляция объемов элюирования и кажущихся молекулярных масс разных белков при гель-хроматографин. Условия анализа см. в подписи к рис. 6.1 (ионная сила 0,36 моль/л) [27].

РИС. 6.3. Градуировочные графики, полученные при гель-хроматографии белков на колонках Synchropak ТРС 100 (о) и 500 (б). Элюент — 0,1 М КН2РО4 (pH 7); скорость потока 0,5 мл/мин [19].
Зная природу сил физического и химического взаимодействия белков с поверхностью носителя и учитывая факторы, влияющие на кажущиеся величины молекулярных масс М белков в растворе, можно определять на колонках (при неденатурирующих условиях) кажущиеся М белков с точностью до ~ 10%. В этих условиях при достаточно высоких выходах белка сохраняется его биологическая активность.