Практическая химия белка - А. Дарбре 1989
Аналитические методы
Колоночная хроматография аминокислот
Определение аминокислот
8.16.3.1. Постколоночная модификация. До начала 70-х годов элюирующиеся с ионообменной колонки аминокислоты детектировались реакцией с нингидрином, смешивание с реагентом проводилось в послеколоночном реакторе с последующим прохождением раствора через нагретую спираль. Интенсивность образующейся окраски измерялась сначала в одном колориметре при 570 нм, а затем в другом, где при 440 нм определялась концентрация пролина и гидроксипролина.
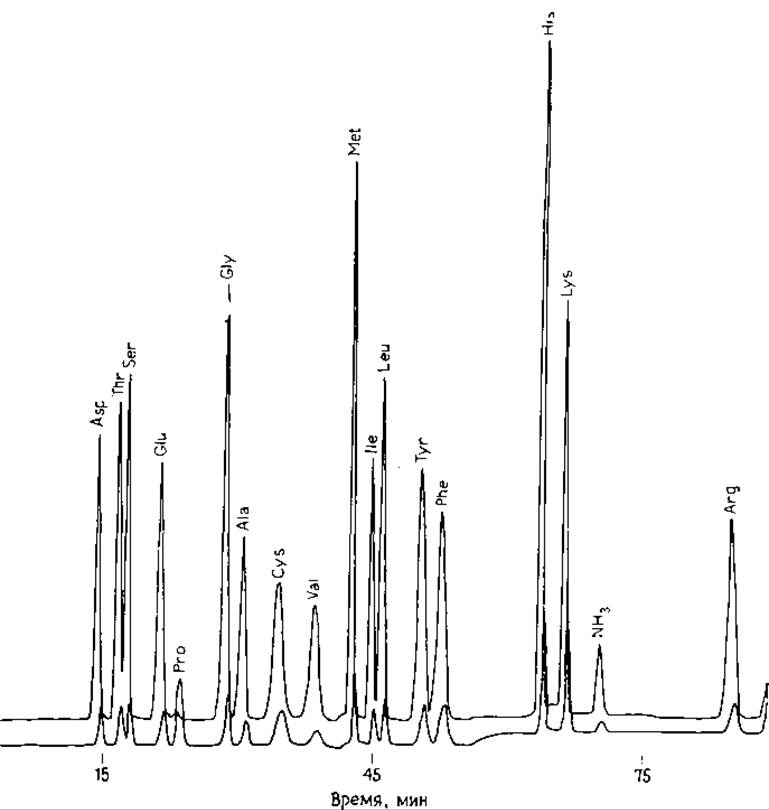
РИС. 8.4. Разделение аминокислот ионообменной хроматографией и одноколоночной системе. Колонка (6X460 мм), заполненная смолой типа W-З до высоты 220 мм. Натрийцитратные буферы: pH 3,25 (0,2 М Na+, с 1%-ным пропанолом-2; pH 3,95 (0,4 М Na+); pH 6,4 (1,0 М Na+). Температура 50—60 °С. Скорость потока 44 мл/ч (буфер), 22 мл/ч (нингидрин). Кювета 12 мм. Вся шкала 2,0 А. Смесь аминокислот для построения градуировочного графика (50 нмоль каждого компонента в 100 мкл). С разрешения фирмы Beckman.

РИС 8 5 Одноколоночное разделение аминокислот (гидролизат гликопротеина). Анализатор фирмы Beckman, модель 119Cl. Колонка (6X460 мм), заполненная смолой типа W-3H до высоты 370 мм. Na-цитратные буферы фирмы Beckman: pH 3,33 (0 20 М Na+); pH 4,25 (0,20 М Na+); pH 6,04 (1,0 М Na+). Температура 30 и 60°С. Скорость потоков 30 мл/ч (буфер), 15 мл/ч (нингидрин). Кювета 12 мм. Вся шкала 0,5 А. Объем образца 100 мкл. Концентрация (нмоль) каждого компонента указана в скобках над пиком. С разрешения фирмы Beckman.
В 1972 г. в качестве селективного флуорогенного реагента на первичные амины был предложен флуорескамин [375], а несколько позднее он стал использоваться для модификации аминокислот после их выхода с колонки аминокислотного анализатора. Получаемая при этом чувствительность определения в 10—100 раз превышала возможности нингидринового метода [21]. Для измерений применялся флуориметр с длиной волны возбуждения 340 нм и эмиссией при 450 нм. Широкому распространению флуорескамина помешали его нестабильность в водных средах и высокая стоимость. Этих недостатков лишен введенный в практику почти одновременно с флуореcкамином [320] о-фталевый альдегид (ОФА), вытеснивший в значительной степени флуорескамин и применявшийся в аминокислотных анализаторах многими исследователями. Образование флуоресцирующего производного с ОФА с максимумом возбуждения при 360 нм и максимумом эмиссии при 455 нм происходит при pH 9—11. Лизин дает слабую флуоресценцию, усиливающуюся при добавлении реагента бриджа. Цистеин реагирует только в присутствии иодоуксусной кислоты [78], а цистин лучше определять в виде цистеиновой кислоты после окисления надмуравьиной кислотой. Пролин, гидроксипролин и вторичные амины вступают в реакцию только после окисления хлорамином-Т, N-сукцинимидом или гипохлоритом [33, 178, 321]. Если нет необходимости определять пролин и гидроксипролин, то безусловно выгодно использовать ОФА; чувствительность определения производных достигает 5 пмоль, для нингидрина она составляет 100 пмоль, как для первичных, так и для вторичных аминогрупп. Среднее относительное стандартное отклонение для аминокислот равно 6% (разброс 3—24%) [85].
Более поздние методы определения аминокислот с постколоночной модификацией основаны на использовании таких флуорогенов, как 7-хлоро-4-нитробензо-2-окса-1,3-диазол, позволяющий обнаружить все аминокислоты, включая пролин и гидрооксипролин, на уровне 1 пмоль [415], и 4-фторо-7-нитробензо- 2,1,3-оксадиазол [391] с пределом обнаружения 5 пмоль для пролина и 20 пмоль для других аминокислот.
8.16.3.2. Предколоночная модификация. Применение постколоночной модификации сопряжено с техническими трудностями осуществления смешивания каждой разделяемой аминокислоты в элюате с раствором реагента в соответствующих, оптимальных для реакции условиях. Провести предколоночную обработку аминокислот реагентами проще, а полученные соединения могут быть разделены с помощью ОФ-ВЭЖХ, но по имеющимся данным, воспроизводимость результатов уступает достигаемой в постколоночном методе. Наиболее изученные производные аминокислот — фенилтиогидантоины — продукты деградации пептидов по методу Эдмана (гл. 13) не использовались непосредственно для анализа аминокислот, хотя детально разработаны несколько методов их идентификации, в том числе ВЭЖХ [186, 420]. Методом ВЭЖХ за 30 мин разделяются также окрашенные аналоги ФТГ — диметиламиноазобензолтиогидантоины [412] (см. гл. 14).
Обзор по прсдколоночной модификации аминокислот и пептидов с последующим разделением производных ВЭЖХ см. в работе [360].
Дансиламинокислоты. Для идентификации дансиламииокислот при определении аминокислотной последовательности белков широко используется метод тонкослойной хроматографии (гл. 10 и 11). Недавно дансильные производные были успешно разделены па колонках с обращенной фазой [15, 152, 167, 202, 330, 340, 363, 394, 403]. Чувствительность обнаружения составляет 100 пмоль при спектрофотометрическом и несколько фемтамолей при флуоресцентном [15, 202] или хемилюминесцентном определениях [166, 200].
Дансильные производные при анализе аминокислот не дают результатов, сравнимых с получаемыми при использовании ОФА. Один из недостатков дансилирования состоит в том, что для одной аминокислоты возникает несколько пиков, например пик О-дансилтирозина и O,N-дидансилтирозина наряду с пиком N-дансилтирозина. Преимущество же состоит в возможности одновременной с другими аминокислотами идентификации пролина и гидроксипролина. Было предложено применять [403] дансильные производные аминокислот для анализа состава пептидов с высокой степенью чувствительности и для количественного определения N- и С-концевых остатков, в частности С-концевых остатков амидов аминокислот, отщепленных ферментативными методами от амидированных пептидов на уровне 50 пмоль с УФ-детекцией [340]. d- и L-изомеры дансиламино- кислот разделены методом ВЭЖХ [209, 208].
Производные с о-фталевым альдегидом. о-Фталевый альдегид реагирует с аминокислотами в присутствии ß-меркаптоэтанола при 25 °С с образованием замещенного изоиндола [341]. Соединения, не содержащие а-водородного атома, дают флуоресцентный сигнал, составляющий по интенсивности <1% флуоресценции эквивалентного количества глицина [83], для цистина эта величина составляет 3%, даже если реакция проводится при 100 °С [84].
В присутствии меркаптоэтанола реакция ОФА с первичными аминогруппами завершается за 0,1—1,0 мин, но образующиеся производные глицина, лизина, гидроксилизина и фосфосерина имеют период полупревращения 1—4 мин [374]. Была изучена стабильность ОФА-2-меркаптоэтанолпроизводных аминокислот [80] и проведено их разделение методом ВЭЖХ за 22 мин [79]; показано, что разрушение продуктов может быть сведено к минимуму при быстром введении в колонку. Интенсивность флуоресценции для лизина и гидроксилизина повышается до 40—50% при добавлении к реакционному раствору реагента бридж-35. Цистин может быть определен количественно в виде цистеиновой кислоты и карбоксиметилцистеина.
Вторичные аминокислоты (пролин и гидроксипролин) не взаимодействуют с ОФА непосредственно, но при их окислении гипохлоритом образуются первичные аминогруппы, вступающие в реакцию. Эти аминокислоты могут быть определены также после модификации 4-хлоро-7-нитробензофураном (НБФ) [376]. Прекрасные результаты были получены при разделении ОФА производных аминокислот методом ВЭЖХ с флуорометрическим детектором [79, 160, 161, 163, 187—189, 210, 219, 376].
Новые возможности не только для повышения чувствительности определения, но и селективности обнаружения некоторых производных, например основных аминокислот [191], открывает применение электрохимических детекторов.
Автоматизация анализа флуорогенных соединений предъявляет повышенные требования к их устойчивости, которым не удовлетворяют аддукты ОФА-меркаптоэтаноламинокислоты. Более длинный период полупревращения имеют ОФА-этантиольные производные. Хотя падение интенсивности флуоресценции на 20—50% за 6—8 ч наблюдается и у этих соединений [342], процесс их синтеза и последующего разделения в автоматическом варианте был опробован при исследовании аминокислот плазмы [111].
В 1984 г. описан [74] автоматический рутинный метод анализа ОФА-производных аминокислот на колонке Altex Ultrasphere ODS (250x4,6 мм) с размером частиц 5 мкм с предколонкой Brownlee, заполненной сорбентом C18(5 мкм). В этой системе без смены носителя удалось проанализировать более 2000 образцов.
ОФА был введен в программу автоматического анализа аминокислотной последовательности на секвенаторе для блокирования а-аминогрупп «остаточных» пептидов, когда пролин становится N-концевым в определяемой последовательности [41].
Реагенты для модификации с помощью ОФА.
OФА-реагент [214]. Растворяют 62 г борной кислоты и 25 г КОН в 900 мл воды. Подщелачивают до pH 10,4 45%-ным КОН и доводят до объема 1 л. Фильтруют через мембрану Millipore 0,22 и добавляют 2 мл меркаптоэтанола, 6 мл 30%-ного (масс./об.) бридж-35 и 1,2 г ОФА, растворенного в 15 мл метанола. Выдерживают в течение ночи в темноте под азотом при комнатной температуре. Реагент стабилен в течение 1 мес под азотом при 4 °С. ОФА использовался для определения аминокислот на уровне 10 пмоль [214] и фосфоаминокислот (разд. 8.11.2.3).
Реагент ОФА — этантиол [206]. Растворяют 100 мг ОФА в 5 мл метанола. Добавляют 50 мкл этантиола (ЭТ) и 10 мл 0,15 М натрийборатного буфера (pH 10,5), содержащего 0,2% реагента бридж-35. Смесь продувают азотом и оставляют стоять в темноте по крайней мере на 16 ч. Для сохранения стабильности каждые 4 дня к реагенту добавляют 10 мкл ЭТ (разд. 8.12.2.3).
Предколоночная дериватизация ОФА [187, 188].
Реагенты. Растворяют 50 мг о-фталевого альдегида в 1,25 мл метанола и добавляют 50 мкл 2-меркаптоэтанола и 11,2 мл 0,4 М боратного буфера подщелаченного до pH 9,5 с помощью 4 М NaOH. Реагент стабилен в течение 1—2 недель. Можно использовать раствор реагента фирмы Pierce. Он содержит ОФА в боратном буфере с добавкой реагента бридж-35 и 2-меркаптоэтанола. Реагент стабилен 6 мес при 4 °С.
Модификация. Белок гидролизуют в 6 М НСl, лиофилизуют и остаток растворяют в воде. Если для гидролиза использовалась метансульфокислота, гидролизат нейтрализуют 4 М NaOH. Разбавляют, если необходимо, 0,4 М боратным буфером (pH 9,5) до получения конечной концентрации по каждой аминокислоте <25 нмоль/мл. Перед гидролизом белок может быть окислен или карбоксиметилирован.
Аликвоту раствора образца 5—10 мкл смешивают с 5 мкл раствора реагента. Через одну минуту добавляют 20—100 мкл ацетата натрия (pH 7,0) и немедленно 20 мкл наносят на колонку. Внутренним стандартом служит 2-аминоэтанол.
Анализ сыворотки мочи или спинномозговой жидкости. Смешивают 25 мкл образца при энергичном размешивании с 75 мкл ацетонитрила. Центрифугируют при 1000 g 2 мин. Берут 10 мкл аликвоты для обработки ОФА.
ВЭЖХ. Используют колонки с носителем Ultrasphere ODS (45:240)Х4,6 мм с размером частиц 5 или 3 мкм и Microsorb C18 (100X4,6 мм). Необходима предохранительная колонка (СО : PELL сорбент ODS, 40 мкм), особенно для колонок с носителем C18 и размером частиц 3 мкм. Длина колонки практически не влияет на эффективность разделения аминокислот, поэтому предпочитают укороченные колонки (45—100 мм) для сокращения времени анализа. Иногда проблему составляет достижение четкого разделения глицина и треонина. Дело в том, что колонки даже одной фирмы значительно различаются между собой. В некоторых случаях глицин и треонин разрешаются полностью, на других колонках не удается достичь полного разделения даже варьированием состава элюирующей системы.
Измерения проводят на флуориметре с кюветой 9 мкл и фильтрами для возбуждения при 305—395 нм и эмиссии при 420—650 нм.
Для градиентного элюирования смешивают два предварительно дегазированных раствора:
Раствор А. 0,1 М ацетат натрия, pH 7,2 (для гидролизатов белков) или pH 6,4 (для физиологических жидкостей).
Раствор Б. Абсолютный метанол.
Линейная зависимость площади пика от количества нанесенного образца сохраняется в диапазоне 500 фмоль — несколько сотен пикомолей вещества; при содержании <5 пмоль наблюдаются значительные отклонения от линейности для таких аминокислот, как серин, глицин, аланин, из-за наложения фоновых примесей. В этих случаях необходимо проводить коррекцию результатов путем вычитания данных «глухого» опыта. Для большинства аминокислот чувствительность 25—50 фмоль, рабочий интервал 50 фмоль — 1 нмоль. Па рис. 8.6 приведены результаты разделения аминокислот на колонке со смолой Ultraspere ODS (3 мкм) за 13,5 мин. Кривые элюирования гидролизатов вазопрессина и соматостатина в аналогичных условиях представлены на рис. 8.7.
Замечание. Смесь, содержащая более 60 аминокислот и аминов, была разделена с использованием предколоночной модификации с ОФА. Недавно на колонке Perkin Elmer C18 (4,6X32 мм), размер частиц 3 мкм (Jones, частное сообщение), проведен анализ менее чем за 7 мин. Цистеин определялся в виде карбокcиметильного производного, а метионин —в виде метионин-S-оксида; пролин и гидроксипролин — по методу, описанному в работе [376).

РИС. 8.6. Профиль элюирования смеси аминокислот, модифицированных ОФА. В каждом пике 40 пмоль вещества. Система ВЭЖХ включает два насоса (фирма Beckman, модель 100А), микропроцессор для создания режима градиентного элюирования (фирма Beckman, модель 421) и флуориметр (фирма Gilson, модель 121), снабженный 9-мкл кюветой и фильтрами с полосой пропускания 305—395 нм (для возбуждающего света) и 420—650 нм (для эмиссионного излучения). Эмиссионный фильтр снабжен диафрагмой с отверстием диаметром 2 мм. Диапазон шкалы флуориметра 0,1 отн. ед., временная константа 0,5 с. Образцы вводились в колонку с помощью инжeкционного клапана (фирма Beckman, модель 210), снабженного петлей объемом 20 мкл. Хроматографические пики записывались и обрабатывались с помощью интегратора системы C-RIA. Колонка с обращенной фазой Ultrasphere ODS (75x4,6 мм, частицы 3 мкм) соединена с предколонкой (30x2,1 мм), наполненной сорбентом СО: PELL ODS (частицы 40 мкм). Скорость потока 1,5 мл/мин, исходное давление на колонке 3100 psi. Любезно предоставлено д-ром В. N. Jones. Седьмой пик слева направо Asn.
Предколоночная дериватизация с 4-хлоро-7-нитробензофураном (НБФ) [3761 используется для модификации пролина и гидроксипролина. Аликвоту нейтрализованного образца разбавляют, если нужно, до конечной концентрации пролина —20 нмоль/мл. Смешивают равные объемы 0,4 М боратного буфера (pH 9,5) и метанольного раствора НБФ (2 мг/мл). Нагревают при 60 °С 5 мин в закрытом сосуде. Реакцию останавливают охлаждением до 0 °С, Аликвоту раствора наносят на колонку.
ВЭЖХ. Используется колонка Ultrasphere (250X4,6 мм) с частицами 5 мкм.

РИС. 8.7. Профили элюирования гидролизатов двух карбоксиметилированных полипептидов. Количество вещества в каждом пике выражено в пикомолях. а — кислотный гидролизат вазопрессина; найденные количества аминокислот находятся в хорошем соответствии с известным составом полипептида: Asp, Glu, CMC2, Gly, Arg, Tyr, Phe; б — ферментативный гидролизат соматостатина; ожидаемый состав соматостатина из данных аминокислотной последовательности; СМС2, Asn, Ser, Gly, Thr2, Ala, Trp, Phe3, Lys2.
Растворитель А. Тетрагидрофуран — 0,05 M ацетат натрия (pH 6,6) (1:99).
Растворитель Б. Метанол.
Линейный градиент от 30% до 45% Б при скорости 1,5% Б в минуту.
Скорость потока 1,0 мл/мин.
Обнаружение при длине волны возбуждения света 220 нм, эмиссии до 370 нм и шкалой чувствительности 0,1 мкА, НБФ-аддукты пролина и гидроксипролина элюируются в этих условиях за 6 мин.
Фенилтиокарбамильные производные. Реакция фенилизотиоцианата (ФИТЦ) с аминокислотами изучена детально, поскольку она лежит в основе методики деградации пептидов по Эдману, конечными продуктами которой являются фенилтиогидантоины [104]. Первая стадия этой реакции — образование фенилтиокарбамильных (ФТК) производных — используется для количественного определения аминокислот в так называемом PICO-TAG™-aнaлизе, разработанном и внедренном фирмой Waters. ФТК-аминокислоты стабильны, легко синтезируются и успешно идентифицируются после разделения методом БЭЖХ на обращенной фазе. В реакцию вступают как первичные, так и вторичные аминогруппы аминокислот и разделяются все производные одновременно. Обнаружение с УФ-детектором при 254 нм; это дешевле и проще, чем применение флуориметра для ОФА-производных. Для анализа был использован S35, меченный ФИТЦ [76, 151, 199].
Предколоночная модификация фенилизотиоцианатом [151].
Реагенты. ФИТЦ (в 1-миллиметровых ампулах, запаянных в вакууме), триэтиламин («для секвенирования»), аминокислоты (фирма Pierce). Пиридин и триэтиламин перегнаны над нингидрином и гидридом кальция. Ацетонитрил и метанол для ВЭЖХ (фирма Burdik and Jackon). Буфер для конденсации: ацетонитрил — пиридин —триэтиламин — вода (10:5:2:3). Стабилен в течение месяца при —5 °С. ФТК-аминокислоты устойчивы, если хранятся замороженными при pH 6,8.
Модификация. В небольшой пробирке высушивают досуха гидролизат белка или раствор аминокислот. Растворяют остаток в 100 мкл буфера для конденсации и высушивают досуха на роторном испарителе или высокоскоростном концентраторе (Speed-Vac Concentrator). Эта предварительная обработка необходима для удаления следов НСl и дает возможность избежать появления постороннего пика на хроматограмме вблизи гистидина.
Добавляют 100 мкл буфера для конденсации и 5 мкл ФИТЦ. Оставляют на 5 мин при комнатной температуре. Упаривают и затем сушат в глубоком вакууме (0,5—10-2 мм рт. ст.). Вновь растворяют образующиеся ФТК-аминокислоты в 250 мкл 0,05 М аммонийацетатного буфера или смеси вода — ацетонитрил (7:2). Вводят с помощью инжектора 1 —10 мкл (100—1000 пмоль каждой аминокислоты) на колонку с обращенной фазой. Аликвота может быть одновременно исследована на обычном анализаторе для контроля полноты превращения аминокислот в ФТК-производные.
ВЭЖХ. Используют обычно колонки (250X4,6 мм) с носителем С3 и С18 и частицами 5 мкм (Altex, Dupont и IBM).
Системы растворителей:
A. 0,05 ацетат аммония (pH 6,8), подкисленный фосфорной кислотой.
Б. 0,1 М ацетат аммония (pH 6,8) в различных растворителях:
1) ацетонитрил — вода (50:50);
2) метанол — вода (80:20);
3) ацетонитрил — метанол — вода (44:10:46).
B. Ацетонитрил — вода (70:30).
Прекрасное разделение ФТК-аминокислот было получено с использованием градиента растворителей (см. ниже) при температуре колонки 52 °С и общем времени анализа 30—40 мин. Поглощение измерялось в УФ-свете при 254 нм:
|
Время, мин |
Содержание |
растворителя, % |
|
|
А |
В |
В |
|
|
0 |
100 |
0 |
0 |
|
15 |
85 |
15 |
0 |
|
30 |
50 |
50 |
0 |
|
30,1 |
0 |
0 |
100 |
|
40 |
100 |
0 |
0 |
Приведенная методика описана в работе [76]. В табл. 8.1 приведены коэффициенты молярного поглощения ФТК-аминокислот (последние указаны в порядке их элюирования с колонки).
Процедура определения аминокислотного состава, называемая PICO∙ТАС™-анализом, заключается в обработке избытком ФИТЦ нескольких (до 12 одновременно) образцов и удалении летучих компонентов в вакууме в специально сконструированном приборе. В диапазоне 5—1000 пмоль зависимость величины сигнала от количества вещества линейна. Возможна автоматизация процесса. Все белковые аминокислоты включая аспарагин, глутамин, цистеиновую кислоту, карбоксиметилцистеин, гомосерин, метионинсульфоксид и метионинсульфон, гидроксипролин и гидроксилизин могут быть проанализированы на специальной колонке PICO-TAG™. Результаты разделения стандартной смеси аминокислот (фирма Pierce Н) в количестве 250 пмоль и 1 пмоль (за 12 мин) приведены на рис. 8.8 и 8.9.
Таблица 8.1. Коэффициенты молярного поглощения ФТК-аминокислот в системах растворителей А, Б (1) и В (см. текст) [151]
|
А мшюкислота |
Молярное поглощение при 254 нм (1 моль/см) |
Аминокислота |
Молярное поглощение при 254 нм (1 моль/см) |
|
Ala |
15772 |
Arg |
13874 |
|
Glu |
14465 |
Pro |
15235 |
|
KM-Cys |
15500 |
Tyr |
16524 |
|
Hyp |
15420 |
Val |
16295 |
|
Ser |
14824 |
Met |
16716 |
|
Gly |
15326 |
Ile |
21375 |
|
His |
12645 |
Leu |
17069 |
|
Ihr |
15152 |
Phe |
16293 |
|
Ala |
16316 |
Lys |
30224 |