Практическая химия белка - А. Дарбре 1989
Анализ фенилтиогидантоинов аминокислот
Аналитические методы
Высокоэффективная жидкостная хроматография
В конце 70-х — начале 80-х годов происходил взрывообразный рост числа публикаций по ВЭЖХ ФТГ-производных аминокислот, причем в разных лабораториях работали на разных приборах, колонках и применяли разные буферы. Поэтому новичку трудно сделать правильный выбор условий разделения. В этом разделе описываются те системы, относительно которых мы имеем личный опыт. Замечания и оговорки, относящиеся к этим и другим системам, помогут читателю сделать выбор хроматографической системы.
13.2.1.1. Оборудование. Большое число коммерческих моделей ароматографов доступно либо в виде набора модулей, либо в виде моноблоков. Часто можно собрать хроматограф из модулей, производимых разными фирмами. Это позволяет соблюсти разумный компромисс между ценой и качеством прибора, но неопытному аналитику не следует выбирать такой вариант. Основные требования к аналитической системе вкратце можно сформулировать следующим образом:
1) Система подачи растворителей должна обеспечивать возможность создания линейных градиентов при скоростях потока 0,1—2,75 мл/мин и при давлениях 0,3—35,0 МПа. Эффективность колонки повышается при уменьшении размера частиц; при этом возрастает рабочее давление (при сохранении длины колонки) и поэтому разумно предусмотреть возможность работы при больших давлениях. Растворители, используемые для градиентного элюирования, можно предварительно смешивать и подавать на колонку с помощью одного насоса (как правило, имеющего несколько головок). В то же время описаны системы, включающие несколько насосов, каждый из которых подает свой растворитель в смесительную камеру. В обоих случаях для создания градиента требуется электронное программирующее устройство; часто форма градиента выбирается из набора готовых форм разной крутизны. Следует отметить, что добиться хорошей воспроизводимости разделения ФТГ-производных аминокислот при ВЭЖХ довольно трудно; важную роль при этом отводят подбору градиентов. Эффективность системы легко оценить, выполнив несколько разделений в одних и тех же условиях. Следует предусмотреть возможность задания и поддержания изократического режима разделения на разных участках анализа, особенно в конце градиентного разделения. С помощью электронного программирующего устройства система в конце каждого аналитического цикла возвращается в исходное состояние. Используя систему, состоящую из водного буфера А и органического растворителя В*, надо иметь возможность на короткое время между анализами увеличивать содержание компонента В в элюенте до 100% (для С8-колонок см. разд. 13.2.1.5); это позволяет хорошо промыть колонку, а также способствует продлению срока службы колонки. Как и во всех хроматографических аналитических методах, колонка как средство разделения играет решающую роль в создании высокого разрешения. При наличии эффективной колонки нет необходимости в программировании скорости потока или в создании сложных форм градиентов с промежуточными изократическими участками. Однако полезно иметь такие возможности для того, чтобы при необходимости использовать их.
2) Необходимо иметь инжектор, позволяющий наносить образец на колонку без сброса давления и соответственно без изменения скорости потока. При помощи инжектора на колонку наносят от одного до нескольких сотен микролитров раствора образца с точностью ±1%. Многие операторы быстро осознают преимущества автоматических инжекторов, оправдывающие высокую стоимость этих модулей.
3) Для оптимизации разделения по температуре термостат колонки должен контролировать температуру в, диапазоне 20-65 °С.
4) Поглощение элюата записывают на длине волны 254 нм в кюветах малого объема (10 мкл и менее) при давлениях в кювете до 3,5 атм. Полезно использовать второй канал детектирования (при 313 нм) для регистрации модифицированных производных Ser, Thr, образующихся в ходе автоматического анализа последовательности. Конструкции проточных ячеек некоторых фирм позволяют свести к минимуму влияние изменения коэффициента преломления, происходящего при градиентном элюировании. По мере увеличения разрешающей способности колонки возрастает скорость анализа. При уменьшении диаметра колонки сокращается время пребывания элюируемых компонентов в проточной ячейке, поэтому для проведения скоростных анализов необходимо использовать детекторы, способные работать при малых значениях постоянной времени детектора. Рабочая чувствительность лучших (спектро)фотометров составляет 0,001 ед. опт. плотн. на всю шкалу при удовлетворительном отношении сигнала к шуму.
* Обычно это чистый органический растворитель (ацетонитрил, метанол и т. д.). — Прим. перев.
При использовании 1,0—0,01 нмоль пептида диапазон до 0,005 ед. опт. плоти, является достаточным, но при работе с меньшими количествами необходим более чувствительный детектор. При работе на микроуровне необходима оптимизация всех элементов прибора и параметров разделения; необходимы растворители высокой чистоты, потому что резко возрастает дрейф базовой линии в ходе высокочувствительного элюирования. Может понадобиться дополнительная очистка растворителей, буферов, воды.
5) Для регистрации результатов разделения необходима система записи данных идентификации ФТГ-производных аминокислот. Существует несколько типов интеграторов, обладающих разными возможностями. В большинстве случаев перед разделением продуктов отщепления проводят градуировку па методу внешних стандартов, что позволяет оценить удельные площади пиков (в наномолях) и ширину «окна» для идентификации пиков. Интеграторы могут обрабатывать базовую линию сложного вида и находить площади неразделенных пиков. Чтобы получить достоверные результаты при расчетах площадей пиков разной формы, для разных участков хроматограммы используются различные значения ширины пиков и уровня шумов. Эксплуатация хроматографов на пикомольном уровне часто соответствует пределу рабочих параметров, поэтому необходимо иметь прибор с большим запасом возможностей. В на% стоящее время существуют дешевые одноканальные интеграторы, записывающие результаты измерений на термочувствительную бумагу. Некоторые интеграторы можно соединять с компьютерами для хранения исходных или предварительно обработанных данных, поступающих с детектора непосредственно в компьютер. Можно использовать интерфейс на основе 12—16-разрядного аналого-цифрового преобразователя (АЦП) или применять стандартный интерфейс (например IEEE, RS232 или 16-разрядный интерфейс общего назначения). В этом случае нужна относительно низкая скорость записи хроматографических данных (10—25 точек/с); необходимо приобрести или составить самостоятельно программу интегрирования для данного компьютера. После сбора данных компьютер может проводить сглаживание сигнала и вычитание базовой линии для улучшения соотношения сигнал/шум.
В исследованиях, результаты которых излагаются в данной главе, использовалась система фирмы Waters, состоящая из автоинжектора WISP (модель 710В), двух насосов (модель 6000), детектора (модель 440, длины волн 254 и 313 нм), колонки с водяным термостатом. Для работы па шкале 0,002 и 0,001 ед. опт. плотн. применяют детектор фирмы Altex (модель 160) с автоматической установкой исходной базовой линии после проведения каждого анализа. Выход сигнала (шкала на 10 мВ) присоединен к системе обработки данных (модель 730 фирмы Waters). Насосы управляются с помощью программирующего устройства (модель 720 фирмы Waters). Для записи и обработки данных используется система, описанная выше. Для прямого сбора данных детектор соединен с АЦП, который через HPIB имеет выход на компьютер (модель 9845/204 фирмы Hewlett-Packard). В последнее время применяют также многоканальную систему фирмы Nelson Analytical в комбинации с компьютером фирмы Hewlett-Packard (модель 9816).
13.2.1.2. Хроматографические растворители. Наиболее важное значение имеет оптическая чистота воды, растворов солей и органических растворителей. Буферы должны быть стерильны и свободны от посторонних частиц. Для очистки воды удобна патронная система фирмы Milliporc (разд. 8.3). Органические растворители приемлемого качества продают фирмы Rathburn Chemicals. BDН, Burdick and Jackson, Fisons and Merck. По мере увеличения чувствительности анализа все большее значение приобретают пики примесей и дрейф базовой линии. При необходимости воду, используемую для приготовления буферов, можно дополнительно очистить, пропустив ее через колонку с грубой фракцией С18-сорбента, например патроны Sеp-Pak (фирма Waters). Органические растворители пропускают через слой активированного угля высшего качества, перегоняют на колонке Widmеr или на установке с вращающейся мешалкой. Однако в руках новичка эта методика может скорее загрязнить, чем очистить растворители и обычно нe является рентабельной с точки зрения цены и эффективности очистки. Ацетонитрил фирмы Rathburn (марка S), используемый в нашей лаборатории без очистки при градиентном разделении, вызывает дрейф базовой линии, составляющий 0,005—0,001 ед. опт. плотн.
Наличие загрязнений в реагентах и растворителях, используемых в анализе последовательности, является отдельным фактором, влияющим на чувствительность анализа. При необходимости реагент можно очистить, как описано в работе [8].
Качество уксусной кислоты и ацетата натрия не представляет проблемы, если используются продажные реактивы высшей степени чистоты. Растворители деаэрируют пропусканием через них сильного потока гелия в течение 2—3 мин, через водный буфер гелий барботируют в течение всего времени работы насосов, подающих растворы на колонку. Другие методы деаэрирования в нашей лаборатории дают менее надежные результаты, хотя любые методы, рекомендованные фирмами — производителями оборудования, при тщательном повседневном приготовлении буферов дают воспроизводимые результаты. Мы готовим исходный 1 М буфер, стерилизуем его фильтрованием. Буферы для хроматографического элюирования готовят каждые два дня разбавлением исходного буфера. Невозможно предотвратить случайное попадание и рост микроорганизмов в ацетатных буферах. Для предотвращения роста бактерий и грибов буфер А содержит небольшое количество ацетонитрила (см. разделение на C8-колонке в разд. 13.2.1.5).
13.2.1.3. Хроматографические колонки. Возможности разделения на колонках продолжают улучшаться благодаря более строгому контролю производственных процессов, а также внедрению более эффективных сорбентов с постоянно уменьшающимся размером частиц. Для анализа ФТГ-производных аминокислот в настоящее время используется три типа обращенных фаз — октильная, октадецильная, цианопропильная. Несколько фирм выпускают колонки с сорбентами, покрытыми указанными фазами и различающиеся типом и размером частиц (3—10 мкм). Эти носители имеют разную степень покрытия углеводородными цепями и дополнительной модификации (блокировки) остаточных силанольных групп. В последние годы мы испытали много колонок разных фирм и отметили значительное улучшение воспроизводимости разделения. Однако до сих пор наблюдается существенное различие в разделении некоторых пар ФТГ-производных аминокислот на колонках различных фирм, по описанию заполненных сорбентом одного типа. Во многих случаях можно почти полностью разделить стандартную смесь (за исключением какой-либо одной пары ФТГ-производных), состоящую из 18 компонентов. Иногда в случае ФТГ-Arg и ФТГ-His наблюдается значительный «хвост». Мы считаем, что единственным решением этой проблемы разделения является опробование разных колонок. По нашему мнению, по воспроизводимости разделения ФТГ-аминокислот и продолжительности жизни колонки наиболее подходящими являются колонки Zorbax С8 (фирмы Dupont). При проведении на этих колонках ~2000 анализов воспроизводимость времени удерживания ФТГ-производных аминокислот ото дня ко дню составляет 0,01 мин. По нашему опыту, единственной колонкой другого типа, дающей удовлетворительные результаты при хроматографии основных ФТГ-производных аминокислот, является цианопропильная колонка фирмы IBM.
13.2.1.4. Приготовление стандартных растворов ФТГ-производных аминокислот. Сухие ФТГ-производные (фирмы Pierce) растворяют в ацетонитриле или в метаноле до концентрации ~7,5 нмоль/мкл, отбирают по две аликвоты, разбавляют для измерения поглощения при 269 нм. Зная коэффициенты молярного поглощения (табл. 13.1), можно определить точную концентрацию растворов и разбавить каждый раствор до концентрации 5 пмоль/мкл. ФТГ-Arg и ФТГ-His обрабатывают специально. Гидрохлориды этих соединений можно перевести в растворимые трифтороацетаты путем добавления 20%-ной ТФУ, раствор затем упаривают в потоке азота. Высушенные такие образом ФТГ-производные затем растворяют в ацетонитриле и разбавляют до нужной концентрации, как указано выше. Готовят смесь, содержащую равные количества каждого ФТГ-производного (при разделении па C8-колонках добавляют также ФТГ-производное норлейцина), разбавляют раствор до получения нужной концентрации ФТГ-производных аминокислот в подходящем объеме (например, 50 пмоль в 10 мкл). Растворы индивидуальных производных храпят при —20 °С в течение нескольких месяцев, а в виде смесей — несколько недель при той же температуре. Приготовление стандартных растворов ФТГ-Scr и ФТГ-Thr — особый случай и обсуждается ниже.
13.2.1.5. Разделение ФТГ-производных аминокислот методом обращенно-фазовой ВЭЖХ. Большинство из многочисленных опубликованных методик для анализа ФТГ-производных имеет лишь незначительные преимущества по сравнению с первоначальным вариантом разделения, предложенным в 1977 г. [20], когда использовали сорбент с октадецильной фазой (С18), ацетатные буферы и ацетонитрил. Единственное серьезное затруднение вызывала хроматография ФТГ-Arg и ФТГ-His, которые элюировались в виде гораздо более широких зон, чем ФТГ-производные других аминокислот. На колонках выпуска последних лет, заполненных сорбентом с меньшим размером частиц и имеющих большее число теоретических тарелок, можно добиться значительно большей эффективности разделения, но анализ ФТГ-Arg и ФТГ-His до сих пор представляет проблему при использовании колонок с фазой C18. Острота этой проблемы зависит от содержания свободных силанольных (кислых) групп, остающихся после модификации носителей. Существенное улучшение результатов разделения можно получить при использовании колонок с фазами C8 (Dupont) и CN (IBM). Колонки фирмы Dupont (Zorbax C8) наиболее пригодны для разделения ФТГ аминокислот, возможно, из-за того, что сорбент имеет высокую степень модификации остаточных силанольных групп. В данной главе приведены различные методики, заимствованные из литературы и модифицированные в нашей лаборатории.
Таблица 13.1. Молекулярные массы и экстинкция ФТГ-производных аминокислот
|
ФТГ-производные |
Молекулярная масса |
Єд59 |
|
ФТГ-Аlа |
206 |
16 000 |
|
ФТГ-Asn |
249 |
17 200 |
|
ФТГ-Asp |
250 |
16 100 |
|
ФТГ-Arg-НСl |
328 |
15 900 |
|
ФТГ-Glu |
264 |
15 900 |
|
ФТГ-Gln |
263 |
17 000 |
|
ФТГ-Gly |
192 |
14 900 |
|
ФТГ-His-НСl |
309 |
15 500 |
|
ФТГ-Ilе |
248 |
17 000 |
|
ФТГ-Leu |
248 |
16 700 |
|
ФТГ-N-ε-ФТК-Lys |
398 |
29 000 |
|
ФТГ-Met |
266 |
17 100 |
|
ФТГ-Рhе |
282 |
15 500 |
|
ФТГ-Рrо |
232 |
14 300 |
|
ФТГ-КМ-Cys |
297 |
16 600 |
|
ФТГ-Тrр |
321 |
19 700 |
|
ФТГ-Tvr |
298 |
15 600 |
|
ФТГ-Val |
234 |
16 500 |
Разделение на колонках с фазой С8.
Буферы. Исходный 1 М ацетат натрия доводят до pH 4,1 уксусной кислотой. Работают с двумя буферами А и В, которые отличаются содержанием ацетонитрила. Оба буфера (А и В) содержат 0,008—0,02 М ацетата; буфер А содержит 10% ацетонитрила, буфер В — 80%. Растворы деаэрируют гелием. Колонка термостатирована при 43 °С, скорость потока элюента 2 мл/мин.
Колонка. Zorbax С8, 4,6x250 мм (Dupont). Между инжектором и колонкой присоединена спираль из трубки длиной не менее 600 мм, помещенная в термостат для предварительного обогрева буфера.
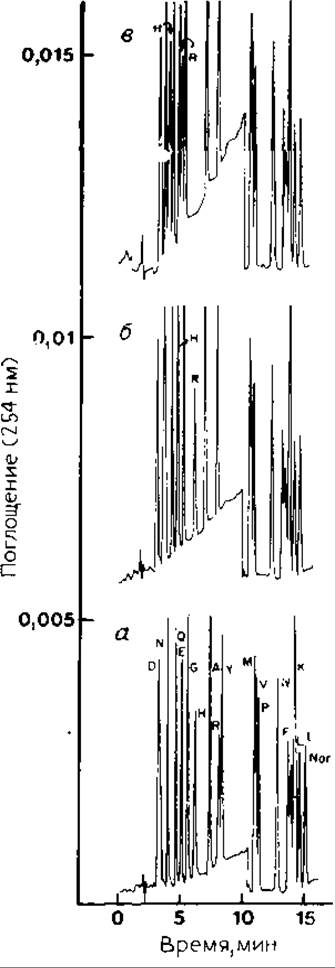
РИС. 13.1. ВЭЖХ ФТГ-производных аминокислот на колонке Zorbax С8. Влияние концентрации соли в буфере на разделение производных Arg и His. Условия разделения приведены в разд. 13.2.1.5. Концентрация ацетата натрия (моль/л); а — 0,005, б — 0,01, в — 0,02. Обозначения аминокислот — в однобуквенном коде, Nor — ФТГ-производное норлейцина.
Условия анализа. Для оценки начальных условий разделения можно использовать линейный градиент буфера В от 20 до 40% в течение 8 мин. Результаты такого разделения показаны на рис. 13.1, а. Положения пиков ФТГ- Arg и ФТГ-His зависят от концентрации соли в буферах, и, как видно из рис. 13.1,6 и в, при изменении концентрации соли пики этих веществ могут перемещаться относительно пиков ФТГ-производных других аминокислот. На разделение ФТГ-производных гидрофобных аминокислот влияет содержание буфера В в конце градиента. Проведя 2—3 анализа с различной конечной концентрацией этого буфера, можно оптимизировать разделение; изменение концентрации в 1 % может оказаться решающим. Проведя оптимизацию хроматографических параметров, можно не менять условия разделения в течение нескольких недель. Точность анализа при этом зависит главным образом от воспроизводимости приготовления буферов. По мере старения колонки для сохранения прежнего положения пиков ФТГ-Arg и ФТГ-His на хроматограмме следует увеличивать концентрацию соли в буферах. Может потребоваться оптимизация условий элюирования этих двух соединений относительно ФТГ-производных других аминокислот и пиков побочных продуктов, образующихся в ходе реакций, протекающих в секвенаторе. На рис. 13.2 приведены кривые элюирования с С8-колонки при определении ФТГ-производных аминокислот, полученных на газофазном секвенаторе.
Разделение на колонке с фазой С18. Для анализа ФТГ-производных чаще всего используют колонки с фазой C18, производимые фирмами Dupon (Zorbax ODS), Waters (C18μВоnсlарак), Altex (Ultraspere ODS).
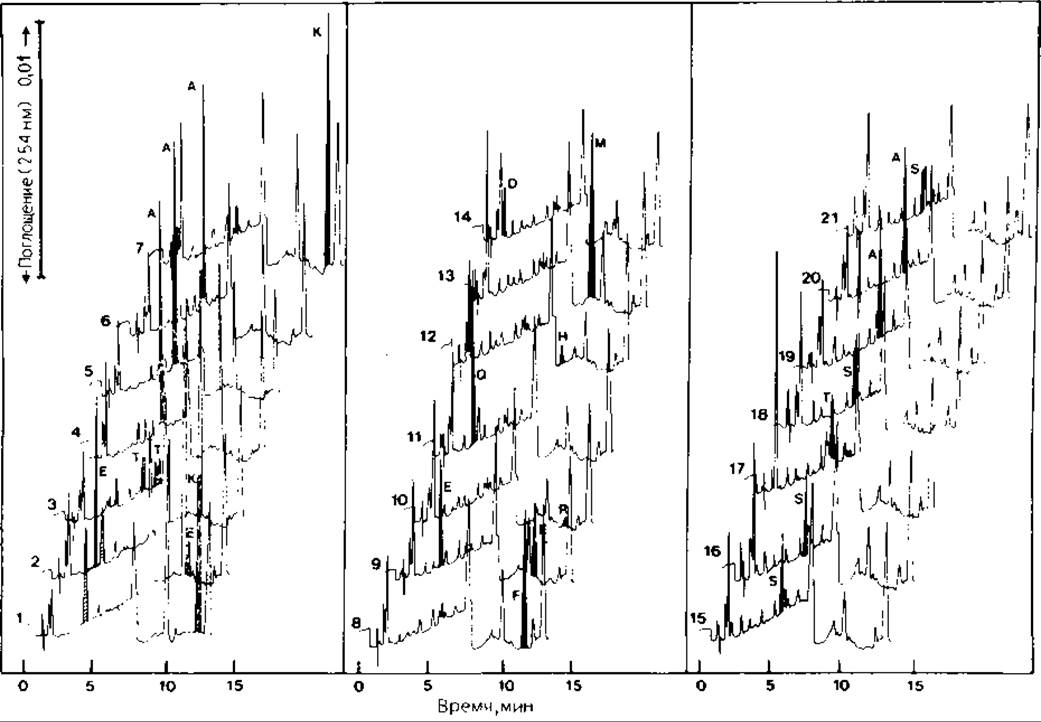
РИС. 13.2. ВЭЖХ продуктов 21 цикла анализа по Эдману рибонуклеази (ГФ-секвенатор). Условия хроматографии приведены в разд. 13.2.1.5 (0,0025 М ацетат натрия). Обозначения пиков примесей указаны а подписи к рис. 13.3.
Подробное описание методик для этих колонок можно получить от фирм-производителей и найти в журналах Analytical Biochemistry, Journal of Chromatography. Поскольку параметры колонок, производимых разными фирмами, сильно отличаются друг от друга, то это привело к появлению огромного числа публикаций, описывающих бесчисленное множество вариантов условий разделения. В последнее время значительно усовершенствованы как условия синтеза носителей, так и способы упаковки колонок, что позволяет надеяться на увеличение межлабораторной воспроизводимости результатов. Методология, описанная в работе [20], до сих пор лежит в основе серийного анализа. Хорошие результаты получают при использовании натрийацетатных буферов (pH 4,0—4,5) с концентрацией 0,001 —- 0,04 моль/л, ацетонитрила или метанола в качестве органических модификаторов, а также градиента концентраций органического растворителя от 20 до 40% при температуре 40—45 °С. При этом остается проблема «хвостов» пиков ФТГ-Arg и ФТГ-His. При скоростях потока элюента до 2,5 мл/мин можно провести анализ менее чем за 20 мин. Ацетонитрил предпочтительнее метанола или этанола из-за более низкого уровня фона и меньшей вязкости при высоких концентрациях растворителя в буфере. Изменением концентрации соли в буфере можно повлиять на хроматографическое поведение ФТГ-Arg и ФТГ-His и на их положение относительно других ФТГ-производных аминокислот.
На разделение ФТГ-производных влияют температура, скорость потока элюента, концентрация органического растворителя, форма градиента. При оптимизации условий разделения на новой колонке полезно провести анализ при четырех разных температурах (например, при 25, 35, 45 и 55 °С), для оптимизации анализа производных гидрофобных аминокислот изменить конечную концентрацию ацетонитрила, скорость изменения градиента. Важное значение имеет предварительный подогрев буфера, проводимый в соединительной трубке, помещенной между инжектором и колонкой. При необходимости следует изучить влияние pH. В литературе описаны примеры использования колонок с фазой C18, например:
1) колонка Zorbax ODS (Dupont); система ацетат натрия — ацетонитрил [5, 13, 20];
2) колонка μBondapak (Waters); ацетат натрия — метанол [19, 17];
3) колонка Ultrasphere ODS (Altex); ацетат натрия — ацетонитрил с добавкой ТГФ [16].
Разделение на колонках с CN-фазой.
Буферы. Исходный 1 М ацетат натрия доводят уксусной кислотой до pH 5.7. Буфер А — 0,015 — 0,04 М ацетат натрия, содержащий 15% буфера В, который в свою очередь состоит из метанола (50%) и ацетонитрила (50%). Буферы деаэрируют гелием, элюирование приводят при 32 °С со скоростью 1 мл/мин. Для оптимизации разделения состав буфера меняют, как указано далее.
Колонка. Цианопропильная (IBM), размером 4,6x250 мм. Опубликовавны условия полного разделения смеси ФТГ-производных обычных аминокислот на колонках Zorbax CN (Dupont) [10] и CN (IBM) [8]. Главное преимущество цианопропильных колонок перед колонками с фазой С18— лучшая форма пиков ФТГ-Arg и ФТГ-His, большее время жизни колонки (число вводов пробы), большая чувствительность (отношение высота пика: количество ФТГ). Мы испытывали с 1982 г. колонки С8, С18 и цианопропильные и нашли, что в отношении формы пиков ФТГ-Arg и ФТГ-His колонки с фазами С8 и цианопропил имеют преимущество перед С18-колонками. По нашему опыту, срок службы С8-колонок и цианопропил (число вводов пробы) сопоставим. У нас нет опыта работы с колонками Zorbax ODS, достаточного для заключения о сроках службы этих колонок.
Оптимизацию разделения на цианопропильных колонках проводят изменением концентрации соли; добиваются того, чтобы пики ФТГ-Arg и ФТГ-His оказались между пиками ФТГ-производных других аминокислот. Увеличение концентрации соли сокращает время элюирования этих соединений. Следует учитывать, что наличие побочных продуктов реакции Эдма- на может диктовать свои условия выбора положения пиков ФТГ-Arg и ФТГ-His. По мере старения колонки для поддержания постоянства времени элюирования производных основных аминокислот необходимо увеличивать концентрацию соли. Для оптимизации разделения ФТГ-производных Туr, Val, Pro, Met следует менять соотношение ацетонитрила и метанола в буфере В. Увеличение концентрации метанола улучшит разделение производных Pro и Met, а снижение улучшит разделение ФТГ-Туr и ФТГ-Val. Для оптимизации разделения производных Asn, Ser, Thr, Gln, Gly следует изменить начальную концентрацию буфера В и крутизну градиента буфера В. При наличии программирующего устройства можно поддерживать многоступенчатые градиенты, подобные описанным в работе [8], и благодаря этому добиться оптимального разделения. При воспроизведении этих градиентов следует учитывать различие в объемах смесителей разных систем.
Разделение ФТГ-производных аминокислот на фенилалкильных колонках. Описано эффективное, но длительное разделение на колонках μBondapak (фирма Waters) [6].
13.2.1.6. Анализ ФТГ-производных аминокислот в продуктах отщеплении по Эдману. При анализе более чем I нмоль исходного пептида идентификация ФТГ-производных обычных аминокислот, полученных в ходе ручного или автоматического определения последовательности по Эдману, является однозначной. При работе с количествами >1 нмоль образца примеси, вносимые из секвенаторных реактивов, обычно не влияют на ВЭЖХ.
ФТГ-Arg и ФТГ-His. Для превращения анилинотиазолинонов в ФТГ- проbзводные аминокислот лучше использовать не НСl, а ТФУ. Может потребоваться очистка ТФУ (обработка хромовой кислотой, перегонка над дитиотреитом для получения чистой ТФУ, свободной от пероксидов) [8]. Конверсию проводят с 20%-ной ТФУ при 55 °С в течение 20 мин. Затем кислоту удаляют в токе азота, образец растворяют в ацетонитриле. При этом ФТГ-Arg и ФТГ-His анализируются в форме трифтороацетатов, а не гидрохлоридов. Эта методика требует приготовления стандартов в виде трифтороацетатов (разд. 13.2.1.4). Время выхода с колонки указанных ФТГ-производных оптимизируют, меняя концентрацию соли в буфере.
ФТГ-Asp и ФТГ-Glu. Эти ФТГ-производные характеризуются небольшими временами удерживания, и при количественном анализе встречаются затруднения либо из-за образования множественных ников, либо вследствие выходов этих производных из колонки совместно с дитиотреитом, добавляемым в секвенаторные реагенты и растворители в качестве антиоксида и га. В случае ГФ-анализа показано, что это несущественно при использовании колонки с фазой С8 (рис. 13.2). Для увеличения времени удерживания ФТГ- производных кислых аминокислот их можно этерифицировать [8].
Методика. Готовят 1 М раствор ацетилхлориди в тщательно охлажденном метаноле (см. разд. 8.17.1.1). К пробе добавляют 50 мкл полученного раствора, выдерживают реакционную массу в течение 20 мин. Реагент удаляют испарением в потоке азота, образец растворяют в ацетонитриле. Положение пиков метиловых эфиров производных Asp и Glu показано на рис. 13.3. При анализе ФТГ-производных в виде метиловых эфиров повышается точность количественного анализа из-за того, что эти сложные эфиры элюируются в области низкого уровня фона примесей, появляющихся в реакции Эдмана. Если необходимо получить иное положение пиков искомых ФТГ относительно пиков примесей, то можно синтезировать этиловые эфиры тех же ФТГ.
ФТГ-Ser и ФТГ-Thr. Анализ этих ФТГ-производных лучше всего проводить, предприняв некоторые меры предосторожности (добавление антиоксидантов, например дитиотреита, во все растворители, перегонка ТФУ или гептафторомасляной кислоты над дитиотреитом). Важно проводить конверсию водной кислотой немедленно после сбора отщепленных АТЗ в коллекторе фракций. Можно добавлять раствор АТЗ в хлоробутане к раствору ТФУ в конверторе с последующим быстрым высушиванием, что помогает увеличить выход ФТГ-производных этих аминокислот. Для быстрого проведения этого процесса лучше всего использовать автоматический конвертор.
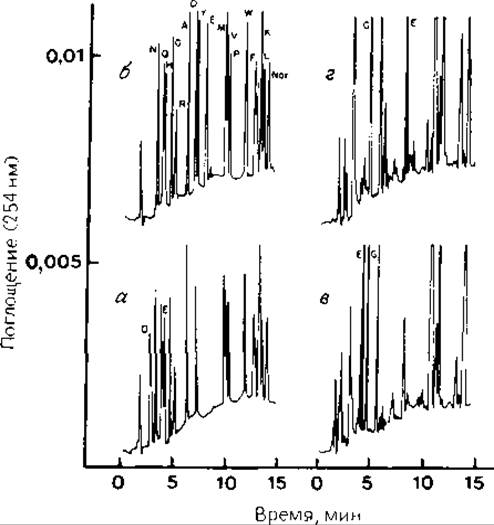
РИС. 13.3. ВЭЖХ метиловых эфиров ФТГ-Asp и ФТГ-Glu. Условия ВЭЖХ указаны в разд. 13.2.1.5; условия этерификации — в разд. 13.2.1.6. а — разделение стандартной смеси ФТГ-производных аминокислот (40 пмоль, шкала — 0,003 е. о. п.); б — та же смесь, содержащая метиловые эфиры; в и г — разделение продуктов 2-го цикла отщепления по Эдману (рибонуклеаза, ГФ-секвенатор, 0,005 е. о. п.); в — прямое определение ФТГ-Glu; г — анализ метилового эфира ФТГ-Glu. Перед началом анализа к каждому образцу добавлено ФТГ-производное норлейцина (ФТГ-Nor). Указаны пики типичных примесей (дитиотреит) и побочных продуктов взаимодействия ФИТЦ с диметиламином, а также продукты разложения ФИТЦ. Для удаления примесей, реагирующих с аминогруппами, добавлен Gly-Gly, дающий ФТГ-Gly.
Коммерческие препараты ФТГ-Ser и ФТГ-Thr могут быть не идентичны тем же производным, отщепленным на секвенаторе. Лучше всего определять время выхода и проводить количественный анализ производных Ser и Thr, анализируя белок известной структуры, содержащий Ser и Thr (например, Ser-3 в миоглобине кашалота, Thr-3 в рибонуклеазе быка; см. рис. 13.2). Учитывая выход аминокислот, стоящих в последовательности до и после остатков Ser и Thr, можно определить поправку на разрушение ФТГ-производных этих аминокислот. Эти же белки можно использовать для оптимизации условий работы секвенатора и увеличения выхода ФТГ-производных аминокислот (рис. 13.2).
Надежность обнаружения ФТГ-Ser и ФТГ-Thr можно повысить, детектируя их дегидропроизводные на длине волны 314 нм. Для продуктов отщепления на секвенаторе величина поглощения при 314 нм сильно меняется, так как могут образовываться не только дегидропроизводные, по и продукты присоединения к ним дитиотреита. По нашим данным, ФТГ-Thr, полученный на газофазном секвенаторе, дает два или четыре пика, два из которых элюируются до и после ФТГ-Туr на колонке С8 (рис. 13.2). Полученный в тех же условиях ФТГ-Ser выходит с колонки непосредственно перед производным Ala (рис. 13.2). Вещества, элюируемые в этих положениях, не поглощают при 314 нм. При работе на ЖФ-, ТФ-, ГФ-секвенаторах получаются разные результаты. Лучшим решением вопроса в этих случаях является, как указано ранее, анализ стандартного белка.
ФТГ-Cys. Методика идентификации остатков Cys зависит от природы химической модификации сульфгидрильной группы остатка цистеина до анализа на секвенаторе. Для количественной оценки содержания цистеина наиболее удобно использовать меченое [С14]-карбоксиметильное производное, полученное восстановлением и последующим алкилированием образца [С14]-иодоацетамидом. Все отщепленные остатки проверяют на наличие радиоактивности. Кроме того, можно определить время элюирования соответствующего производного цистеина, оценить количественно его содержание и использовать эти данные для хроматографической оценки содержания Cys. Можно анализировать и ФТГ-производное цистеиновой кислоты, однако оно элюируется с колонки очень быстро, и при наличии многих соединений, также выходящих с колонки, содержание ФТГ-производного цистеиновой кислоты трудно оценить (тем более количественно).
13.2.1.7. Высокочувствительный анализ. При анализе образцов, содержащих <1 нмоль полипептида, наличие посторонних соединений, появляющихся из реактивов, растворителей и даже из пробы образца, может вызвать большие затруднения при идентификации. Реактивы собственной очистки следует дочищать, покупные — проверять на чистоту. Методики очистки приводятся в работах [7, 8].
Моно- и дифенилтиомочевина — обычные примеси, образующиеся в ходе реакции Эдмана в ГФ-секвенаторе при взаимодействии ФИТЦ с диметиламином. Кроме того, дополнительные пики на хроматограммах дают полибрен и примеси, присутствующие в органических растворителях и буфере, используемом на стадии карбамоилирования.