Практическая химия белка - А. Дарбре 1989
Анализ аминокислотной последовательности на микроуровне с использованием газофазного пептидо-белкового секвенатора
Секвенатор
Эксплуатация секвенатора
17.2.3.1. Нанесение образца. Перед нанесением образца реактор (рис. 17.2) разбирают. Для этого откручивают винт 7, кольцо-фиксатор 8, вынимают реактор в сборке из основания 9. Откручивают алюминиевую крышку 3, вынимают оба стеклянных цилиндра 7 из патрона 6. Удаляют использованные диски (стеклофильтр и тефлоновый фильтр). Стеклянные цилиндры промывают поочередно водой, 1 М уксусной кислотой, водой, 1 М едким натром, водой, метанолом (марки «для ВЭЖХ»), В торцевую выемку верхнего цилиндра помещают новый стеклофильтр, наносят на него по 0,025 мл водного раствора полибрена (60 мг/мл) и глицилглицина (1 мкм/мл). Затем фильтр сушат в вакууме, между двумя торцевыми поверхностями цилиндров, образующими реакционную камеру, кладут новый тефлоновый фильтр, собирают реактор и проводят по крайней мере четыре цикла отщепления. После такой предварительной химической обработки стеклофильтра реактор разбирают, вынимают верхний цилиндр, несущий этот фильтр. Оставляя последний в коническом углублении, переворачивают цилиндр фильтром вверх, наносят на фильтр раствор полипептида (аликвотами по 0,025 мл), сушат фильтр. Собирают реактор и начинают анализ аминокислотной последовательности на секвенаторе.
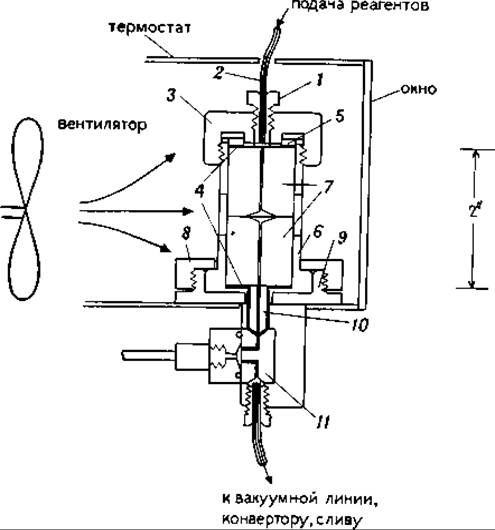
РИС. 17.2. Реактор в сборе.
1 — верхнее уплотнение; 2 — тефлоновая линия; 3 — алюминиевая крышка; 4 — тефлоновая прокладка; 5 — уплотнение; 6 — направляющая гильза (нержавеющая сталь); 7 — стеклянный цилиндр (пирекс); 8 — кольцо-фиксатор; 9 — основание реактора; 10 — нижнее уплотнение; 11 — блок клапанов.
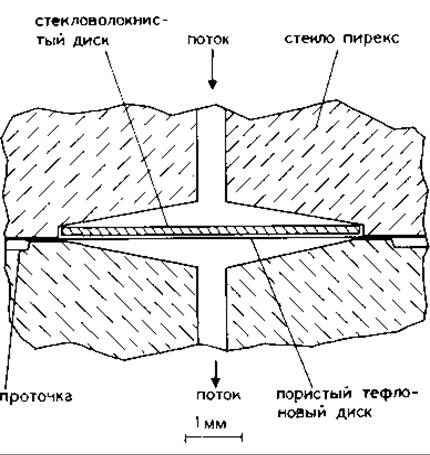
РИС. 17.3. Реакционная камера (увеличенное изображение).
Таблица 17.1. Сравнение расхода реагентов и растворителей при проведении одного цикла отщепления по Эдману на ЖФ и ГФ-секвенаторах
|
ЖФ-секвенатор (реагент/растворитель) |
Объем, мл |
ГФ-секвенатор (реагент/растворитель) |
Объем, мл |
|
|
R1 |
ФИТЦ в гептане а |
0.4 |
15%-ный ФИТЦ в н-гептане б |
0,05 |
|
R2 |
Квадрол — ТФУ (pH 9,0) в смеси вода — н-пропанол (4:3) |
0,7 |
15%-ный водный триметиламин в |
5 см3/мин (в потоке аргона) |
|
R3 |
ГФМК |
0,5 |
ТФУ, содержащая 0,01% дитиотреита г |
5 см3/мин (в потоке аргона) |
|
R4 |
25%-ная водная ТФУ (расход не указан) |
0,5Д |
25%-ная водная ТФУ, содержащая 0,01% дитиотреита |
0,05 |
|
S1 |
Бензол |
7 |
Бензол е |
1,1 |
|
S2 |
Этил ацетат, содержащий 0,05% уксусной кислоты и 0,002% дитиотреита |
16 |
Этилацетат, содержащий 0,05 % уксусной кислоты и 0,002% дитиотреита |
1,2 |
|
S3 |
1-хлоробутан, содержащий 0,001 % дитиотреита |
7 |
1-Хлоробутан, содержащий 0,001% дитиотреита |
1,2 |
|
S4 |
Ацетонитрил, содержащий 0,001% дитиотреита |
4 |
Ацетонитрил, содержащий 0,001 % дитиотреита ж |
0,33 |
В настоящее время программа работы изменена следующим образом: а5%-ный раствор; б5%-ный раствор; в12,5%-ный раствор; гподается не в виде паров, а в жидком состоянии (9 мкл); д приведено переводчиком; е бензол заменен на н-гептан; ж 20%-ный водный ацетонитрил. — Прим. перев. Промывка конвертора не включена в этот объем.
Таблица 17.2. Программа работы газофазного секвенатора

17.2.3.2. Программа работы секвенатора. Последовательность операций, проводимых на секвенаторе, в основном аналогичная описанной ранее [4] и в общем виде отражена в табл. 17.2. Недавно в программу были внесены следующие изменения:
1) снижена скорость потока этилацетата (за общее время экстракции 250 с добавляется 1,2 мл); анализ фракции элюата с секвенатора методом ВЭЖХ (шкала чувствительности 0,005 ед. опт. плотн.) показал, что такая модификация фактически исключает появление побочных продуктов расщепления по Эдману, поглощающих при длине волны 254 нм;
2) увеличено общее время операции отщепления при 42 °С (от 650 до 800 с).
17.2.3.3. Эксплуатационные возможности. Для оценки возможностей прибора методом ВЭЖХ определяли выходы ФТГ-производных аминокислот (постадийные выходы) для различных количеств апомиоглобина кашалота [4]. Для образцов, содержащих 10 нмоль — 5 пмоль миоглобина (рис. 17.4), выходы составляли: 98% (10 нмоль), 96% (500 пмоль), 94% (50 пмоль) и 92% (5 пмоль). Снижение постадийного выхода, наблюдаемое при уменьшении количества наносимого образца, вероятнее всего, связано с наличием следовых количеств окислителей в реактивах и в самом секвенаторе. На уровне 10 нмоль можно определить последовательность первых 90 остатков миоглобина, на уровне 5 пмоль получены данные о частичной последовательности 22 аминокислот (рис. 17.5). В число остатков, не идентифицированных на уровне 5 пмоль, входят производные аминокислот, хуже других растворимые в 1-хлоробутане (например, ФТГ-His и ФТГ-Arg), и наиболее неустойчивые производные аминокислот (Ser, Thr и Тrр).
Возможности секвенатора в отношении коротких гидрофобных пептидов оценивались на примере октапептида ангиотензина II человека (рис. 17.6). Анализируя как 5 имоль (5 мкг исходного вещества), так и 500 пмоль (0,5 мкг), авторы идентифицировали все восемь отщепленных производных аминокислот. При работе с 50 пмоль того же образца не были обнаружены только два последних остатка — Pro и Phe. Соответствующие хроматограммы ВЭЖХ приведены на рис. 17.7.