Практическая химия белка - А. Дарбре 1989
Определение С-концевой последовательности аминокислот
Определение С-концевой последовательности
Карбоксипептидазы
Впервые карбоксипептидаза использовалась в 1930 г. в виде неочищенного препарата для отщепления С-концевого Gly от молекулы глутатиона [28]. С тех пор этот фермент упоминается почти в каждой значительной работе по определению структуры белка. Опубликован обширный обзор по применению карбоксипептидазы для С-концевого анализа белков и пептидов [25].
Коммерчески доступны три типа карбоксипептидаз, обладающих различной специфичностью: А, В и С. Карбоксипептидаза А (из поджелудочной железы крупного рогатого скота) отщепляет с наибольшей скоростью С-концeвые остатки, содержащие ароматические или большие алифатические группы в боковой цепи: Phe, Tyr, Trp, Leu, Ile, Met, Val. С меньшими скоростями отщепляются Th г, Glu, His, Ala, HSer, Asn, Ser, Lys. Очень медленно высвобождаются Gly, Asp, Glu, Cys-SO3H, KM-Cys; Pro и Arg вообще не отщепляются. Скорость отщепления кислых аминокислот можно увеличить, понижая pH реакционной массы [79]. Карбоксипептидаза В (из поджелудочной железы свиньи) быстрее всех других аминокислот отщепляет основные аминокислоты (Lys и Arg). Карбоксипептидаза С выделена из ряда растительных источников, включая цитрусовые [101], листья апельсинового дерева [82], фасоли [93], ячменного солода [91], плесени [39, 77]. Этот фермент соединяет в себе специфичность карбоксипептидаз А и В и в то же время может отщеплять С-концевой Pro. Скорости высвобождения приблизительно одинаковы для всех аминокислот, за исключением Gly, который выщепляется очень медленно [3, 89]. Карбоксипептидаза Р получена из Aspergillus [39] и Penicillum [99]; поставляется фирмой Takara-shuro К. К. Она активна при pH 2,5 и имеет специфичность, сходную с таковой для карбоксипептидазы С. Аналогичный фермент (карбоксипептидаза Y) выделен из пекарских дрожжей; иногда при его использовании не удается отщепить Asp и основные аминокислоты [34]. Известны попытки использования карбоксипептидаз в твердофазном варианте анализа С-концевой последовательности [90].
Определение С-концевой аминокислоты (или последовательности аминокислот) при помощи карбоксипептидаз состоит из расщепления пептида (белка) соответствующим ферментом (смесью ферментов) и отбора аликвот анализируемого раствора через различные отрезки времени. Проводится количественный анализ аминокислот в каждой пробе, строится график зависимости молярного содержания свободных аминокислот (в пересчете на 1 моль образца) от времени расщепления (рис. 18.13) [3].
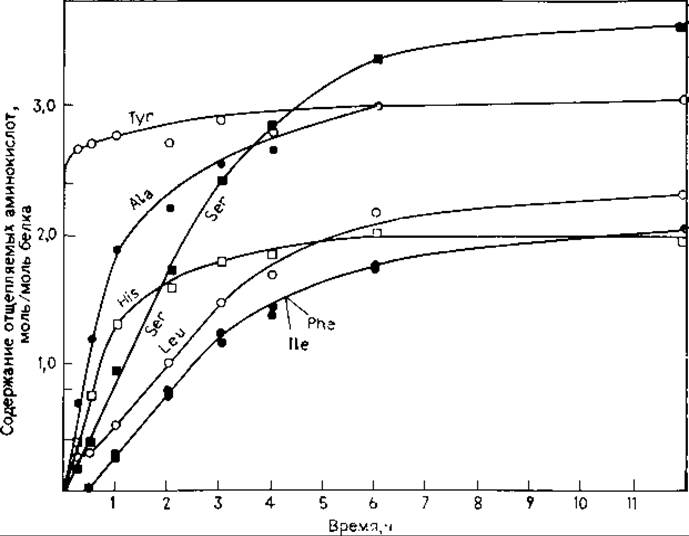
РИС. 18.13. Отщепление аминокислот альдолазы мышцы кролика карбоксипептидазой А [95].
При работе с карбоксипептидазами следует учитывать следующие основные проблемы. Во-первых, многие препараты панкреатических ферментов А и В содержат эндонуклеазы (трипсин, химотрипсин), которые следует инактивировать добавлением диизопропилфторофосфата (ДИФФ). Коммерчески доступны обработанные таким образом карбоксипептидазы А и В. Во-вторых, следует учитывать различие в скоростях отщепления отдельных аминокислот, зависящее не только от природы С-концевого остатка, но и от природы предпоследней аминокислоты, что может осложнить определение последовательности. Когда вслед за трудно отщепляемым остатком стоит легко отщепляемый, то скорости высвобождения этих двух аминокислот будут почти неразличимы. Еще одним осложнением является случай, когда в С-концевой последовательности стоят подряд несколько остатков одной аминокислоты. По всем вышеупомянутым причинам при использовании карбоксипептидаз обычно трудно вывести последовательность более трех-четырех С-концевых аминокислот. Наконец, пики Asn, Gln и Ser в стандартных условиях аминокислотного анализа накладываются друг на друга. При наличии такого пика на хроматограмме следует отобрать аликвоту гидролизата, отделить и отбросить фермент и исследуемый белок, гидролизовать остаток, провести аминокислотный анализ кислотного гидролизата. Наличие Asp или Glu указывает на присутствие Asn или Gln в пике, «соответствующем» Ser.
18.4.4.1. Методика определения при помощи карбоксипептидаз А и В. Предварительная обработка фермента.
Препараты карбоксипептидаз А и В бычно содержат свободные аминокислоты и протеолитические ферменты. Эндопептидазы можно инактивировать обработкой фермента (1 мг/мл) 50-кратным избытком ДИФФ (15 мкл 0,1 М ДИФФ в сухом изопропаноле на 1 мг фермента) в ОД М буфере (бикарбонат аммония или ацетат N-этилморфолина, pH 8,5) в течение 1 ч при комнатной температуре. Реагент и свободные аминокислоты быстро отделяют диализом или гель-фильтрацией на сефадексе G-25.
Свободные аминокислоты можно также удалить из раствора, содержащего фермент, путем суспендирования фермента в воде и последующего центрифугирования. При низкой ионной силе раствора карбоксипептидазы А и В нерастворимы и легко выпадают в осадок. Жидкость над осадком, содержащую свободные аминокислоты, отбрасывают, а осадок фермента растворяют в небольшом объеме 2 М бикарбоната аммония [25].
Предварительный эксперимент.
Перед проведением количественного анализа следует убедиться в том, что отщепление действительно происходит, подобрать оптимальные соотношения фермента и субстрата, подобрать продолжительность расщепления. Для белков обычно необходимы предварительная денатурация и перевод в растворенное состояние. Расщепление можно проводить в 6 М мочевине [31] или в 0,056 М ДСН [30]. Количество анализируемого материала зависит от чувствительности используемого метода определения.
Денатурированный белок (5—50 нмоль) растворяют в 100—200 мкл 0,2 М N-этилморфолин-ацетатного буфера (pH 8,5). Добавляют карбоксипептидазу А (10—50 мкг) или В (5—20 мкг), обработанную ДИФФ; смесь инкубируют при 37 °С в течение 4 ч. Аналогично проводят контрольный опыт (без белка). Процесс останавливают подкислением реакционной массы (ТФУ, уксусной или соляной кислотами) до pH 2. Образующийся осадок удаляют центрифугированием, надосадочную жидкость анализируют на содержание свободных аминокислот.
Если в ходе предварительного эксперимента обнаруживается высвобождение многих аминокислот, то следует использовать низкое отношение фермент : субстрат (1 : 100 или 1 : 200) или проводить отщепление при комнатной температуре. Если аминокислоты высвобождаются медленно, тб в последующем опыте используют высокое соотношение фермент : субстрат (1 :20). Если в предварительном опыте с карбоксипептидазами А и В не обнаружено значительных количеств свободных аминокислот, то следует применить методы С-концeвого химического анализа или выделить С-концевой пептид и по результатам этих опытов судить о причинах неудач с расщеплением белка при помощи карбоксипептидаз.
Количественное определение проводится после выбора оптимальных условий гидролиза. Количество анализируемого образца зависит как от чувствительности используемых методов идентификации, так и от числа отбираемых аликвот. Рекомендуется выбрать следующие интервалы времени 0,5, 1, 2, 4, 8 и 16 ч; количество белка в каждой аликвоте составляет 1—10 нмоль (в зависимости от типа анализатора).
Интерпретация. В качестве типичного примера выбора условий эксперимента рассмотрим использование карбоксипептидазы А для определения структуры С-концевой части альдолазы мышцы кролика (рис. 18.13) [95]. При использовании карбоксипептидазы В в гидролизате отсутствовали свободные аминокислоты. Первоначально предполагалась следующая последовательность аминокислот:
![]()
Вызывали недоумение низкие выходы аминокислот после отщепления третьего, пятого, шестого, седьмого остатков, что говорило о плохом отщеплении His (или об отсутствии его) в третьем положении. Более высокие, чем для остальных аминокислот, выходы Ser (4-й остаток) позволяли предположить, что в изучаемой области содержится более одного остатка Ser, хотя установить точное местоположение второго Ser было невозможно. В литературе [3] указывалось, что с помощью карбоксипептидаз редко удается надежно определить последовательность более трех-четырех остатков, хотя и существует большой соблазн сделать выводы, выходящие за рамки надежной интерпретации результатов.
Анализ данных, представленных на рис. 18.13, позволяет вывести следующую последовательность первых четырех аминокислот: Ser-His-Ala-Tyr. Предполагалось [95], что пятым остатком является Leu, за ним следуют, согласно измерению скорости высвобождения, Ilе и Phe. Эти аминокислоты отщеплялись в одинаковых количествах, но можно предположить указанную последовательность их расположения в цепи, так как известно, что карбоксипептидаза А отщепляет Phe в 26 раз быстрее, чем Не. Размещение Leu в пятом положении представляется неправомерным, так как скорость его отщепления приблизительно равна скорости высвобождения Ilе и Phe, превышая последние по абсолютному значению лишь на 0,25 моля для каждой точки определения.
После определения полной аминокислотной последовательности альдолазы мышцы кролика [49, 50] аминокислотная последовательность С-концевой области выглядела следующим образом:
![]()
Эти данные совпадают с результатами определения первых трех аминокислот и с предположением о том, что Ilе находится ближе к С-концу молекулы, чем Phe. Однако указанная последовательность отличается от той, что была выделена по результатам С-концевого анализа белка. Во первых, «Ser» в четвертом положении оказался Asn, который совпадает с Ser в обычных условиях аминокислотного анализа и неотличим от Ser без дополнительной проверки другими методами. Во-вторых, лишний остаток «Ser», явно присутствующего в последовательности (рис. 18.13), оказался в пятом положении с С-конца, а не в восьмом. В-третьих, Leu, высвобождающийся с той же скоростью, что и Ilе, и Phe, попал в восьмое, а не в пятое положение. Было найдено, что заниженные выходы His и последующих остатков объясняются частичным дезаминированием остатка Asn в пятом положении; связь Asp-His очень устойчива к действию карбоксипептидазы А [50].
18.4.4.3. Отщепление с помощью карбоксипептидазы С. Доступны коммерческие препараты карбоксипептидазы С из листьев апельсинового дерева [89] и карбоксипептидазы Y из дрожжей [34]. Фермент из первого источника может содержать переменные количества трипсина, химотропсиноподобной активности, аминопептидазы, которые инактивируются предварительным инкубированием с 0,001 М ДИФФ при pH 5,3—8,0. Такая же обработка частично ингибирует карбоксипептидазу С из цитрусовых и полностью — карбоксипептидазу Y из дрожжей.
Стратегия и методика применения карбоксипептидаз С и Y для определения С-концевой последовательности аналогичны изложенным для ферментов А и В. Отщепление проводят в 0,05 М цитрате натрия или ацетате пиридина (pH 5,5) при соотношении фермент : субстрат = 0,11,0% (по массе). Карбоксипептидаза Y иногда не отщепляет Asp или основные аминокислоты [34].