Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление по остатку триптофана
Окислительное галогенирование
Метод селективного расщепления пептидных связей остатка триптофана основан на высокой реакционной способности индольного ядра. При этом благодаря низкому содержанию в белках триптофана должны образоваться несколько крупных фрагментов, удобных для секвенирования. Однако, несмотря на то что за годы поисков были найдены подходящие реагенты и методики, лишь немногие из них нашли практическое применение [47, 181]. Далее подробно рассматриваются наиболее полезные и часто применяемые на практике методики. Относительно остальных методов расщепления по триптофану будут сделаны лишь короткие комментарии.
Окислительное галогенирование индольного ядра остатка триптофана N-бромосукцинимидом (NBS) было впервые предложено как метод модификации и расщепления триптофилпептидной связи. Из других бромирующих агентов, которые использовались для этих целей, следует упомянуть N-бромоацетамид, N-бромофталимид и бром [47, 137, 148, 181, 209].
Главный недостаток расщепления белков по карбоксильной группе триптофана с помощью бромосукцинимида заключается в низком выходе фрагментов, который редко превышает 50%, а иногда составляет даже 5%. Кроме того, расщепление но триптофану сопровождается побочными реакциями. На практике благодаря высокой реакционной способности N-бромосукцинимида может идти модификация и расщепление пептидных связей не только остатков триптофана, но и остатков тирозина (разд. 2.6.1) и гистидина (разд. 2.8.3). Однако расщепление по тирозину можно исключить путем О-ацилирования фенольного гидроксила [169—171]. Расщепление по гистидину также можно свести к минимуму, поскольку эта реакция идет только при нагревании. В ходе реакции метионин в значительной степени окисляется до метионин-S,S-диоксида, а цистеин и цистин до цистеиновой кислоты. В 8 М мочевине N-бромосукцинимид расщепляет только связи триптофана, в то время как тирозин не затрагивается [64]. Из-за недостатков, свойственных методу с применением N-бромосукцинимида, была изучена возможность применения других галогенирующих реагентов.
Расщепление с помощью N-бромосукцинимида проводят в кислой среде при достаточном избытке реагента в расчете на серусодержащие аминокислоты, тирозин и гистидин. При расщеплении простых триптофансодержащих пептидов на 1 моль пептида в реакции расходуется 2—3 моля N-бромосукцинимида. Исследование взаимодействия бромосукцинимида с 3-индолами и простыми производными триптофана [209], а также строения некоторых промежуточных продуктов реакции [51, 162, 163] позволило предложить наиболее вероятный механизм расщепления связи по триптофану через окислительное галогенирование (см. последовательность реакций 37→43).
Как следует из предлагаемой схемы реакций, в превращениях участвуют 2 экв. электрофильного галогена. Благодаря своей высокой реакционной способности N-бромосукцинимит галогенирует бензольное кольцо тирозина в положение 5 [137]. По-видимому, первым промежуточным продуктом реакции является 3-галогеноиндоленин (38), который затем в результате гидролиза и элиминирования переходит в оксоиндол (39). Далее оксоиндол (39) при взаимодействии со вторым эквивалентом положительно заряженного галогена превращается в 3-галогенооксоиндол (40), который благодаря нуклеофильной атаке кислорода карбоксильной группы триптофана по углеродному атому (индольного ядра), связанному с галогеном, превращается в иминолактон (42). Последний легко гидролизуется в N-ацилдиоксоиндолилаланинлактон (43) (находящийся в равновесии с открытой формой аминокислоты), который становится С-концевым аминокислотным остатком пептидного фрагмента.

Факт, что оксоиндол является промежуточным соединением в последовательности реакций расщепления, был четко показан на примере цитохрома с сердца лошади [51, 163]. Единственный в белке остаток триптофана вначале избирательно окисляли в производное оксоиндола, а затем проводили бромирование в системе НВr — ДМСО.
Последовательность реакций (37→43) включает также еще один путь, согласно которому 3-галогенооксоиндолилаланин (40) наряду с циклизацией до 42 гидролизуется в диоксоиндолилаланин (41). Избирательное (или предпочтительное) расщепление пептидных связей по диоксоиндолилаланину может быть достигнуто мягким кислотным гидролизом [162]. Выдвинутое в работе [20] предположение об анхимерном содействии y-гидроксигруппы катализируемому кислотами гидролизу алифатических амидов убедительно подтверждается легкостью и селективностью гидролиза пептидной связи в токсичном циклопептиде фаллоидине, при котором y-гидроксигруппа способствует расщеплению пептидной связи [204, 205].

Установлено также, что расщепление пептидной связи при окислительном галогенировании может идти и по аминогруппе остатка триптофана, хотя и с низким выходом [123, 162, 163]. Если глицилтриптофан инкубируют с BNPS-скатолом (разд. 2.5.2) в 75%-ной уксусной кислоте при 37°С в течение 24 ч, с выходом 20% образуется свободный глицин [123]. При расщеплении пентапептида Phe-Val-Gln-Trp-Leu в системе ДМСО — галогеноводород в уксусной кислоте и последующем подкислении до pH 2 (60 °С, несколько часов) кроме ожидаемого остатка лейцина в смеси идентифицируют свободный диоксоиндолилаланин (и/или его лактон). На кривой элюирования с аминокислотного хроматографа не было обнаружено других аминокислот [163].
Расщепление по аминогруппе триптофана можно представить в виде последовательности реакций 44→48, в которой в результате расщепления С-пептидной связи триптофана по механизму окислительного галогенирования образуется фрагмент с С-концевым оксоиндолилаланином (44), который затем через промежуточный 6-членный интермедиат иминолактона (46) превращается в 48.
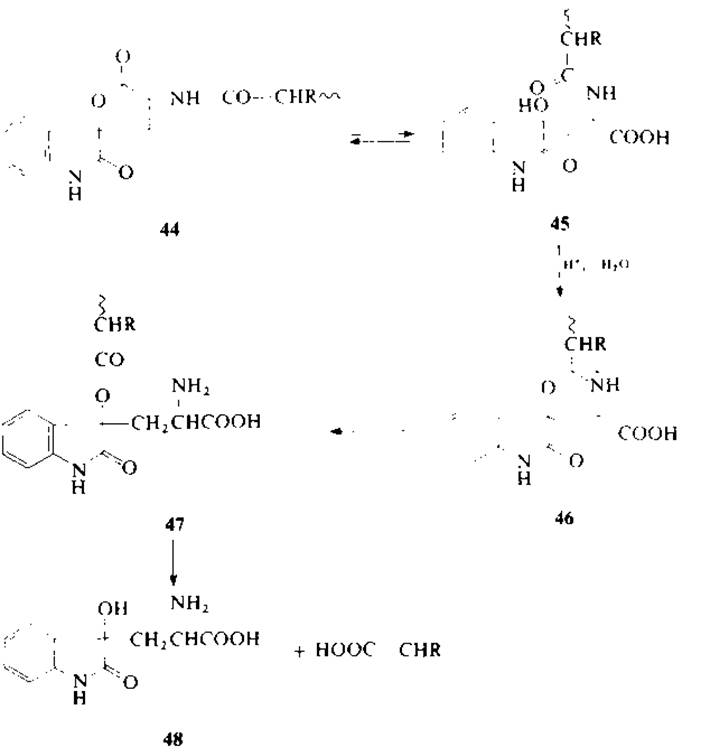
Расщепление пептидной связи по аминогруппе триптофана можно также объяснить 1—6-взаимодействием по аналогии с механизмом реакции бромоциана с метионином без расщепления пептидной связи [22] (разд. 2.4.1). В случае метионина образуется производное О-аминоацилгомосерина, которое, по-видимому, устойчиво в водной среде (например, в 70%-ной муравьиной кислоте). В случае триптофансодержащих пептидов идет образование соответствующего О-аминоацильного производного с группой третичного алкилового эфира (51), который, полагают, гораздо более лабилен в кислой среде. Возможный механизм 1—6-взаимодействия представлен последовательностью реакций 49→52.
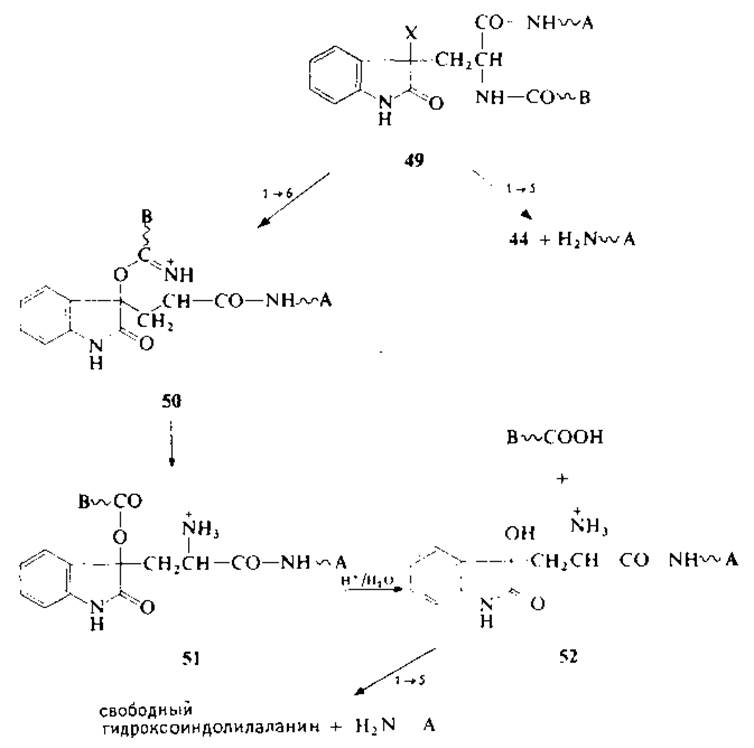
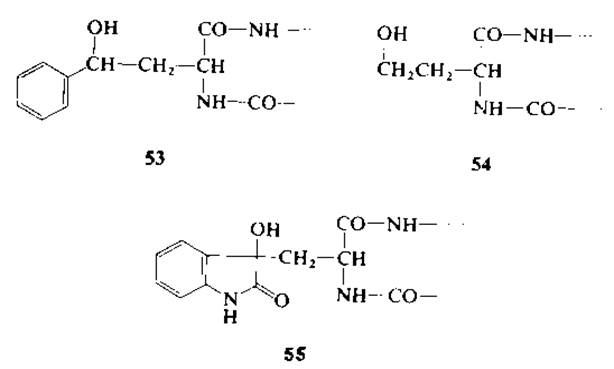
В этой связи интересно отметить, что имеются сведения [196] о расщеплении в условиях мягкого гидролиза по аминогруппе и карбоксилу у-фенилгомосерилпептидов (53), близких в структурном отношении как гомосерину (54), так и пептидам с диоксоиндолилаланином (55). Пептиды с N-концевым триптофаном не расщепляются галогенирующими реагентами [181]. Возможно, что с бромоиндоленином (37) преимущественно взаимодействует не карбоксиамидная группировка, а а-аминогруппа триптофана с образованием трициклического производного, что исключает расщепление пептидных связей [131]. Подобное участие в реакции свободной аминогруппы было обнаружено в случае N-тирозилпептидов, которые также не расщепляются N-бромосукцинимидом [208] (разд. 2.6).
УФ-спектры пептидных фрагментов, полученных окислительным галогенированием, свидетельствуют о присутствии в молекуле С-концевого диоксоиндолилаланина или его лактона (последовательность 37→43). Диоксоиндолилаланин в воде характеризуется λmах = 253 нм (ε = 4070), λmах = 287 нм (ε = 1220) (λmin = 230 и 277 нм). Соответствующий лактон имеет аналогичный максимум поглощения при 253 и 300 нм [66, 161, 163].
При проведении реакции с N-бромосукцинимидом или другими галогепирующими агентами образуются 5-бромодиоксоиндолилаланин (λmaх = 261 и 302 нм) и/или его лактон (λmах = 261 и 310 нм) [76, 123]. УФ-спектр оксоиндолилаланина не имеет λmах в области 270—300 нм и характеризуется λmіn при 250 нм и плечом при ∼280 нм. Если пептидные фрагменты содержат другие хромофорные группы (например, тирозин), УФ-спектр в области 250—300 нм изменится.
Следует иметь в виду, что расщепление пептидной связи тирозина окислительным галогенированием обычно проводят в 50—80%-ной уксусной (или муравьиной) кислоте при комнатной температуре в течение нескольких часов по аналогии с расщеплением бромоцианом (разд. 2.4.1). Это довольно жесткие условия, при которых возможны побочные реакции, такие, как дезамидирование или расщепление лабильных пептидных связей (Asp-Pro). Фрагменты с С-концевым диоксоиндолилспиролактоном фиксируют ковалентно через 3-аминопропильную группу макропористого стекла с целью твердофазного секвенирования по Эдману [197].