Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление по остатку тирозина
Расщепление по остатку цистеина
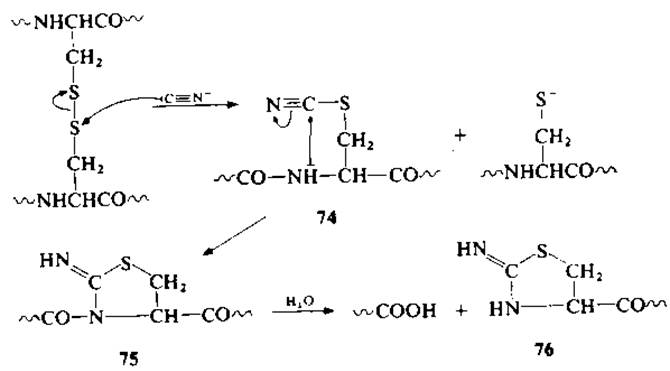
В основе метода избирательного расщепления пептидной связи по аминогруппе остатков цистеина лежит превращение SH-групп в тиоциановые группировки [183]. Впервые о расщеплении пептидной связи цистинсодержащих белков под действием цианидов сообщалось в 1964—66 гг. [23, 24]. Образование остатков тиоцианоаланина (74), который циклизуется в ацилиминотиазолидин (75), сопровождается быстрым гидролизом пептидной связи с образованием N-концевого пептида и С-концевого 2-иминотиазолидин-4-карбоксильного фрагмента (76) с достаточно высоким выходом. Поскольку расщепление дисульфидных связей цианидами приводит к частичному и случайному образованию тиоцианогрупп, следовало рассчитывать на получение сложной смеси пептидов. Однако на практике при обработке бычьей рибонуклеазы 1000-кратным избытком цианида при pH 8 и 37 °С в течение 48 ч образуется 9 пептидов. По аминокислотному составу полученные фрагменты соответствуют известной структуре рибонуклеазы, а также фрагментам, полученным путем расщепления по N-ацильным связям всех восьми остатков полуцистина [24].
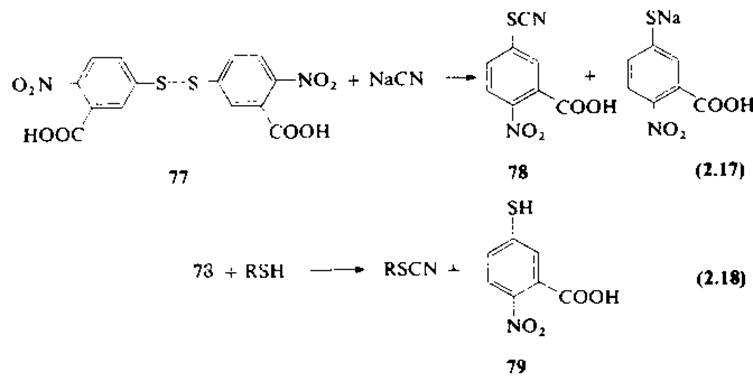
Предложен метод прямого и количественного превращения SH-групп белков в соответствующие тиоцианопроизводные с помощью 2-нитро-5-тиоцианобензойной кислоты (78) [38, 39] [уравнения (2.17) и (2.18)]. Реагент синтезируют по реакции 5,5'-дитиобис-(5-нитробензойной) кислоты с цианидом натрия [уравнение (2.17)]. 2-Нитро-5-тиоцианобензойная кислота довольно мягкий и избирательный цианирующий реагент по SH-группам; его высокая реакционная способность связана с легкостью замещения серусодержащим нуклеофилом легко отщепляющегося n-нитротиофенола [уравнение (2.18)]. Меченый реагент получают путем расщепления реактива Эллмана с помощью Na14CN. Таким способом можно ввести радиоактивную метку в остаток тиоцианоаланина и следить за скоростью образования меченых 2-иминотиазолидинпелтидов.
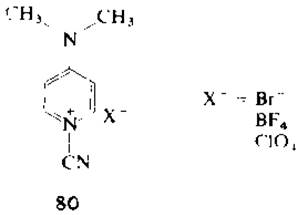
Показано также, что активным цианирующим агентом SH-групп в белках являются соли 1-циано-4-диметиламинопиридиния (80) [199]. Реакцию проводят в нейтральной или кислой среде, например в 0,1 М ацетатном буфере (pH 2—7), содержащем 7 М мочевину, при 25 °С в течение 11 мин и при трехкратном молярном избытке реагента.
Двухстадийная методика цианирования включает в качестве первого этапа обработку цистеинсодержащего белка реактивом Эллмана в мягких щелочных условиях (разд. 2.2.2.4). Затем смешанный дисульфид расщепляется под действием цианида в тиоцианоаланинпроизводное белка и анион 2-нитро-5-тиобензоата [941. Было показано также, что аналогичная двухступенчатая реакция цианирования идет при взаимодействии цианидов со смешанными дисульфидами, образующимися при реакции между цистеинсодержащим белком и 2-нитрофенилсульфенилхлоридом и водной уксусной кислоте [46, 48, 49].
Избирательное расщепление по. остаткам тиоцианоаланина проводят в щелочной среде (pH 9) при 37°С в течение 24 ч. В этих условиях остатки тиоцианоаланина подвергаются ß-элиминированию с образованием тиоцианата и дегидроаланина (разд. 2.5.2). Поскольку реакции расщепления и ß-элимипирования проходят в слабощелочной среде одновременно, следовало ожидать, что они будут конкурировать и расщепление пептидной связи пройдет с низким выходом. Однако результаты, полученные при анализе ряда белков, свидетельствуют о том, что расщепление идет почти количественно [183]. Низкий выход, вероятно, объясняется неполнотой цианирования. На примере папаина [105], каталитической субъединицы аспартат-транскарбамилазы Е. coli [194] и изоцитратдегидрогеназы Azotobacter vinelandii [28] было установлено, что монотиоцианопроизводные нативного белка не циклизуются, а расщепление пептидных связей происходит только после денатурации [194]. Следовательно, стадию расщепления S-цианированного белка следует проводить в присутствии денатурирующих агентов, например гуапидин-НСl.