Практическая химия белка - А. Дарбре 1989
Дисульфидные связи
Идентификация и локализация цистинсодержащих пептидов
Идентификация по известной аминокислотной последовательности
Анализ известной аминокислотной последовательности позволяет наметить оптимальный подход к определению положения дисульфидных связей. Для однозначной идентификации каждый цистинсодержащий пептид должен включать лишь одну дисульфидную связь. Следовательно, линейная последовательность интактной полипептидной цепи между ближайшими остатками полуцистина должна быть расщеплена хотя бы в одной точке. Иногда хорошие результаты дает расщепление бромоцианом.
Однако в случае крупных белков, имеющих несколько дисульфидных мостиков, более эффективен гидролиз с помощью относительно низкоспецифичных протеаз, например термолизина [45].
Из множества возможных схем приведем простую и изящную схему анализа определения положения дисульфидных связей в миотоксине а [18].

После расщепления бромоцианом и триптического гидролиза были выделены три коротких пептида, связанные дисульфидными мостиками (вероятное положение дисульфидных связей указано штриховыми линиями). Поскольку при анализе руководствовались известной структурой, пептиды были подвергнуты одностадийной деградации по Эдману в секвенсере, обессолены и фракционированы. При этом были получены два фрагмента:
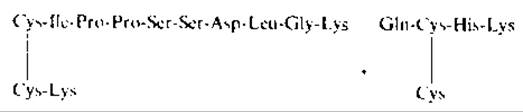
Из приведенных структур следует, что при секвенировании был удален остаток Не, один остаток Cys, а остаток Gin циклизовался в пирролидонкарбоновую кислоту. Отсюда следует следующее расположение дисульфидных связей в миотоксине а:

Вполне очевидно, что каждый белок требует своей специфической схемы анализа.