Биохимия и молекулярная биология - Белясова Н.А. 2002
Молекулярные основы и механизмы наследственности
Сохранение постоянства и изменчивость геномов
Генетический обмен и рекомбинация
Не менее важный, чем мутации, вклад в изменчивость привносят способы генетического обмена и следующие за ними рекомбинационные события. Генетический обмен характерен как для эукариот, так и для прокариот и может осуществляться в ходе различных процессов. Для эукариотических организмов изучены половой и парасексуальный процессы: в ходе первого происходит слияние половых клеток с образованием диплоидной зиготы, которая в большинстве случаев подвергается мейотическому делению, сопровождающемуся рекомбинацией между хромосомами. В парасуксуальном цикле происходят объединение и последующая рекомбинация генов на основе событий, осуществляющихся в митозе без участия оплодотворения половым путем.
Обмен генетической информацией у прокариот происходит in vivo в ходе конъюгации, трансдукции и трансформации, а в лабораторных условиях, кроме того, при слиянии протопластов.
Конъюгация — процесс генетического обмена, требующий физического контакта клеток. При этом перенос генов осуществляется из донорских бактерий (содержат конъюгативные плазмиды) в реципиентные клетки (бесплазмидные) по специальному каналу — конъюгативному мостику. Этот процесс опосредуется генами, расположенными на плазмидах. Плазмиды представляют собой суперспирализованные ковалентно-замкнутые кольцевые молекулы ДНК небольшой величины (2—600 т. п. н.), способные к автономной репликации. Клетки, содержащие плазмиды, могут приобретать новые признаки. Эти признаки используются для обозначения выявленных впервые плазмид: F-плазмиды (факторы фертильности, или половые факторы), ответственные за донорские свойства бактерий; Col-плазмиды (факторы колициногенности) —опосредуют способность клеток синтезировать особый класс бактериоцинов — колицины; R-плазмиды (факторы резистентности) — обусловливают устойчивость бактерий к антибиотикам и др. Плазмиды характеризуются рядом общих и специфических свойств. К общим свойствам плазмид можно отнести способность к автономной репликации, к конъюгативному переносу, к интеграции в нуклеоид (эписомы), несовместимость (неспособность некоторых плазмид стабильно наследоваться одной и той же клеткой).
Специфические (индивидуальные) свойства характеризуют небольшие группы плазмид и придают клеткам разные фенотипические свойства: устойчивость к антибиотикам, катионам, анионам, мутагенным факторам, бактериоцинам, бактериофагам; способность деградировать ксенобиотики; синтез антибиотиков, бактериоцинов, пигментов, инсектицидов, поверхностных антигенов, токсинов, ферментов; использование в качестве источников углерода разных сахаров и аминокислот; индукцию опухолей у растений и др.
Трансдукция — способ генетического транспорта, при котором переносчиками генов выступают умеренные или вирулентные бактериофаги. Фрагменты бактериальных хромосом обычно включаются в состав фаговых частиц либо в ходе неправильного вырезания профагов из бактериального генома (характерно для умеренных вирусов), либо в ходе ошибочной упаковки в головки бактериальной ДНК при сборке вирулентных фагов. Образующиеся фаговые частицы носят название «дефектные», поскольку в большинстве случаев не способны обеспечить литический цикл. Однако они сохраняют способность адсорбироваться на клетках и инъецировать в них свою нуклеиновую кислоту, которая может вступать в события рекомбинации с клеточным геномом.
Трансформация — способ генетического обмена, открытый Гриффитом, при котором в клетки проникает свободная ДНК. Трансформирующая способность описана как для хромосомальных, так и для плазмидных ДНК. Процесс, в котором выделенная ДНК фагов поступает в бактериальные клетки и обусловливает образование в них зрелых фаговых частиц, называется трансфекцией. В естественных условиях трансформация осуществляется с невысокой эффективностью за счет высвободившейся из спонтанно лизировавшихся клеток ДНК. В лабораторных условиях частоту трансформации можно существенно повысить, увеличив концентрацию трансформирующей ДНК и переведя клетки в компетентное состояние (только в таком состоянии клетки способны адсорбировать и поглощать ДНК). Еще легче трансформируются протопласты, и этот прием — один из самых распространенных при введении гибридных (полученных в экспериментах по генной инженерии) молекул ДНК в клетки.
Слияние протопластов представляет собой искусственный метод объединения геномов. Он основан на способности плазматических мембран — пограничных структур протопластов — к спонтанной агрегации с обобществлением всего содержимого двух или более протопластов. При этом между геномами могут происходить сложные рекомбинационные события, сопровождающиеся возникновением разных вариантов организмов.
Процессы трансформации клеток и протопластов, а также слияние протопластов используют и для селекции некоторых эукариотических организмов: дрожжей, мицелиальных грибов, растений.
Итак, перечисленные выше процессы приводят к поступлению в клетки нового генетического материала, который может подвергаться у бактерий рестрикции, если модифицирован неадeкватно имеющейся в клетке системе рестрикции—модификации, но может и успеть вступить во взаимодействие с резидентными молекулами ДНК — рекомбинацию. Рекомбинация свойственна всем группам организмов, за исключением РНК-содержащих вирусов (у них она не обнаружена). Это ферментативный процесс, и генетическая информация о синтезе ферментов, опосредующих рекомбинацию, есть во всех клетках и у многих вирусов. Некоторые ферменты, играющие ключевую роль при рекомбинации, участвуют также в процессах репликации и репарации ДНК.
Различают три типа рекомбинации: общую (регулярную, гомологичную), сайт-специфическую и незаконную (негомологичную, случайную). Основное отличие между этими типами заключается в протяженности сайтов гомологии, которые обусловливают взаимодействие молекул ДНК, приводящее к перекомбинированию генов.
Общая рекомбинация. Это обмен участками между гомологичными (идентичными) нуклеотидными последовательностями, или кроссинговер. При данном типе рекомбинации происходит разрыв гомологичных цепей ДНК с последующим реципрокным соединением их в новом сочетании (рис. 2.6). Обмен производится одноцепочечными участками, причем имеющими одинаковую ориентацию. В процессе принимает участие большое количество разнообразных ферментов. В частности общая рекомбинация у E. coli катализируется recA-белком (обеспечивает обмен одиночными цепями), recBCD-нуклеазой (осуществляет разрыв и расплетение цепочек), геликазами и белками, связывающимися с одноцепочечной ДНК (необходимы для миграции креста Холлидея), а также ДНК-полимеразой РolI и ДНК-лигазой.
Г омологичная рекомбинация начинается с надрезания однонаправленных цепей в гомологичных молекулах ДНК, после чего свободные концы одной цепи спариваются со свободными концами другой цепочки, и формируется структура Холлидея (по имени исследователя впервые предложившего ее). Точка перекреста обменивающихся цепей перемещается вдоль рекомбинирующих молекул — миграция ветви (креста). При этом происходит размыкание водородных связей между комплементарными нуклеотидами внутри одной родительской молекулы ДНК и замыкание соответствующих связей между нуклеотидами цепей, принадлежащих разным молекулам ДНК. Структуры Холлидея затем переходят в рекомбинантные двойные спирали (разрешаются) путем внесения разрывов и воссоединения цепей двумя альтернативными способами. В первом способе разрезаются и воссоединяются перекрещивающиеся однонаправленные цепи, а в другом — неперекрещивающиеся однонаправленные цепочки. При миграции креста Холлидея осуществляется спаривание цепей, принадлежащих разным молекулам ДНК, т. е. образуются гетеродуплексы. В их составе могут содержаться некомплементарные нуклеотиды, которые удаляются так же, как при репарации ДНК, а шаблоном в данном случае может служить любая из цепей.
Существует альтернативный способ общей рекомбинации, в ходе которого происходит двухцепочечный разрыв в одной молекуле ДНК. В этом случае на одном из этапов тоже формируется структура Холлидея, и происходит миграция ветви.
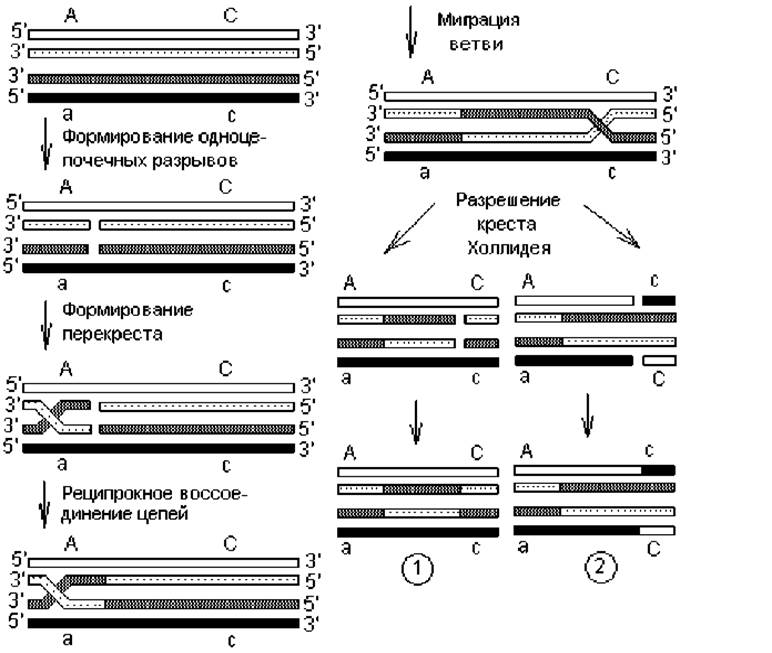
Рис. 2.6. Этапы процесса рекомбинации между гомологичными молекулами ДНК: 1 — продукт разрезания и воссоединения перекрещивающихся цепей; 2 — продукт разрезания и воссоединения неперекрещивающихся цепей
Сайт-специфическая рекомбинация. Этот способ рекомбинации не зависит от продуктов генов recA, B и D и происходит между специфическими сегментами молекул ДНК, не имеющими протяженных областей гомологии. Лучше всего этот тип рекомбинации изучен на примере интеграции фага 1 в нуклеоид кишечной палочки и его обратного исключения. Рекомбинационные события при этом происходят в коротких участках ДНК бактериофага и клетки — att-сайтах (от англ. attachment — прикрепление). В составе фаговой ДНК присутствует аttРОР'-сайт, а в составе бактериальной ДНК — attВОB'-сайт, располагающийся между оперонами gal (отвечает за утилизацию галактозы) и bio (отвечает за биосинтез биотина). Нуклеотидные последовательности att-сайтов на фаговой и клеточной ДНК различаются, за исключением участка «О» протяженностью 15 пар нуклеотидов, одинаковых для обоих сайтов. Эта последовательность, общая для рекомбинирующих геномов, служит для образования «липких» концов за счет двух надрезов уступом (рис. 2.7). Образование этих надрезов катализирует белок Int — продукт фагового гена int.
ДНК фага 1 проникает в клетку в линейной форме и сразу замыкается в кольцо благодаря существованию «липких» концов. Затем на фаговую и бактериальную ДНК воздействуют нуклеазы (белок Int), и образующиеся «липкие» концы в составе разных att-сайтов могут взаимодействовать, приводя к интеграции профага в хромосому (рис. 2.8).
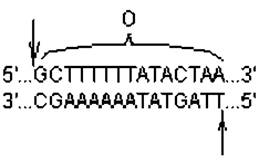
Рис. 2.7. Нуклеотидная последовательность участка «О», входящего в состав att-сайтов: стрелками показаны места надрезов уступом
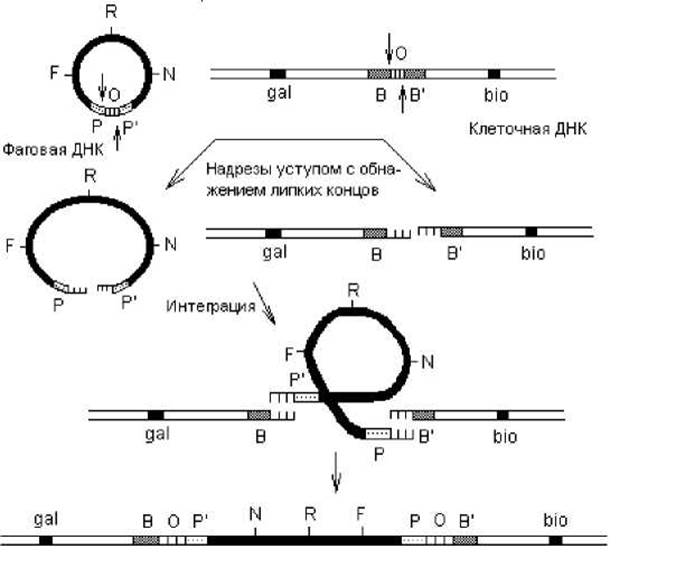
Рис. 2.8. Интеграция ДНК фага λ в хромосому E. coli
В результате сайт-специфической рекомбинации, сопровождающей процесс интеграции ДНК фага λ в нуклеоид кишечной палочки, происходит образование новых (рекомбинантных) сайтов: ВОР' и РОВ' (рис. 2.8).
Исключение профага λ из хромосомы E. coli может происходить также в результате сайт-специфической рекомбинации, и в этом процессе, кроме белка Int, играют роль фаговый белок Xis и клеточный белок HF. Следует отметить, что интеграция профага 1 может осуществляться и в другие сайты нуклеоида E. coli, однако это происходит с частотой примерно в 200 раз меньшей, чем интеграция между локусами gal и bio, и в таких случаях реализуются закономерности незаконной рекомбинации.
Незаконная рекомбинация. Примерами незаконной (негомологичной) рекомбинации служат события транспозиции перемещающихся (мобильных) элементов, для которых в геномах отсутствуют предпочтительные сайты интеграции. Полагают, что для этих событий не требуются участки гомологии ДНК. К незаконной рекомбинации относят также процессы случайного встраивания вирусной или плазмидной ДНК в клеточные геномы. Эти события наиболее часты для клеток животных.