Биохимия и молекулярная биология - Белясова Н.А. 2002
Метаболизм. Процессы, требующие притока энергии
Метаболизм азотсодержащих соединений
Расщепление аминокислот
В первом разделе данной главы уже охарактеризована необходимость и основная стратегия расщепления аминокислот. Она объясняется невозможностью запасания аминокислот впрок и невозможностью их выведения из клеток целиком. Избыточные аминокислоты используются организмами как метаболическое топливо: их углеродные скелеты при перестройках определенного рода могут вовлекаться в биосинтез жирных кислот, глюкозы, кетоновых тел, изопреноидов и др., а также окисляться в ЦТК, обеспечивая клетку энергией. Следует отметить, что многие микроорганизмы, в частности аэробные бактерии, способны использовать отдельные аминокислоты в качестве единственного источника энергии и углерода. У анаэробных микроорганизмов, при отсутствии в клетках цикла трикарбоновых кислот, выработался другой механизм: катаболизм аминокислот в парах, когда одна из них служит донором электронов, а вторая — акцептором. Важно, что в таком процессе происходит образование АТР.
Кроме углеродных скелетов, при деградации аминокислот образуется аминный азот, который в отличие от углерода не пригоден для получения энергии за счет окисления, и более того, является токсичным для клеток. Поэтому те аминогруппы, которые не могут повторно использоваться в биосинтезе, превращаются в мочевину (или другие вещества) и выводятся из организма.
Ниже будут рассмотрены основные типы реакций, в которые могут вступать аминокислоты: реакции по a-аминогруппе, карбоксильной группе и боковой цепи.
Расщепление аминокислот по аминогруппе. Эти процессы представлены в основном реакциями трансаминирования и дезаминирования по a-аминогруппе. Реакции трансаминирования уже были рассмотрены в разделе, касающемся биосинтеза аминокислот. Они катализируются трансаминазами (аминотрансферазами), отличительной особенностью которых является использование пиридоксальфосфата (производное витамина В6) в качестве простетической группы. Наибольшее значение в процессах деградации аминокислот имеют глутамат-трансаминаза и аланин-трансаминаза. Эти ферменты выполняют роль «воронок», собирающих аминогруппы от разных аминокислот и включающих их в состав глутамата и аланина. У животных эти две аминокислоты служат переносчиками накапливающегося аминного азота из тканей в печень. В печени аминогруппа аланина переносится аланин-трансаминазой на a-кетоглутарат с образованием глутамата:
Аланин + a-Кетоглутарат → Пируват + Глутамат
Таким образом, большинство аминогрупп различных аминокислот оказывается в составе глутамата, который легко подвергается дезаминированию.
Реакции дезаминирования аминокислот приводят к освобождению NH2-группы в виде аммиака и осуществляются тремя разными путями. Различают окислительное, гидролитическое и прямое дезаминирование (рис. 16.12). Наиболее распространенным типом является окислительное дезаминирование, которое осуществляется по a-аминогруппе и катализируется в основном глутаматдегидрогеназой — типичным для печени ферментом. Необычным свойством этого фермента является способность использовать как NAD, так и NADP в качестве коферментов. Активность глутаматдегидрогеназы регулируется аллостерическими активаторами (ADP, GDP) и ингибиторами (ATP, GTP).
Окислительное дезаминирование осуществляется в две стадии с образованием иминокислоты в качестве промежуточного продукта, который спонтанно гидролизуется, превращаясь в кетокислоту и аммиак (рис. 16.12). Обе реакции обратимы, и их константы равновесия близки к единице. Ранее (рис. 16.3) было показано, как в ходе обратной реакции аммиак включается в состав глутамата. Можно считать, что реакция образования и дезаминирования глутамата является центральной реакцией в процессе метаболизма аммиака.
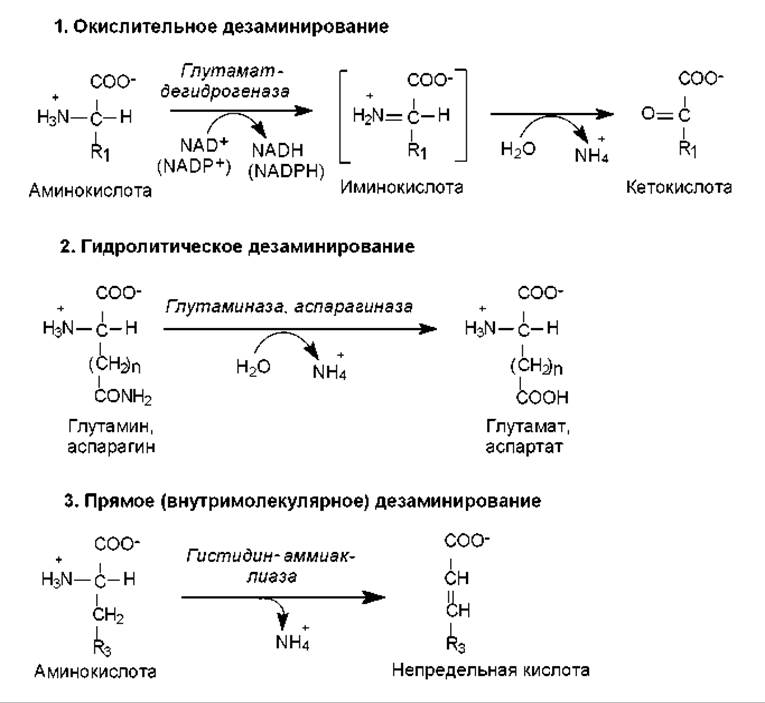
Рис. 16.12. Различные типы реакций аминокислот по аминогруппе
У многих организмов окислительное дезаминирование осуществляется с помощью дегидрогеназ, использующих флавиновые кофакторы (FMN, FAD). Эти ферменты называют оксидазами аминокислот. Они характеризуются широкой субстратной специфичностью: одни специфичны к L-аминокислотам, другие — к их D-аналогам. Считается, что эти ферменты вносят небольшой вклад в обмен аминогрупп.
Гидролитическому дезаминированию подвержены немногие аминокислоты, из протеиногенных — аспарагин и глутамин. При их дезаминировании образуются соответственно аспартат и глутамат. Этот процесс правильнее называть дезамидированием, поскольку он осуществляется за счет амидной группы (рис. 16.12). В редких случаях таким путем отщепляется и а-аминогруппа аминокислоты, тогда образуются аммиак и оксикислота.
В результате прямого (внутримолекулярного) дезаминирования возникают ненасыщенные соединения. Прямому дезаминированию обычно подвергается гистидин, а также серин. Однако первичная ферментативная атака серина приводит к отщеплению молекулы воды (фермент — серингидратаза), и в этом превращении участвует боковая гидроксильная группа серина. Спонтанному дезаминированию в данном случае подвергается нестабильное промежуточное соединение — аминоакрилат. Продуктом суммарной реакции является пируват, и этот тип дезаминирования вызывается перестройкой в боковой цепи аминокислоты.
Реакции аминокислот по карбоксильной группе. Превращения по карбоксильной группе аминокислот могут использоваться организмами для деградации этих молекул, а также для превращения в другие, необходимые клетке соединения, в первую очередь аминоациладенилаты и биогенные амины. Образование аминоациладенилатов на подготовительной стадии синтеза белка уже было описано в главе 3. Биогенные амины возникают в реакциях, катализируемых декарбоксилазами аминокислот. Эти ферменты широко распространены у животных, растений и особенно у микроорганизмов, причем известно, что у патогенных микроорганизмов декарбоксилазы могут служить факторами агрессии, с помощью которых возбудитель проникает в соответствующие ткани. Декарбоксилазы L-аминокислот, так же как трансаминазы, используют в качестве простетической группы пиридоксальфосфат.
Моноамины (биогенные амины) выполняют в организмах разнообразные функции. Например, этаноламин, образующийся при декарбоксилировании серина, является составной частью полярных липидов. При декарбоксилировании цистеина и аспартата образуются соответственно цистеамин и ß- аланин, которые входят в состав такого важного для клеток кофермента, как коэнзим А. Декарбоксилирование гистидина приводит к образованию гистамина — медиатора, участвующего в регуляции скорости метаболических процессов, деятельности желез внутренней секреции, регуляции кровяного давления у животных. Многие другие биогенные амины выполняют функции сигнальных веществ, в частности широко распространенных у животных и человека нейромедиаторов.
Реакции аминокислот по боковой цепи. Насколько разнообразна структура радикалов аминокислот, настолько разнообразны и химические превращения, которым они могут подвергаться. Среди этих многообразных реакций можно выделить те, которые позволяют клетке получать из одних аминокислот другие. Например, тирозин образуется при окислении ароматического кольца фенилаланина; гидролиз аргинина приводит к формированию орнитина (см. цикл мочевины); расщепление треонина сопровождается образованием глицина и т. п.
Кроме этих реакций, важное значение имеют превращения боковых групп, связанные с возникновением физиологически активных веществ. Так, из тирозина образуется гормон адреналин, из триптофана образуются никотиновая кислота (витамин РР, входящий в состав никотинамидных коферментов) и индолилуксусная кислота (ростовое вещество), из цистеина — меркаптуровые кислоты (участвуют в обезвреживании ароматических соединений). Уже отмечалась возможность превращения серина в пируват при дегидратации его боковой цепи и дезаминировании.
Таким образом, разнообразные химические превращения аминокислот могут приводить к образованию биологически активных веществ с широким спектром действия и, кроме того, к отщеплению аминогрупп в виде аммиака с формированием углеродных скелетов. В следующем разделе будет рассмотрена судьба аммиака и углеродных атомов расщепленных аминокислот.