ЕКОЛОГІЧНА БІОХІМІЯ - Навчальний посібник - В. М. Ісаєнко 2005
Розділ 9. РАДІОРЕЗИСТЕНТНІСТЬ ОРГАНІЗМІВ
9.6.Радіорезистентність людини
Найважливішою проблемою радіобіології є захист людини від ушкоджувальної дії підвищених рівнів іонізуючої радіації Вирішальну роль у формуванні радіаційного ураження організму людини, як також інших ссавців, відіграють доза, вид і. режим опромінення, стать, вік, період спостереження тощо..
Норми радіаційної безпеки. У проблемі визначення, розвитку уражень за дії малих доз, коли основного значення набувають канцерогенні та генетичні наслідки впливу іонізуючої радіації, існують два основні протилежні погляди. Згідно з одним із них, існує пороговий рівень впливу іонізуючої радіації, нижче якого ефект не виникає. Другий погляд полягає у відсутності порогу біологічного ефекту дії радіації ( безпороговаконцепція).
Зауважимо, що вибір концепції нормування, дії іонізуючої, радіації не випливає безпосередньо із запропонованих поглядів на пороговість. Система нормування історично ґрунтується на концепції порога шкідливої дії уражаючих факторів, у тому числі іонізуючої радіації. Її перегляд може бути виправданим, не лише простою констатацією безпороговості дії випромінювання, а й соціальною доцільністю. Вона, у свою чергу, має базуватися на об’єктивних кількісних оцінках реально наявного ризику.
Нормами радіаційної безпеки України встановлено такі категорії осіб, які зазнають дії іонізуючої радіації: 1 А (персонал)— особи, які постійно або тимчасово працюють безпосередньо із джерелами іонізуючої радіації; 2) Б (персонал)— особи, які безпосередньо не працюють із джерелами іонізуючого випромінювання, але в зв’язку з розташуванням робочих місць у приміщеннях та на промислових майданчиках об’єктів з радіаційно- ядерними технологіями можуть отримувати додаткове опромінювання; 3) категорія В— усе населення.
Основний радіаційно-гігієнічний норматив, границею якого є обмеження опромінення осіб категорії А, Б і В, називають лімітом дози. Числові їх значення встановлюються на рівнях, які викликають детерміністичні ефекти опромінення— ті, що виявляються тільки за перевищення певного дозового порога. Наслідки їхнього прояву залежать від величини отриманої дози. Крім цього, ліміт дози гарантує таку малу ймовірність виникнення ефектів опромінення, що він є прийнятим як для окремих осіб, так і для населення в цілому. Стохастичнимц ефектами дії іонізуючої радіації називають безпорогові, імовірність виникнення яких існує за будь-яких доз, зростає зі збільшенням дози й відносний прояв яких не залежить від дози. До стохастичних відносять канцерогенні та генетичні (передаються нащадкам) ефекти.
Різні тканини та органи мають свою радіочутливість. Найбільше реагують на дію іонізуючої радіації червоний кістковий мозок, ті,- мус, селезінка, лімфовузли та лімфатичні фолікули травного, тракту, статеві залози; менше — очі, печінка, легені, нирки, серце, мозок, нервові стовбури, шкіра та ів,;. ще стійкішими є кістки та сухожилля.
Різна чутливість органів до дії іонізуючої радіації зумовлює реакцію організму на те, опромінюється все тіло рівномірно ( опромінення) чи нерівномірно (його частина). Загальне рівномірне опромінення всього тіла викликає найбільше ураження.
Числові значення лімітів дози зовнішнього опромінення наведено в табл. 9.8.
Таблиця 9.8
ЛІМІТИ ДОЗ ОПРОМІНЕННЯ, мЗв/рік
Ліміти доз |
Категорії осіб, які зазнають опромінення |
||
А |
Б |
В |
|
Ліміти еквівалентної дози зовнішнього опромінення: |
20 |
2 |
1 |
для кришталика ока |
150 |
15 |
15 |
для шкіри |
500 |
50 |
50 |
для кистей і стоп |
500 |
50 |
— |
Для осіб категорії А ліміт ефективної дози можливий не більше 50 мЗв/рік, але щоб у середньому за 5 років він не перевищував 100 мЗв. Існують певні обмеження: для жінок репродуктивного віку (до 45 років) та вагітних жінок, які віднесені до осіб категорії А: за будь-які два послідовні місяці локальне опромінення: (зародка та плоду) має не перевищувати дози 1 мЗв. При, цьому за весь період вагітності ця доза не повинна бути більшою 2 мЗв.
З'ясовано, що дози нижче за 0,35-—0,5 Гр у разі гострого опромінення не викликають у людини радіаційних синдромів, а ефекти від хронічного опромінення в дозах, які зіставили з дозами за гострого опромінення ще в 5—10 разів менші.
За рекомендаціями Міжнародної комісії радіаційного захисту (МКРЗ), значення гранично допустимої дози (ГДД) рекомендовано 0,001 Зв/рік для всього населення (категорія В). Це значення в 10— 100 разів нижче від доз у деяких регіонах з природним, аномально високим вмістом радіоізотопів у ґрунті. Водночас відомо, що в осіб, які постійно мешкають на таких територіях, не виявляють відхилення ні за частотою канцерогенних або генетичних захворювань, ні за фенотипічними. В Україні, як уже зазначено в табл. 9.8, допустима потужність еквівалентної дози для фахівців становить 0,02 Зв/рік, в окремих випадках може бути 0,05 Зв/рік, але при цьому загальна доза за 5-річний період має не перевищувати 0,1 Зв/рік. Для всього населення ГДЦ визначено нарівні 0,01 Зв/рік.
Під дією підвищених доз іонізуючої радіації сукупність ознак, які проявляються у виникненні хворобливого стану, називають синдромами радіаційного ураження. Розпізнають три основні види таких синдромів: 1) синдром І— кістково-мозковий, або гемопоетичний, — переважне ураження кровотворних органів (розвивається за гострого ураження дозами 1—10 Гр); 2) синдром — гастроінтестинальний — переважне ураження травного тракту, клітин епітелію шлунка й кишечнику (доза 10—20 Гр); 3) синдром III— нервово- паралітичний, або синдром центральної нервової системи — ураження нервової системи (доза 20 Гр і більше). За розвитку останнього синдрому інколи розрізняють токсемічну форму— вторинне ураження нервової системи (доза 20—80 Гр) у зв’язку з різким зниженням тонусу судин, яке супроводжується вираженою гіпотензією. Цю форму променевої хвороби часто називають судинною. У разі дії доз понад 80 Гр розвивається церебральна форма— первинне ураження нервової системи.
В основі розвитку синдромів радіаційного ураження лежить ушкодження клітин певних тканин органів і систем. Так, наприклад, розвиток кістково-мозкового синдрому пов’язаний передусім з порушенням стовбурних клітин систем кровотворення, розміщених у кістковому мозку, клітин-попередників органів кровотворення та лімфоїдних клітин. Дещо стійкішими до дії іонізуючої радіації є мієлоїдні клітини, що дозрівають, а саме: мегакаріоцити, моноцити, макрофаги. За гастроінтестинального синдрому першопричиною його розвитку є радіаційне ураження клітин епітелію шлунково- кишкового тракту, а синдрому центральної нервової системи — ураження клітин цієї системи, порушення нейронних мереж.
Під клітинною загибеллю розуміють насамперед утрату здатності до проліферації. Клітинами, що вижили, вважають ті, які здатні до клонотворення. Тож ідеться про репродуктивну бель клітин. Ця форма променевого ураження клітин найпоширеніша.
Інший різновид репродуктивної загибелі нащадків опромінених клітин — утворення так званих гігантських клітин, які виникають у результаті злиття двох сусідніх, частіше «сестринських» клітин. Такі клітини здатні до 2—3 поділів, після чого гинуть.
Головною причиною репродуктивної загибелі клітин є структурні перетворення ДНК у вигляді хромосомних перебудов (аберації хромосом).
Інша форма радіаційної інактивації клітин — інтерфазна загибель — настає до вступу клітин у процеси мітотичного поділу. Для більшості соматичних клітин дорослих тварин і людини інтерфазна загибель реєструється лише після опромінення дозами, що досягають десятків і сотень грей. За менших доз спостерігається репродуктивна форма загибелі, причиною якої є структурні хромосомні пошкодження.
Важливим наслідком опромінення є зміна спадковості клітини, носієм якої є різні цитоплазматичні орпшели. При цьому знижується функціональна активність нащадків опромінених клітин. Можливо, саме це є однією з причин віддалених наслідків опромінення. Проте головною причиною репродуктивної загибелі клітин під час опромінення є пошкодження їхнього генетичного апарату.
Процеси радіаційно-індукованої загибелі клітин, які викликають клітинне спустошення радіочутливих тканин і органів, ґрунтуються на інтерфазній і репродуктивній загибелі клітин із двома типами клітинного танатогенезу — апоптозі і наразі. Більша частина радіаційно-індукованої загибелі, пов’язаної з утратою репродуктивної здатності клітин, є результатом втрати генетичної інформації внаслідок аберації хромосом.
Головна ланка молекулярного механізму клітинного спустошення, що зумовлене репродуктивною загибеллю клітин,— неспроможність або неефективність репарації ДНК. Забезпечення умов підвищення ефективності загибелі клітин може бути одним зі способів зниження радіаційного ефекту на рівні як тканин, так і, відповідно, — організму.
Променеві ураження поділяють на гострі та хронічні, які, у свою чергу, бувають загальними й місцевими. Вони виникають за опромінення великою дозою будь-якого виду опромінювань як ззовні, так і за надходження всередину радіоактивних речовин. Гострі ураження розвиваються за короткочасного опромінення у високих дозах, а хронічні — за тривалої променевої дії. Загальні ураження виникають у разі опромінення великих об’ємів тіла і називаються променевою хворобою, а місцеві (за локального впливу) — променевими ураженнями, або променевими опіками, оскільки за клінікою вони подібні до термічних.
Гостра променева хвороба (ГПХ). Вона розвивається у разі зовнішнього опромінення за дози, що перевищує 1 Гр, одержаній одно- моментно або протягом короткого проміжку часу (від 3 до 10 діб), а також у разі надходження всередину радіонуклідів, які створюють адекватну поглинуту дозу. Ця хвороба характеризується вираженою первинною реакцією, латентним періодом, тривалість якого обернено пропорційна тяжкості хвороби, фазою розпалу з порушенням функції різних органів і систем та періодом відновлення.
Частота летальних наслідків у діапазоні доз 2—10 Гр збільшується від 5 до 100 %. Вони спостерігаються переважно через 5—8 тижнів.
Первнняа реакція ГПХ. Час прояву первинних реакцій від моменту опромінення, тривалості та ступеня вираженості, а також прояву симптомів має принципове значення для прогнозування перебігу ГПХ. Основні симптоми ГПХ: 1) диспептичні (нудота, блювання, пронос); 2) загальноклінічні (слабкість, головний біль, зміна рухової активності, підвищення температури тіла, порушення свідомості тощо); 3) гематологічні (лімфацитопенія, нейтрофільний лейкоцитоз); 4) місцеві (ушкодження шкіри, слизових оболонок та ін.).
За прояву ГПХ легкого ступеня (доза опромінення 1—2,5 Гр) у більшості постраждалих можливі протягом першої доби нудота, блювання, слабкість, зниження здатності до концентрації уваги тощо. Поступово симптоми зникають.
Симптоми променевого ураження посилюються за перебігу ГПХ середнього ступеня тяжкості (доза 2—4 Гр). Вони починають проявлятися вже через 1,5—3 год після опромінення та з підвищенням дози посилюються.
Під час блювання знижується артеріальний тиск. У разі дії доз близько 4 Гр спостерігається почервоніння обличчя і склери (гіперемія), які минають протягом 2—3 діб. Більшість симптомів первинної реакції за ГПХ середнього ступеня минає протягом першої доби.
За ГПХ тяжкого ступеня (доза 4—6 Гр) первинна реакція проявляється через 30 хв— 1,5 год після опромінення і є більш вираженою. Вона завершується, як правило, протягом 1—2 діб. Гіперемія обличчя та склер зникає на 4-5 добу. Виражена астенія спостерігається до розвитку агронулоцитозу та пов’язаних із ним інфекційних ускладнень.
Первинні реакції дуже тяжкого ступеня ГПХ (доза 6—10 Гр) з’являються впродовж ЗО хв. Виникає невгамовне блювання, можуть бути пронос, виражена гіперемія. Відбуваються також зміни крові, виникає початковий лейкоцитоз, який триває близько доби.
За дії більш високих доз, як уже зазначалося, виникає кишкова форма ГПХ (доза 10—20 Гр), за якої летальний наслідок настає на 8—16 добу. Токсемічна форма ГПХ проявляється в разі дії доз 20— 80 Гр з летальним наслідком на 4—8 добу, церебральна (доза понад 80 Гр)— на 2—3 добу. У результаті дії доз понад 150 Гр летальні наслідки настають через кілька годин унаслідок ураження нервової системи й легенів. Дози 250—300 Гр і більше викликають загибель під час опромінення — «смерть під променем».
Латентний період ГПХ. Після завершення первинної реакції за перебігу ГПХ настає період уявного благополуччя, коли зменшуються нудота, пронос, зникають початковий лейкоцитоз, гіперемія шкіри та склер.
За легкого ступеня ГПХ латентний період, як правило, не проявляється. Не виникають також клінічні симптоми хвороби.
За ГПХ середнього ступеня самопочуття хворих змінюється не дуже, проте їм важко займатися фізичною та інтелектуальною працею, вони швидко стомлюються. Водночас відбуваються зміни крові — коливається кількість лімфоцитів, тромбоцитів і ретикулоцитів.
У тяжко хворих на ГПХ із завершенням періоду первинної реакції самопочуття поліпшується на кілька днів, але відбуваються виражені зміни крові — істотно зменшується вміст лейкоцитів і тромбоцитів, розвивається агранулоцитоз, який визначає розпал хвороби.
За дуже тяжкого стану ГПХ самопочуття хворих теж поліпшується на кілька діб, але спостерігається зменшення кількості формених елементів периферійної крові, зокрема тромбоцитів, до критичного рівня. Симптоми первинної реакції змінюються ураженням слизових оболонок ротової порожнини та шлунково-кишкового тракту, шкіри.
У латентний період спостерігається епіляція (лат. е(х)— з і pilus— видалення волосся). Вона виникає внаслідок дії доз 2,5— 3,0 Гр на волосся голови. У разі дії доз близько 6 Гр виражена епіляція проявляється на 4—17 добу, а доз 6—10 Гр— на 8—9 добу. Опромінення голови в дозах 12—15 Гр призводить до постійної епіляції. За дії доз 10 Гр і більше відбувається епіляція вій і брів.
Період розпалу захворювань за ГПХ. Значне зниження кількості лейкоцитів у периферійній крові протягом кількох діб свідчить про настання періоду розпалу. Розвиток агранулоцитозу визначається насамперед зменшенням кількості гранулоцитів і тромбоцитів у периферійній крові. Унаслідок дії доз близько 2 Гр агранулоцитоз розвивається на 30—33 добу після опромінення і триває 7—8 діб, за дії доз близько 4Гр агранулоцитоз розвивається на 10—20 добу, а 6Гр — 7—8 добу.
Період розпалу ГПХ характеризується лейко- і тромбоцитопенією та пов’язаними з ним інфекційними захворюваннями. Можливий розвиток пневмонії, езофагіту, виразки кишечнику, сепсису. Розпалу агранулоцитозу на 1-3 доби передує клітинне спустошення кісткового мозку, виникає аплозія. Опромінення кісткового мозку в дозах понад 6Гр призводить до загибелі майже всіх стовбурових клітин. У цьому разі єдиною надією на порятунок стає пересадка кісткового мозку. Проте за опромінення в дозах близько 10 Гр розвиваються летальні ураження кишечнику, тож пересадка кісткового мозку неефективна.
За опромінення живота дозами понад 5 Гр розвивається ентероколіт та гепатит. За доз 2—4 Гр відбувається ураження слизової оболонки порожнини рота. Дія більших доз, як уже зазначалося, викликає також тяжке ураження слизової оболонки кишечнику — перфорації, перитоніт, інвагінації тощо. Якщо ці явища супроводжуються агранулоцитозом і тромбоцитопенією, то врятувати життя хворому не вдається.
Період відновлення. Якщо за ГПХ наслідок нелегальний, то настає період відновлення. Його наслідки й період перебігу залежать від ступеня тяжкості ГПХ, тривалість його від 2—4 місяців до 1—3 років.
Безпосереднє відновлення розпочинається відразу після завершення агранулоцитозу. Знижується температура тіла, поліпшується самопочуття. Показники крові відновлюються: збільшується кількість лейкоцитів, тромбоцитів і ретикулоцитів. Відбувається також регенерація кісткового мозку— збільшується кількість клітин, які перебувають у процесі мітотичного поділу, молоді клітини переважають над дозрілими. Стан слизових оболонок порожнини рота, носоглотки та шлунково-кишкового тракту також поліпшується. Починає відростати волосся. Водночас ще тривалий час реакція серцево-судинної системи на фізичне навантаження відрізняється від фізіологічно нормальної. Можуть спостерігатися задихання, біль у м’язах і серці, тривале загоєння ран тощо.
Основні принципи лікування хворих на ГПХ. У період первинної реакції лікувальні заходи зводяться переважно до надання допомоги з використанням протиблювотних засобів. За переопромінення необхідне спеціальне лікувальне обстеження. Критичними за середнього ступеня хвороби є 12—20 доба після опромінення, тяжкого — 5—12 доба, а дуже тяжкого — перша доба або навіть години.
Хворим на середню і тяжку форми ГПХ у період розпалу призначають антибіотики широкого спектра дії та симптоматичні засоби, спрямовані на нормалізацію функцій серцево-судинної та центральної нервової систем.
За дуже тяжкої форми ГПХ проводять також деконтамітацію слизових оболонок і шкіри за допомогою неадсорбованих антибіотиків та антисептиків. У разі потреби роблять пересадку кісткового мозку.
Променева хвороба від внутрішнього опромінення. До умов, які визначають дію радіоактивних речовин, що потрапили в організм, належать: способи надходження в організм; агрегатний стан і хімічна структура речовин, їхня розчинність і всмоктуваність за місцем аплікації; сумарна активність радіонуклідів, тип випромінювання та його енергетичний спектр; характер розподілу й перерозподілу радіоактивних речовин в організмі; способи їх елімінації, швидкість виведення з організму та період розпаду; відносна чутливість тканин до дії іонізуючої радіації та радіоізотопів, як хімічних елементів; функціональний стан органів тощо.
Радіоактивні речовини можуть потрапляти в організм із продуктами харчування, питною водою, повітрям, через неуражену шкіру, рани, одноразово чи повторно. У невеликій кількості інкорпоровані радіоізотопи не викликають реєстрованих патологій, у більшій — неістотні порушення, а у великій — розвиток променевої хвороби. Остання розвивається тоді, коли радіоактивні речовини потрапляють в організм у кількості, що перевищує граничну в 6—10 разів.
У разі потрапляння в організм радіоізотопів цезію, стронцію та інших, які добре ресорбуються, перебіг променевої хвороби майже не залежить від способів надходження цих радіоізотопів в організм і визначається переважно їхньою тропністю.
За надходження в організм радіоізотопів, які погано всмоктуються, клінічна картина хвороби визначається в основному способами їх потрапляння. Переважно вражаються ділянки надходження цих радіоізотопів. Так, за перорального потрапляння радіоізотопів цезію, ітрію, лантану, урану та деяких інших, які обмежено здатні надходити в порожнини кишечнику, у кров і лімфу, відбувається дифузне ураження шлунково-кишкового тракту — розвиток виразково-некротичного ентероколіту.
Важливе значення при розвитку променевої хвороби за дії інкорпорованих радіоізотопів має тип їх розподілу в організмі. Так, наприклад, радіоізотопи цезію, рубідію, необію, полонію більш чи менш рівномірно нагромаджуються в м’яких тканинах, викликаючи переважно атрофію м’язів, селезінки, сім’яних залоз, пригнічення процесів кровотворення. Радіоізотопи урану спочатку діють на травний канал, а відтак — нирки. Гетеротропні радіоізотопи, такі як цезій, лантан, аурум тощо, викликають зміни в слизовій оболонці шлунково-кишкового тракту, а також цироз печінки, пухлини залоз внутрішньої секреції, кісткової тканини. Остеотропні радіоізотопи стронцію, барію, ітрію, радію, плутонію та інші пригнічують кістково- мозкове кровотворення та спричиняють ураження кісткової тканини.
За внутрішнього опромінення променева хвороба може бути легкого, середнього й тяжкого ступеня. Залежно від особливостей дії інкорпорованих радіоізотопів можуть уражатися, як уже зазначалося, як окремі органи, так і системи (кровотворення, травлення, виділення, дихання, зору, репродукції тощо).
При надходженні радіоізотопів в організм передбачається раннє використання методів і засобів зниження їх усмоктування та прискорення виведення з організму. Це забезпечується прийманням сорбентів, промиванням шлунка, призначенням проносних засобів і клізм тощо. Заміна радіоізотопів стабільними при прийнятті збагачених ними препаратів або продуктів харчування на всіх етапах їхнього метаболізму сприяє прискоренню їх виведення. Для поліпшення функціонування найчутливіших до дії інкорпорованих речовин органів і систем необхідно проводити відповідну терапію.
Інфекційні та геморагічні ускладнення виникають унаслідок надходження в організм великої кількості радіоізотопів, які опромінюють організм у дозах, що перевищують 10 Гр на все тіло за кілька днів. За дії таких доз необхідно призначати антибіотики та симптоматичні засоби.
Хронічна променева хвороба (ХПХ). Вона виникає за тривалої дії на організм іонізуючого випромінювання у дозах, які перевищують граничнодопустимі.
Характерними рисами ХПХ є: 1) ураження органів та систем, вираженість і строки розвитку якого визначаються сумарною дозою, видом та інтенсивністю опромінення, а також фізіологічними особливостями структури та функції органа; 2) тривалість і хвилеподібність перебігу, оскільки поряд із наростанням ефектів пошкодження розвиваються й відповідні пристосувальні реакції.
Вирізняють також два варіанти розвитку ХПХ: 1) виникнення синдромів внаслідок дії загального зовнішнього опромінення або надходження в організм ізотопів, які швидко й рівномірно розподіляються в усіх органах і тканинах; 2) переважне ураження окремих органів і систем унаслідок інтенсивного опромінення їх ізотопами із чітко вираженою вибірковістю депонування або місцевого опромінення від зовнішніх джерел.
За тривалого впливу випромінювань і після їх припинення або зниження інтенсивності умовно виділяють такі періоди: 1) формування захворювання, або власне ХПХ; 2) відновлення; 3) наслідки.
Перший період визначається часом нагромадження основної частини сумарного променевого навантаження, тобто тривалістю роботи в несприятливих умовах, найближчими роками (до 1—3 років) після припинення або різкого зниження інтенсивності опромінення. У цей період і формується основний клінічний синдром ХПХ із характерними для нього проявами.
Залежно від дози опромінення та індивідуальних особливостей організму вираженість клінічних проявів може бути різною. Ступінь тяжкості ХПХ може бути легким, середнім, тяжким і дуже тяжким. По суті, це фази розвитку одного патологічного процесу. У разі продовження опромінення в досить великих дозах вони послідовно змінюють одна одну. Залежно від часу припинення опромінення (або зниження його дози до допустимого рівня) та характеру змін, які розвинулися на цей час, захворювання обмежується тим чи іншим ступенем тяжкості й далі не прогресує.
Період відновлення за ХПХ зазвичай настає через 1—3 роки після припинення опромінення або за різкого зниження його інтенсивності — менше 0,05 Гр/рік. До того часу звичайно завершується основний цикл первинно-деструктивних змін і чітко переважають репаративні процеси, які розпочалися раніше. Хронічна променева хвороба може завершуватися: 1) цілковитим відновленням— клінічним видужанням; 2) відновленням із дефектом; 3) стабілізацією змін, які спостерігалися раніше; 4) погіршенням стану здоров’я та розвитком ряду синдромів, частково зумовлених опроміненням, але поліетіологічних за походженням (лейкоз, анемія, прискорена вікова інволюція).
За ХПХ вирізняють різні за ступенем тяжкості ураження, які відповідають певному діапазону сумарних доз та інтенсивності тривалого опромінення. При захворюванні, зумовленому загальним рівномірним опроміненням, виокремлюють такі критерії ступеня його тяжкості: 1) поширення патологічного процесу в організмі тобто ураженням органів і систем з різною радіочутливістю; 2) характер і глибина змін (функціональні чи анатомічні структурні зміни);
3) ступінь повторювання патологічних Проявів і повнота відновлення після припинення чи значного зниження інтенсивності опромінення (до граничнодопустимого рівня) і проведення лікування.
Набутий радіаційною медициною досвід свідчить, що ХПХ може спостерігатися в людей, котрі протягом тривалого часу постійно або систематично повторно зазнавали зовнішнього впливу іонізуючого випромінювання в малих дозах, які перевищували граничнодопустимі. Ця хвороба може зумовлюватися також постійною дією радіоактивних речовин, які потрапили в організм через дихальні шляхи, пошкоджену шкіру чи травний канал і міцно зафіксувалися в тканинах на більш-менш тривалий час (залежно від тривалості періоду їхнього напіврозпаду та швидкості виведення з організму). ХПХ може розвинутись і внаслідок поєднаного внутрішнього та зовнішнього опромінення. Хронічна променева хвороба є, по суті, професійною, але може виникнути і як ускладнення внаслідок лікувального застосування іонізуючого випромінювання. Залежно від перебігу та тяжкості хвороби існують кілька ступенів ХПХ. Кожна з них є певною стадією розвитку патологічного процесу, проте розмежування хвороби за ступенями умовне. ХПХ є загальним захворюванням організму, за якого значно знижується його імунологічна реактивність. Клінічна картина ХПХ охоплює переважно зміни з боку нервової, кровотворної, серцево-судинної, травної систем, нирок, а також порушення обмінних процесів та ендокринних функцій.
Інший перебіг має променева хвороба, зумовлена дією радіонуклідів із чітко вираженою органотропністю або місцевим зовнішнім опроміненням. При цьому відзначається переважно місцева пошкоджуюча дія.
Легкий ступінь тяжкості ХПХ. За цього ступеня захворювання відбуваються, головним чином, вегетативно-вісцеральні порушення, початкові астенічні прояви, помірні зміни складу периферійної крові. Погіршується самопочуття, підвищується втомлюваність, знижуються фізична та розумова працездатність, розладнується сон, підвищується збудливість. Водночас відбувається порушення травної системи — дискінезія кишковика та жовчних шляхів, диспептичні явища.
Вегето-судинна дистонія та порушення функцій внутрішніх органів, розвиток початкової астенізації призводять до виникнення ас- теновегетативного синдрому. З часом астенічні явища можуть проявлятися більш виражено — посилюється головний біль, періодично з’являється нудота та запаморочення, знижується пам’ять, наростає загальна слабкість тощо.
Середній ступінь тяжкості ХПХ. Цей ступінь хвороби характеризується подальшим розвитком астеновегетативних порушень, збільшенням їхньої тяжкості. Уже можуть з’явитися початкові ураження центральної нервової системи, зокрема порушення рефлексів, розлади вестибулярного апарату й нервово-судинної регуляції, виникнення проксимальної тахікардії тощо. Відбуваються також розлади серцево-судинної системи.
За цього ступеня тяжкості ХПХ особливо уражується кровотворна система. Кількість лейкоцитів у периферійній крові знижується, лейкопенія має стійкий характер і супроводжується нейтро- і лімфо- цитопенією. Спостерігаються порушення білкового, вуглеводного та холестеролового обміну в крові.
Може відбуватися також порушення функцій ендокринної системи, моторики кишечнику, початкове клітинне спустошення кісткового мозку, розвиток токсичного гепатиту, посилення інфекційних хвороб.
Тяжкий ступінь ХПХ. Йому притаманні характерні тяжкі зміни: виражена дистрофія органів, пригнічення кровотворення, утрата регенеративної здатності тканин, поява шкірної і носової кровотечі тощо. У кістковому мозку затримується дозрівання клітин. Спостерігаються тяжкі зміни функцій нервової системи, зокрема розвиток енцефалопатії. Уражається також травний тракт, різко ослаблюється імунна система, відбувається епіляція, з’являється ламкість нігтів та ін. Стан хворого різко погіршується.
Дуже тяжкий ступінь ХПХ. Він характеризується надзвичайним виснаженням хворого. Спостерігається гіпоплазія або аплазія кісткового мозку, крововиливи, сепсис, виразково-некротичні ураження слизової оболонки порожнини рота, носоглотки та травного тракту, ураження нервової системи, дистрофічні та некротичні зміни тканин і органів тощо. Зі збільшенням терміну опромінення та сумарної дози настає летальний кінець.
У наш час тяжкий ступінь ХПХ завдяки проведенню профілактичних та лікувальних заходів малоймовірний. Летальний наслідок може бути викликаний порушенням діяльності життєво важливих органів і систем. Варто враховувати посилення уражаючої хронічної дії іонізуючої радіації іншими чинниками: токсичними хімічними речовинами, електромагнітними неіонізуючими випромінюваннями, курінням, зловживанням алкоголем, неповноцінним харчуванням, погіршенням побутових умов тощо.
Лікування хворих на ХПХ. Воно може бути ефективним тільки за умов припинення переопромінення, усебічної діагностики хворого для визначення ступеня ураженості організму та призначення лікування. Лікування легкого та середнього ступенів тяжкості ХПХ передбачає неодмінне проведення загальнозміцнювальних заходів, лікувальне висококалорійне вітамінізоване харчування.
Лікування астенічних станів проводять нейротропними препаратами. За інфекційних ускладнень використовують антибіотики. Симптоматичними засобами нормалізують діяльність внутрішніх органів, нервової системи. Іноді доцільно застосовувати переливання крові.
Лікуючи хворих на тяжку форму ХПХ, особливу увагу приділяють антиінфекційним заходам та боротьбі з геморагічним синдромом. Призначається комбіноване лікування з використанням антибіотиків широкого спектра та антимікотичних препаратів, а також ліків, які знижують проникність судинних стінок (вітамінів С, K і Р, кальцію хлориду тощо). Симптоматичними засобами нормалізують діяльність серцево-судинної, дихальної, травної, ендокринної та нервової систем, стимулюють імунну систему тощо. Систематично переливають цільну кров, її плазму, еритроцитарну, лейкоцитарну та тромбоцитарну масу.
Репродуктивна функція за дії іонізуючої радіації. Статеві залози, як уже зазначалося, належать до високочутливих щодо дії іонізуючої радіації органів. Вважається, що в людини за потужності по- глинної дози 0,001 Гр/добу через 1—2 роки (досягнення сумарної дози 1,0—2,25 Гр) уже відбувається зміна активності сперматозоїдів в еякуляті та дегенеративно-дистрофічні зміни у вигляді атрофії яєчок. Помітні такі зміни спостерігаються за дії дози 0,005— 0,1 Гр/добу — істотне зменшення кількості сперматазонів і маси яєчок, яке ще може змінитися поступовим відновленням нормального стану яєчок. Стійка чоловіча стерильність можлива в осіб, що зазнали опромінення яєчок (наприклад, під час променевої терапії) унаслідок дії 30—40 Гр.
На відміну від сперматогенезу, при оогенезі всі яйцеклітини яєчника жінок виникають ще в ембріональний період розвитку, а потім лише дозрівають. Вважається, що в результаті дії дози 0,01 Гр/добу тільки за досягнення сумарної дози 0,1 Гр відбувається зменшення кількості первинних фолікулів яєчника, яке помітно не прогресує внаслідок дії такої дози. Хронічне опромінення в дозі 0,00001— 0,0001 Гр/добу в сумарній поглинній дозі близько 0,4 Гр викликає незначні та порівняно нечасті зміни тривалості менструального циклу без відхилень перебігу вагітності, пологів і стану немовлят.
Стерильність жінок виникає під дією іонізуючої радіації в дозі близько 10 Гр і стає стійкою внаслідок загибелі всіх первинних фолікулів.
Вплив іонізуючого випромінювання на зародок і плід. Радіочутливість ембріона і плоду набагато вища, ніж організму людини після народження і в дорослому віці. Тому ефекти опромінення в них мають певні особливості.
Внутрішньоутробний розвиток дитини відбувається у 3 періоди: передімплантаційний, органогенезний і фітогенезний (плодовий період). Передімплантація починається з моменту запліднення яйцеклітини. Зазнаючи швидкого поділу, запліднена яйцеклітина одночасно рухається протягом 9 діб по яйцепроводу від яєчника до матки і тут занурюється (імплантується) у її слизову оболонку на 11 добу після запліднення.
Поглинута в цей період досить велика доза радіації виявляється смертельною для крихітного зародка, що складається лише з кількох
клітин. За нижчих рівнів опромінення пошкодження виявляються не настільки катастрофічними, зародок зберігає здатність до нормального розвитку.
Радіологічні дослідження свідчать, що в період перед імплантацією радіочутливість зародка дуже залежить від тривалості опромінення (діб, годин). Зміни радіочутливості, очевидно, зумовлені кількістю клітин, яку він уже має на момент опромінення, фазою генераційного циклу, в якій ці клітини перебувають.
Найвища радіочутливість відзначається одразу після занурення спермію в яйцеклітину. В експериментах з опроміненням рентгенівським і у-променями загибель 50 % сперміїв спостерігалася за дози 0,15 Гр на момент занурення їх і лише за дози 0,3 Гр — через 4—6 год. У цей час у заплідненій яйцеклітині розпочинається процес подвоєння хромосом, який передував першому поділу. Другий пік радіочутливості збігається з часом появи зародка із зародкового міхура безпосередньо перед імплантацією.
Після імплантації зародка в слизову оболонку матки настає органогенез — період, який триває в людини з 9 доби по б тиждень життя після зачаття. У цей період починається диференціювання клітин зародка та утворення його органів, а також частин тіла. Порушенню розвитку зародка в період органогенезу передує ланцюг різноманітних реакцій і подій. їхній тип і тривалість залежать від величини дози і, особливо, від стадії розвитку на момент опромінення. Домінуючий тип радіаційних пошкоджень у процесі формування майбутніх органів представлений різноманітними тератогенними дефектами, каліцтвом.
До найхарактерніших проявів радіаційних тератогенних ефектів належать зміни в скелеті, що формується. Різні його пошкодження зафіксовано в діапазоні доз 0,05—0,25 Гр на 7 добу після зачаття.
У період органогенезу спеціалізацію клітин часто супроводжує їхня міграція. Особливий складний розвиток має центральна нервова система, що зумовлює її надзвичайну чутливість до радіації. Дефекти нервової системи індукуються дозами порядку 0,1 Гр на найчутливіших стадіях розвитку. У переліку наслідків опромінення в період ембріогенезу на першому місці структурні й функціональні порушення центральної нервової системи. Відзначений високий відсоток мікроцефалії в поєднанні з розумовою відсталістю. Мінімальна доза, що зумовлювала таку патологію в дітей, які потрапили під дію опромінення під час ядерного бомбардування Хіросіми та Нагасакі, виявилася нижчою, ніж 0,2 Гр. Порушення функції головного мозку зафіксовано в них унаслідок дії дози близько 0,1 Гр.
Фітогенез, остання стадія розвитку плоду, розпочинається в людини з 7 тижня після зачаття. Це найбільш вивчений у радіоембріологічному плані період внутрішньоутробного розвитку. З’ясовано, що іонізуюча радіація на 4—11 тижнях вагітності зумовлює формування аномалій різних внутрішніх органів. Опромінення на 11—16 тижнях викликає розвиток мікроцефалії, стійке пригнічення розвитку плоду, розвиток аномалій статевих органів. Унаслідок дії іонізуючої радіації на 16—20 тижнях вагітності спостерігається помірна мікроенцефалія, гальмування росту плоду. Опромінення після 30 тижня вагітності швидше викликає функціональні розлади, ніж морфологічні.
При опроміненні під час внутрішньоутробного розвитку спостерігається висока ймовірність утворення пухлин. Серед онкозахворювань значну частину становлять пухлини головного мозку. Наслідком опромінення вагітних жінок дозами 0,1—0,2Гр було народження дітей із вадами розвитку (уповільнення фізичного розвитку, розумова відсталість).
Аналіз динаміки прояву окремих вад показує, що в забруднених радіоізотопами районах унаслідок аварії на Чорнобильській АЕС підвищується частота всіх вад, особливо незаростання губи та піднебіння, подвоєння нирок і сечоводів, полідактилії і дефектів нервової трубки. У походженні полідактилії велике значення мають домінантні мутації. Арафії (як обличчя, так і нервової трубки) — вади переважно мультифакторального генезу, а внесок генетичних факторів у виникнення подвоєння нирок і сечоводів не визначено. У медичних абортусів (викидень) не спостерігається приріст анеуплодій (моно- або трисомій), не вдається також виявити прямого тератогенного ефекту в загибелі клітин закладок органів як одну з радіобіологічних реакцій ембріона.
Радіаційно-індукований канцерогенез. Численні дослідження свідчать, що внаслідок дії іонізуючої радіації в людей зростає частота появи злоякісних пухлин різної локалізації. Більшість злоякісних пухлин виникає з однієї (ініціальної) клітини, яка трансформується. Початковим етапом злоякісної трансформації клітин є поява мутації онкогена (гена — супресора пухлин). Онкогени, що відповідають за розгортання в клітині генетичної програми, яка переводить їх у розряд злоякісно змінених, передіснують у нормальному клітинному геномі. Розгортання в клітині програми онкогена може здійснюватися під впливом як зовнішніх, так і внутрішніх факторів організму.
Процес розвитку радіаційного ураження клітини має етап, який є спільним з ураженням її хімічними канцерогенами — постреплікативна репарація ДНК. Помилки цього процесу вважаються універсальними джерелами появи мутацій. Більше того, унаслідок дії деяких канцерогенів ідентичними з дією іонізуючого випромінювання
виявляються й об’єкти постреплікативної репарації — пробіли, що перекриваються. Вони не видаляються дореплікативною репарацією і проходять реплікативну вилку.
Між опроміненням і розвитком пухлин минає, як правило, багато часу, що зумовлено існуванням латентного періоду. У людини він для певних злоякісних захворювань може тривати понад 30 років. Термін прояву радіаційно-індукованого лейкозу, який має найменший латентний період, зазвичай становить близько 10 років.
Лейкози належать також до злоякісних хвороб, частота виникнення яких більша,.ніж інших онкозахворювань, що спричинені дією іонізуючої радіації. Це зумовлено як онкогенною дією іонізуючої радіації, так і безпосереднім її впливом на репродукцію клітин крові.
У дослідах на щурах показано, що підвищення частоти виникнення лейкозів у кілька разів порівняно з контролем може відбутися за гострого опромінення дозою 5—7 Гр і не менше 12—15 Гр за фракцінованого. Зауважимо, що чим більша потужність дози, тим вища ймовірність розвитку лейкозів та інших онкозахворювань.
Особливістю онкогенної дії іонізуючого випромінювання є те, що загальне опромінення всього тіла викликає більшу частину появи лейкозів, ніж локальне (наприклад, лімфатичних вузлів). Крім цього, загальне гостре опромінення з відносно великих доз спричиняє лейкози частіше, ніж фракціоноване і тим паче хронічне.
Оцінено, що за тривалого опромінення кісткового мозку людини частота виникнення лейкозів збільшується за дії доз 5—35 Гр. Так, кількість хворих на лейкоз людей, які пережили атомне бомбардування Хіросіми й Нагасакі, серед осіб, опромінених у дозах 10— 14 Гр в I960—1980 рр. становила на рік на 1 млн населення 563— 1336 осіб, а в дозах 0,3—2,0 Гр — 42—68 осіб. Варто зазначити, що спонтанний рівень лейкозів становить 11 осіб на 1 млн населення.
Лейкози є одними з поширених радіаційно-індукованих онкозахворювань, але виникають також інші, особливо в тканинах і органах з високою проліферативною активністю їхніх клітин— яєчниках, яєчках, молочних залозах та ін. Так, наприклад, для мишей граничною дозою, що не викликає розвитку пухлин яєчок, можна вважати 0,35 Гр для гострого і 0,9 Гр для хронічного опромінення.
Вважається, що для людини граничні дози онкогенної дії іонізуючої радіації перебувають у межах 0,5—5,0 Гр. Однак, як уже зазначалося, домінуючою зараз концепцією є безпорогова дія іонізуючої радіації. Це означає, що незважаючи на різке зменшення частоти прояву онкогенної дії іонізуючої радіації зі зменшенням дози, існує, хоча й дуже мала, імовірність виникнення злоякісних пухлин і за менших доз, ніж 0,5 Гр.
Вплив іонізуючої радіації на тривалість життя. Найпоширеніша гіпотеза стосовно механізмів старіння організмів убачає причину старіння в нагромадженні пошкоджень ДНК з віком: одноланцюгових і дволанцюгових розривів, делецій, зшивок білок-ДНК тощо. Іонізуюча радіація теж породжує подібні порушення структури ДНК у клітинах.
Зауважимо, що від стану ендокринної системи залежать тривалість циклів розвитку і зміна популяцій клітин у тканинах різних органів, у тому числі високочутливих до дії іонізуючої радіації (кровотворення, епітелію слизових оболонок та ін.).
Існує також явище радіаційно-індукованого апоптозу — прискорення генетично запрограмованої загибелі клітин.
Вплив іонізуючої радіації на тривалість життя мишей і щурів відносно добре вивчено, на відміну від людини. Так, для мишей установлено, що в разі гострої дії у-випромінювання на кожен 1 Гр дози очікувана тривалість життя скорочується приблизно на 5,4 %. Зменшення тривалості життя залежить від дози опромінення — чим вона вища, тим цей ефект більш виражений. Також існує залежність цього ефекту від виду опромінення. Так, для нейтронів він майже в 10 разів більший, ніж для γ-променів. Зазначимо, що за однакових доз хронічна дія іонізуючої радіації викликає менше скорочення тривалості життя, ніж фракційна і ще менше, ніж гостра. Так, за потужності дози 0,1 Гр/тиждень тривалість життя мишей зменшується приблизно на 10 %.
Розрахунки свідчать, що поглинна доза 0,001 Гр/добу скорочує тривалість життя людини на 0,5—0,6 %, але такі зміни неможливо виявити на фоні коливання цього показника, особливо внаслідок впливу інших несприятливих чинників.
Профілактичні протипроменеві засоби. Речовини, які здатні за профілактичного використання попереджувати або послаблювати ступінь радіаційно-індукованих уражень, називають радіопрожекторами. У широкому розумінні цього поняття до радіопротекторів належать стимулятори радіорезистентності і блокатори надходження радіоізотопів у тканини і органи (речовини—захисники від внутрішнього опромінення).
Речовини, які безпосередньо є радіопротекторами, за профілактичного використання мають захисну дію, що проявляється в збереженні життя опроміненого організму, або послаблюють ступінь тяжкості променевого ураження з пролонгацією стану дієздатності та тривалості життя. На відміну від інших радіозахисних засобів, протипроменевий ефект є для них основним серед інших фармакологічних властивостей. Радіопротектори ефективні тільки за умов
профілактичного використання, їхня дія проявляється в перші хвилини або години після введення, за відносно короткочасового та гострого опромінення.
Найчастіше ступінь протирадіаційного захисту радіопротекторів характеризується фактором зменшення дози (ФЗД), який відображає кратність зниження ступеня ураження і обчислюється так:
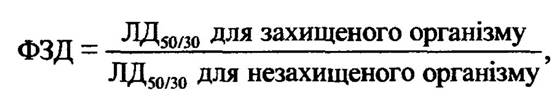
де ДД50/30 — напівлегальна доза, за якої через 30 діб гинуть 50 % опромінених організмів.
Оскільки, як уже зазначалося, зі збільшенням дози спочатку розвивається гемопоетичний, а відтак гастроінтестинальний і церебральний синдроми, то радіопротектори за своїм призначенням доцільно розподіляти на три групи: міелопротектори, і церебропротектори.
Дія мієлопротекторів спрямована насамперед на захист кровотворних органів, ураження яких визначає ступінь тяжкості променевої хвороби внаслідок дії доз 1—10 Гр.
Значення ФЗД для перспективних мієлопротекторів може сягати 1,5—1,7. Механізм їхньої дії зумовлений насамперед, залежно від структури, здатністю пригнічувати нуклепротеїнний обмін і процеси мітотичного поділу або викликати стан гіпоксії. Останній призводить до розвитку так званого оксигенового ефекту. Відомо, що за дії іонізуючої радіації та наявності оксигену утворюються пероксидні вільні радикали, які посилюють вплив випромінювання. Зменшення вмісту оксигену знижує цей ефект.
До препаратів, які викликають переважно гіпоксію, належать біологічно активні аміни та їхні агоністи — серотонін та інші похідні індолілалкіламінів (зокрема, мексамін, адреналін, мезатон, клонідин, епінефрин тощо).
Одним з ефективних радіопротекторів, що викликають гіпоксію, є індралін (індраліногоніст а-адренореактивних структур). Його дія проявляється через 5—10 хв і зберігається протягом 1 год за короткочасного впливу іонізуючої радіації (у-променів, електронів, протонів, швидких нейтронів) великої потужності. Радіозахисна дія індраліну зберігається за опромінювання в дозах, які перевищують мінімально летальну в 1,5—2 рази.
Іншу, найчисленнішу групу мієлопротекторів, механізм дії яких реалізовується на клітинному рівні, становлять сірковмісні сполуки, зокрема меркапроетиламін, його дисульфід, цистамін та інші похідні цих сполук (гамафос, цистофос та ін.). Циклічні аналоги тістаміну — гіазоліни та тіозолідини — діють довше, ніж сам цистамін. Це пояснюється тим, що в організмі вони повільно розщеплюються, коли переходять в активну форму. Одним із важливих радіопротекто- рів, що містить SH-групу, є глутатіон. Він міститься в клітинах крові у великій кількості й забезпечує стійкість організмів до дії іонізуючої радіації на високому рівні.
Сірковмісні радіопротектори приймають перорально, і тому для нагромадження в радіочутливих органах необхідний час 40—50 хв після прийому. їхня протипроменева дія становить 3—4 год, після чого за потреби можна повторити прийом радіопротектора. Вони відносно ефективні сполуки, їхній ФЗД дорівнює, як правило 1,3—1,4, а для цистаміну — 1,5.
Радіопротекторні властивості сірковмісних сполук визначаються головним чином наявністю в їхній структурі вільної та легковивіль- нюваної SH-групи. Завдяки цьому вони є відновлювачами, які здатні перехоплювати утворені внаслідок опромінення вільні радикали. Крім цього, сірковмісні радіопротектори мають виражено комплексотво- рну здатність до двовалентних металів, які є каталізаторами окисних процесів. Ці сполуки також здатні викликати гіпоксичний ефект за рахунок окиснення сульфгідрильних сполук. Ще одна важлива властивість сірковмісних радіопротекторів — це їхня здатність тимчасово інгібувати мітотичну активність клітин радіочутливих тканин, зокрема кровотворних, завдяки впливу на синтез ДНК і мітоз. Це дає можливість зупинити клітинний цикл у радіостійкому стані.
За дії іонізуючої радіації в дозах 10—20 Гр, як уже зазначалося, розвивається променева хвороба, у клінічній картині якої переважає ураження кишкового тракту, що зумовлено розвитком специфічного радіаційно-індукованого ентериту.
Нині немає ефективних фармакологічних засобів захисту від цього типу променевих уражень, але експериментальні дані свідчать про можливість створення ентеропротекторів. Зокрема, показано, що мієлопротектори цистамін і гаммафос проявляють певну захисну дію на проліферацію ентероцитів слизової оболонки кишечнику. Деякі похідні тіазолу, триазолу, тиадиазину й гетероалкану підвищують радіорезистентність стовбурових клітин епітелію кишечнику, завдяки чому збільшується тривалість життя опромінених тварин у 4—5 разів і кишкова форма променевої хвороби «переходить» у кістково-мозкову. Аналогічний вплив на стовбурові клітини ентероцитів здійснюють деякі простагландини та їхні аналоги. Механізм їхньої радіозахисної дії пов’язаний зі зменшенням використання оксигену клітинами епітелію кишечнику.
Домінуюче ураження центральної нервової системи, як уже зазначалося, виникає внаслідок дії доз іонізуючої радіації понад 80 Гр — з’являється церебральна форма променевої хвороби. Вона характеризується надзвичайно тяжкими цереброваскулярними порушеннями — утратою свідомості, дезорієнтацією, атаксією, судомами, порушенням дихання, різким падінням артеріального тиску та іншими розладами. Смерть настає протягом перших 3 діб, а за дії доз 150 Гр і більше — годин. За сучасними уявленнями, у розвитку розладів центральної нервової системи провідну роль відіграє надзвичайно інтенсивне зменшення вмісту НАДН і АТФ, що призводить до деенергізації та загибелі нейронів. Профілактичне введення фармакологічних засобів, які перешкоджають зменшенню енергетичноємних сполук (деяких металовмісних комплексів, глутаматергічних блокаторів, амідів, ароматичних карбонових кислот та ін.), а також безпосередньо НАДН, флавопротеїнів, АТФ як окремо, так і в суміші сприяє збільшенню тривалості життя тварин у 8—10 разів за дії доз 100—150 Гр. У цьому разі причиною загибелі тварин є не порушення центральної нервової системи, а кишкові прояви променевого ураження. Церебропротектори проявляють захисну дію від 6 год до 1 доби після їх уведення в організм.
Стимулятори радіорезистентності. До цієї групи належать препарати, які підвищують радіорезистентність у широкому діапазоні доз — від «малих» до тих, що викликають гемопоетичні синдроми. Вони мають широкий спектр фармакологічних властивостей, серед яких радіаційний захист частот не є основним. Крім цього, вони проявляють протипроменевий ефект не тільки за гострого, а й пролонгованого опромінення, а також ефективні за умов як профілактичного, так і лікувального використання.
Для прояву дії стимуляторів радіорезистентності потрібне відносно довготривале їх надходження в організм (зазвичай 8—24 год), але стан радіорезистентності може зберігатися від кількох діб до 1— 2 тижнів.
Серед таких препаратів вирізняють такі, що мають: 1) достатньо виражені радіозахисні властивості та які здатні проявляти ефект за опромінення в дозах, що викликають променеву хворобу; 2) відносно низьку протипроменеву активність, але здатні знижувати несприятливі наслідки (у тому числі віддалені) опромінення в дозах, які не спричиняють розвитку клінічних патологій.
До першої трупи належать імуномодулятори, гормональні препарати з естрогенною активністю та інші.
Серед імуномодуляторів із протипроменевою дією існують як мікробні препарати (різні вакцини), так і їхні екстракти та фракції (полісахариди) і ліпосахариди з бактерій і грибів. Таку дію проявляють, наприклад, вакцини з кишкової палички, черевнотифозна вакцина, ряд противірусних вакцин, продигіозан, пірогенал, гепарин, леван тощо. Перспективними стимуляторами радіорезистентності є цитокініни — поліпептиди, які регулюють ріст і диференціювання клітин, їм притаманні специфічні гемо- та імунорегулюючі властивості, здатність модифікувати репараційні процеси в кістковому мозку за опромінення. Виражену протипроменеву дію проявляють інтерлейкіни (лімфокіни, монокіни та ін.), гормони тимусу (тималін, тимоген, Т-активін). Зауважимо, що радіозахисна дія іму- номодуляторів зберігається протягом кількох діб після введення і повторне їх призначення збільшує їхню протипроменеву активність.
Екстрогени в початкові моменти дії гальмують проліферативну активність клітин кісткового мозку, що зменшує їх ураження іонізуючою радіацією. У подальшому на перше місце виходять процеси стимуляції синтезу білка та нуклеїнових кислот, які забезпечують відновлення гемопоезу. З таких препаратів найбільш вивченим є ді- етилстильбестрол, для якого ФЗД дорівнює 1,15—1,2.
Протипроменеву дію проявляють також ряд полінуклеотидів і нуклеотидів (полірибоной, ридопсин, фосфаден тощо). Виражені радіозахисні властивості мають препарати дезоксинату (натрієва сіль ДНК, яку отримують із молочка осетрових риб), солі оротової кислоти (попередника піримідинових нуклеотидів), нуклеозид пурину рибоксин.
Довготривала дія іонізуючої радіації у відносно малих дозах спільно з психоемоційним стресом (як це було під час ліквідації наслідків аварії на ЧАЕС), дією хімічних речовин, гіпоксією тощо може супроводжуватися несприятливими астенонегативними, психосоматичними та імунологічними порушеннями, які знижують загальну (неспецифічну) резистентність організмів. Для профілактики таких порушень використовуються препарати вітамінів, вітамінно-амінокислотні комплекси, кофактори ферментів, адаптогени рослинного походження, продукти бджільництва і марикультур, аліментарні домішки, антиоксиданти.
Ці речовини здатні порушувати процеси біосинтезу білка, нуклеїнових кислот, вуглеводів і ліпідів, перетворення енергії тощо, що сприяє нормалізації кровотворення, імунологічної реактивності, пом’якшує біохімічні та фізіологічні прояви стресових реакцій. Усе це посилює адаптогени властивості організму до екстремальних чинників, у тому числі іонізуючої радіації.
До речовин такої дії належать вітаміни та вітамінокислотні комплекси — тетрафолевіт, амітетравіт, амівіт; адаптогени препарати
женьшеню, елеутерококу, китайського лимонника, левзеї, родіоли рожевої, золотого кореня та ін.; харчові домішки з адаптогенною дією— аутолізин, ферметолізат, амівіс, сукцинат і малат натрію тощо.
Біооксиданти здатні інактивувати радіотоксини (продукти переписного окиснення ліпідів, фенольних сполук та ін.), пригнічуючу дію на процеси клітинного поділу, викликають мутагенні та канцерогенні ефекти тощо. Серед біоантиоксидантів для профілактики широко використовують (3-каротин, антоціани, гідролізат мідій МІП-К і т. ін).
Антимутагенні властивості мають радіопротектори цистамін і гаммафос у дозах нижче радіозахисних за критерієм виживання. Таку саму дію проявляє рибоксин.
Харчові домішки, збагачені селеном, вітамінами-антиоксидантами, глютапіроном, дифторметиларнітином та іншими біологічно активними речовинами, знижують частоту появи лейкозів та інших радіаційно-індукованих віддалених ефектів.
Ризик розвитку генетичних наслідків дії іонізуючої радіації значно зменшують меланіни— складні комплекси, утворені полімеризацією окиснення і сполук дигідроксифенілу. Інгібітори протеїназ мають також антимутагенні та антиканцерогенні властивості за умов довготривалої дії іонізуючої радіації.
Індени, які містять п’яти- і шестикарбонові цикли та нітрогенні групи, проявляють донорську акцепторну здатність утворювати міжмолекулярні водневі та іонні зв’язки. Інденові сполуки (F-1, F-37, ОА-1 та ін.) сприяють переходу на них надлишкової енергії з опроміненої ДНК, що зменшує мутагенну дію пролонгованого опромінення.
Блокатори надходження радіоізотопів в організм. Для запобігання та зменшення нагромадження радіоізотопів в організмі використовують адсорбенти, іонообмінні препарати, нерадіоактивні (стабільні) блокатори накопичення радіоізотопів, прискорювачі виведення радіоізотопів тощо.
Ефективним засобом профілактики інкорпорованих радіоізотопів йоду в щитоподібній залозі є препарати з нерадіоактивним йодом — йодид калію, водоспиртова настоянка йоду, розчин Люголю. Оптимальна захисна доза йодиду калію — 0,25 г (1 пігулка) разом із чаєм, киселем або водою кожного дня протягом 7—10 діб; настоянка йоду або розчин Люголю — 3—5 крапель на склянку молока або води 3 рази на добу. Доцільно також наносити настоянку йоду на шкіру у вигляді сітки, уводити в раціон харчування продукти з високим вмістом нерадіоактивного йоду.
Для попередження всмоктування радіоактивних речовин із травного тракту в кров і лімфу, їх накопичення у внутрішніх органах використовують адсорбенти, здатні зв’язувати певні радіоізотопи. Так, наприклад, у разі надходження в шлунково-кишковий тракт ізотопів стронцію доцільно використовувати як адсорбент сульфат барію, полісурмін, окиснену целюлозу, альдегід кальцію окремо чи в суміші з гіалуроновою кислотою та ін. Для попередження всмоктування ізотопів цезію можна використовувати гексаціаноферат калію (фероцин), ортосифон, бентонітову глину, вермикуліт (гідрослюда), берлінську лазур, карбоксилазу. Петацин адсорбує ізотопи плутонію. Меланін проявляє не тільки антиоксидантні властивості та є антимутагеном, а й зв’язує ізотопи плюмбуму, лантану, цинку, хрому, купруму та меркурію. Іонообмінні препарати (наприклад, цеолій) зв’язують ітрій, трансуранові елементи, лантаніди. Для прискорення виведення з організму ізотопів полонію, кобальту, купруму та меркурію використовують пеніциламін і унітіол. Велика кількість спожитої води сприяє виведенню тритію. Окрім цього, існує ще велика кількість сполук, здатних захищати організми від внутрішнього опромінення.