БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 8. ГЛИКОЛИЗ, ЦИКЛ ЛИМОННОЙ КИСЛОТЫ, СИСТЕМА ТРАНСПОРТА ЭЛЕКТРОНОВ: РЕАКЦИИ ЭТИХ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
Стадия 1. Гликолиз
Гликолизом называют расщепление молекулы глюкозы или глюкозильного остатка гликогена на две молекулы пирувата.
Глюкоза или гликоген?
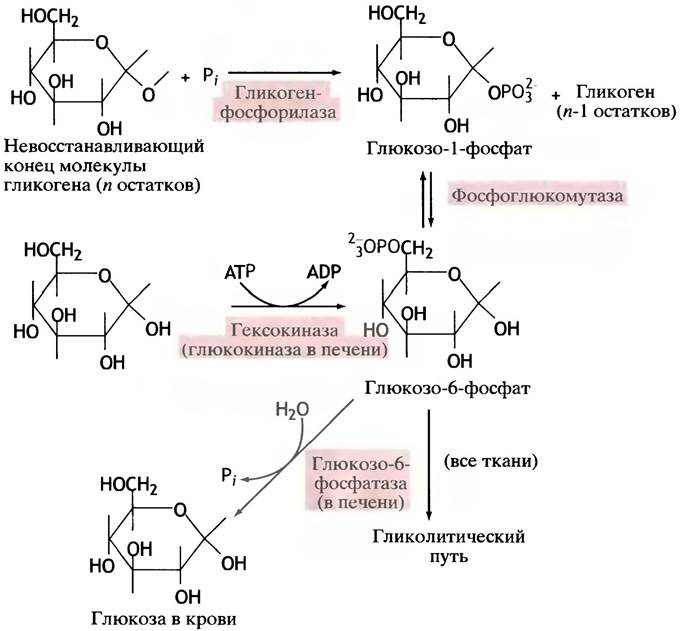
До сих пор мы обсуждали главным образом метаболизм глюкозы. Однако в обычных условиях большинство тканей обладает запасом гликогена, и он подвергается гликолизу в большей степени, чем глюкоза. Между этими процессами есть разница. В случае расщепления гликогена из него образуется глюкозо-1 -фосфат, который далее превращается в глюкозо-6-фосфат (см. с. 86). Последний в печени гидролизуется с образованием глюкозы, которая поступает в кровь. Однако глюкозо-6-фосфат также подвергается гликолитическому превращению и во всех тканях расщепляется до пирувата. Заметим, что глюкозо-6-фосфат образуется не только из гликогена, но также и из глюкозы в результате ее фосфорилирования АТР. Эта реакция является одной из стадий синтеза гликогена (см. с. 86). Будет ли использован глюкозо-6-фосфат для получения гликогена, пирувата или для насыщения крови глюкозой (в случае печени), зависит от физиологических потребностей организма и систем регуляции. Взаимосвязь между гликолизом, глюкозой и гликогеном показана на рис. 8.1. На фосфорилирование молекулы глюкозы с образованием глюкозо-6-фосфата затрачивается одна молекула АТР. В то же время АТР не расходуется при образовании глюкозо-6-фосфата из гликогена, поскольку энергия глюкозильной группы в гликогене (∆G0' гидролиза гликозильной группы) эквивалентна энергии фосфоэфирной связи.
Рис. 8.1. Образование глюкозо-6-фосфата из гликогена или глюкозы и его превращения. О регуляторных механизмах этих процессов см. в главе 12
Почему на начальном этапе гликолиза расходуется АТР?
Может показаться странным, что метаболический путь, рассчитанный на производство АТР, начинается с его потребления. На что расходуется АТР? Дело в том, что в гликолизе участвуют фосфорилированные соединения, а, чтобы профосфорилировать глюкозу, необходимо пожертвовать макроэргическим фосфатом. Однако в дальнейшем эта затрата компенсируется, так как в ходе гликолиза образуются две молекулы АТР.
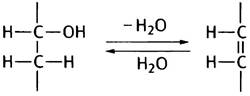
Зачем глюкозо-6-фосфат превращается во фруктозо-6-фосфат?
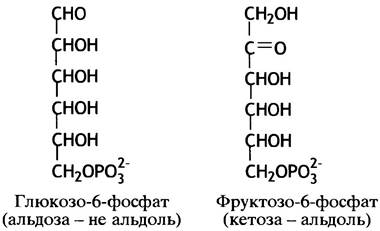
Следующий этап гликолиза состоит в изомеризации производного альдозы - глюкозо-6-фосфата, в производное кетозы - фруктозо-6-фосфат. Конечной целью гликолиза является расщепление глюкозы на два С3-фрагмента. Реакция альдольной конденсации протекает между альдегидом и кетоном (или между двумя альдегидами), которые конденсируются в α-кетоспирт, называемый альдолем, или β-гидроксикарбонильным соединением (рис. 8.2). Образование альдолей обратимо, и поэтому обратная реакция может быть использована для их расщепления. Вернемся к гликолизу. В отличие от глюкозо-6-фосфата, фруктозо-6-фосфат обладает альдольной структурой; это хорошо видно на линейных формулах данных соединений, представленных на рис. 8.3.
Рис. 8.2. Альдольная конденсация: реакция альдегида с кетоном или альдегидом
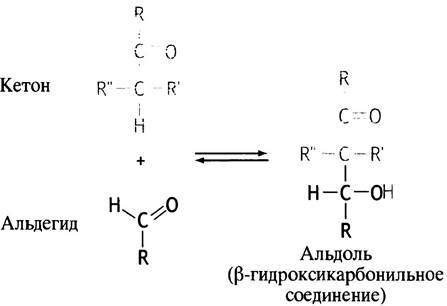
Рис. 8.3. Линейные формулы изомеров моносахаридов: альдозы и кетозы. Глюкозо-6-фосфат в растворе находится в равновесии с циклической пиранозной (шестичленной) формой, а фрук- тозо-6-фосфат - с фуранозной (пятичленной)
Глюкозо-6-фосфат изомеризуется во фруктозо-6-фосфат в реакции, катализируемой глюкозофосфатизомеразой. Затем другой фермент - фосфофруктокиназа с помощью АТР превращает фруктозо-6-фосфат во фруктозо-1,6-дифосфат. После этого альдолаза катализирует расщепление гексозодифосфата на два триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат (рис. 8.4).
Рис. 8.4. Превращение глюкозо-6-фосфата в два С3-соединения. Сахара для ясности представлены в виде цепочек
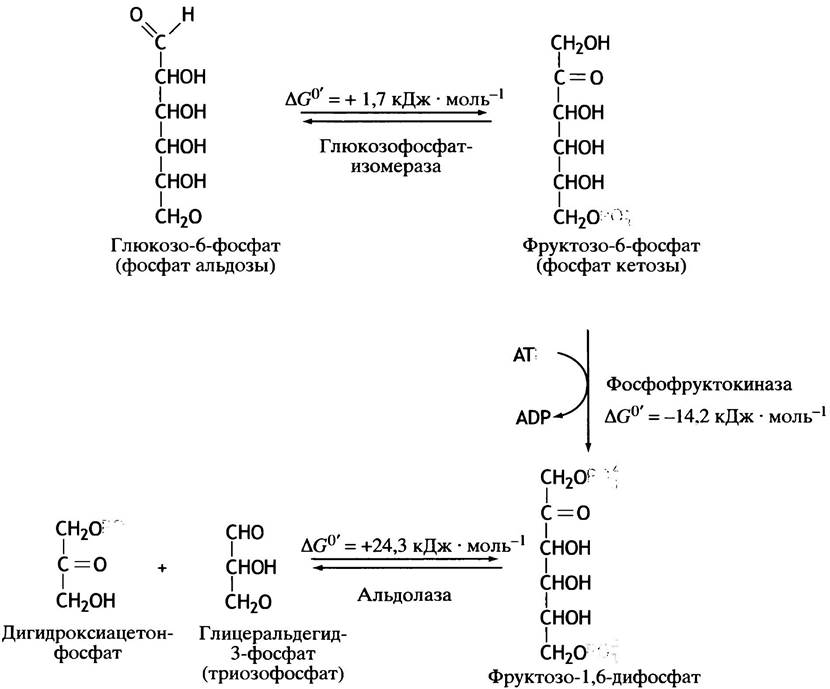
На рис. 8.5 представлена та же реакция, но приведены не линейные, а циклические структуры сахаров; фруктозо-6-фосфат показан в виде пятичленного кольца (фуранозная форма). Изменение свободной энергии при альдолазном расщеплении составляет ∆С°' = +24,3 кДж • моль-1. Казалось бы, такая реакция не должна протекать; возможна лишь обратная реакция. Но здесь есть тонкость: одна молекула фруктозо-1,6-дифосфата превращается в две, и потому не стандартное, а реальное изменение свободной энергии (∆G) сильно зависит от концентраций участников реакции. В условиях клетки величина ∆G мала, так что реакция вполне обратима.
Изменения свободной энергии ∆G°′ и ∆G при альдолазном расщеплении
Несмотря на то, что изменение стандартной свободной энергии при альдолазном расщеплении составляет ∆G°′ = +24,3 кДж • моль-1, эта реакция легко протекает, хотя гораздо менее эндоэргонические реакции в клетке невозможны. Мы знаем, что величина ∆G°′ соответствует стандартным условиям, когда концентрации исходных веществ и продуктов равны 1 М. Так как внутриклеточная концентрация метаболитов обычно находится в пределах 10-4 - 10-3 М, величина ∆G всегда отличается от значений ∆G°′. Знание величины ∆G°′ позволяет оценить возможность протекания той или иной реакции. В случае альдолазы это не так, поскольку величины ∆G прямой и обратной реакции в клетке отличаются мало. Это и является причиной необычного поведения альдолазной реакции.
Рис. 8.5. Превращение глюкозо-6-фосфата в два С3-соединения. Приведены наиболее часто встречающиеся циклические структуры сахаров
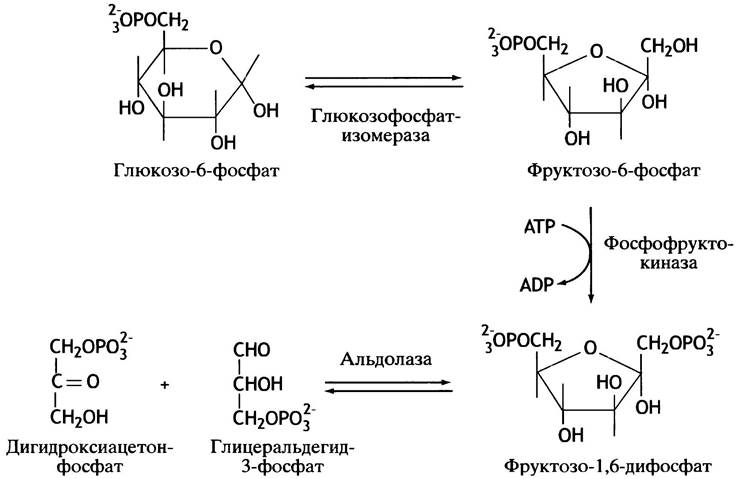
Дело в том, что в ходе прямой реакции число молекул удваивается. Реальное изменение свободной энергии ∆G связано со стандартным значением ∆G°′ следующим уравнением (см. главу 1):
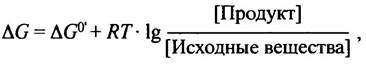
или в данном случае:
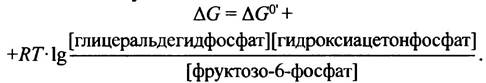
Поскольку концентрация продуктов невелика, величина RТ • ig {[продукты]/[реактанты]} имеет большое отрицательное значение, за счет чего реакция в клетке становится обратимой. Предположим, что концентрации всех реактантов в клетке равна 10-4 М, тогда
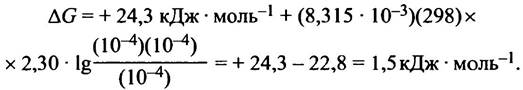
Значение ∆G при выбранных концентрациях реактантов допускает свободное обращение реакции.
Взаимопревращение дигидроксиацетонфосфата и глицеральдегид-3-фосфата
Глицеральдегид-3-фосфат и дигидроксиацетонфосфат являются молекулами-изомерами. Их взаимопревращение катализирует фермент триозофосфатизомераза.

Два вещества находятся в равновесии, но поскольку глицеральдегид-3-фосфат постоянно используется в последующей стадии гликолиза, весь дигидроксиацетонфосфат постепенно превращается в глицеральдегид-3-фосфат.
Глицеральдегид-3-фосфатдегидро- геназа. Образование макроэргического фосфата
Альдегидная группа в глицеральдегид-3-фосфате подвергается окислению с помощью NAD+. Для обычной реакции окисления группы -СНО в группу -СОО- ха
рактерно большое отрицательное значение ∆G, вполне соизмеримое со свободной энергией образования макроэргической фосфорильной группы. Поэтому в данном случае главная задача катализирующего реакцию фермента заключается в том, чтобы свободную энергию окисления использовать для получения макроэргического фосфата.
В активном центре глицеральдегид-3-фосфатдегидрогеназы расположен остаток аминокислоты цистеина, содержащий в боковой цепи тиольную (сульфгидрильную) группу, которая реагирует с альдегидной группой субстрата, образуя тиополуацеталь:
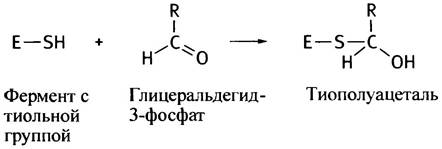
Это соединение подвергается окислению, отдавая электроны молекуле NАD+. При этом тиополуацеталь превращается в тиоэфир:
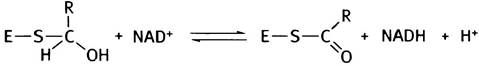
Как и ацетил-СоА, тиоэфир (R-СО-S-) является макроэргическим соединением, которое при фосфоролизе превращается в смешанный ангидрид фосфоглицериновой и фосфорной кислот:
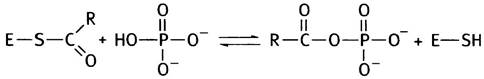
Высокоэнергетическая группа R-CO-PO2-3 может переносить фосфорильный остаток на ADP с образованием АТР. По чисто номенклатурным соображениям фермент, катализирующий такой перенос, назван не по прямой, а по обратной реакции фосфоглицераткиназой. Киназы всегда получают свое название по соединению, находящемуся по одну сторону с АТР в уравнении реакции (рис. 8.6.).
Рис. 8.6. Превращение глицеральдегид-3-фосфата в 3-фосфоглицерат
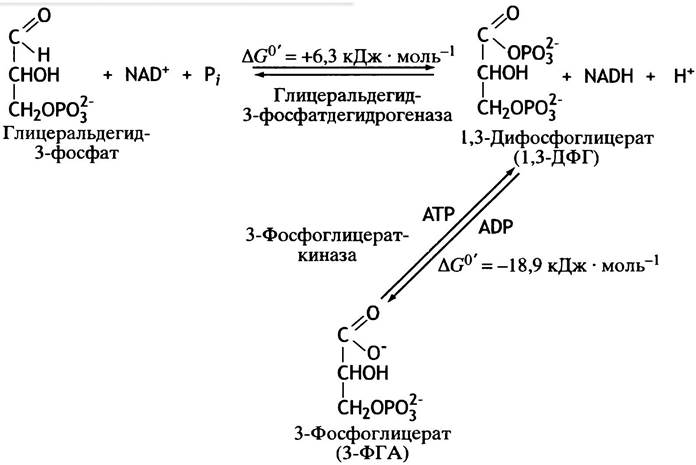
Образовавшаяся в ходе этого процесса фосфорильная группа остается прикрепленной к истинному субстрату фермента. Поэтому процесс получил название субстратного фосфорилирования. 3-Фосфоглицерат - низкоэнергетическое соединение фосфата, которое не может фосфорилировать ADP. Однако на следующих этапах гликолиза внутримолекулярные перестановки приводят к тому, что низкоэнергический фосфоэфир становится высокоэнергетической фосфорильной группой, переносимой на ADP с образованием АТР.
Заключительные стадии гликолиза
Сначала фосфорильная группа 3-фосфоглицерата переносится из положения 3 в положение 2 фосфоглицератмутазой.
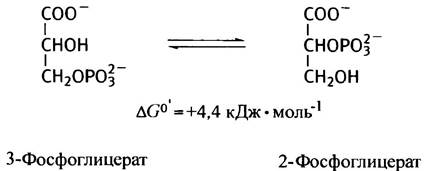
В таком виде реакция внутримолекулярного переноса фосфатной группы протекает лишь в растениях. В мышцах кролика, например, все происходит сложнее. Фермент содержит фосфатный остаток, который переносится на 2-ОН-группу 3-фосфоглицерата, превращающегося при этом в 2,3-дифосфоглицерат. После этого с 2,3-дифосфоглицерата 3-фосфорильная группа переносится на фермент, чтобы восполнить отданный фосфат, и в результате из 3-фосфоглицерата образуется 2-фосфоглицерат. Следующая стадия гликолиза заключается в отщеплении молекулы воды от 2-фосфоглицерата. Обычно дегидратирующие ферменты так и называют дегидратазами, однако в данном случае используется историческое название енолаза, которое отражает химический смысл реакции — образование замещенного енола.
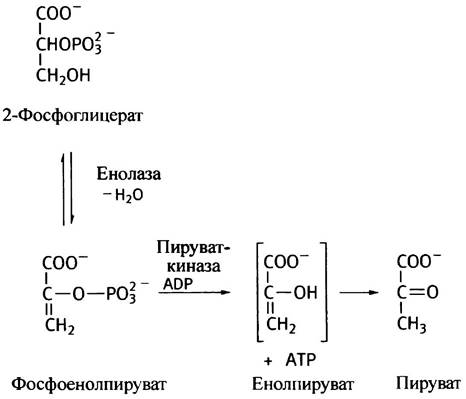
Хотя изменение свободной энергии реакции, катализируемой енолазой, составляет всего ∆G°' = +1,8 кДж • моль-1, но фосфоенолпируват, в отличие от фосфоглицерата, является макроэргическим соединением; его гидролизу соответствует ∆G°' = -62,2 кДж - моль-1. Причина такой разницы величин ∆G°' кроется в том, что продукт реакции - енольная форма пирувата - спонтанно превращается в кетоформу в реакции, которой соответствует большое отрицательное значение ∆G°'. Кето-енольная изомерия хорошо изучена. Кетоформа (в данном случае - пируват) обычно термодинамически выгоднее енольной. Поэтому значительное по величине отрицательное изменение свободной энергии суммарной реакции есть следствие вклада изомеризации. Фосфатная группа с фосфоенолпирувата переносится на ADP ферментом пируваткиназой (опять-таки по номенклатуре киназы называют по обратной реакции фосфорилирования субстрата, даже если сама реакция в таком виде не имеет места). Необратимость превращения фосфоенолпирувата в пируват имеет важное значение для глюконеогенеза. Интересно, что в растениях и микроорганизмах пируват превращается в фосфоенолпируват, но происходит это под действием другого фермента, а главное, при этом расходуется не эквимолярное, а вдвое большее количество АТР.
Полностью метаболические превращения при гликолизе представлены на рис. 8.7.
Рис. 8.7. Гликолитический путь. Красной стрелкой помечены необратимые реакции

Баланс АТР при гликолизе
Если гликолиз начинается с глюкозы, то на образование глюкозо-1-фосфата и фруктозо-1,6-дифосфата расходуются 2 молекулы АТР. Однако в результате фосфоглицераткиназной и пируваткиназной реакций образуются 2 молекулы АТР (см. рис. 8.7). А если учесть, что 1 молекула фруктозо-1,6-дифосфата расщепляется на 2 молекулы глицеральдегид-3-фосфата, то их последующее превращение в пируват сопровождается образованием 4 молекул АТР. Следовательно, суммарный выход макроэргических соединений в результате гликолитического расщепления 1 молекулы глюкозы равен 2 молекулам АТР. Если же гликолиз начинается с гликогена, то на образование фоуктозо-1,6-дифосфата расходуется всего 1 молекула АТР, а синтезируются те же 4 молекулы, и, следовательно, в этом случае образуется 3 молекулы АТР.
Реокисление цитоплазматического NADH челночными системами переноса электронов
В аэробных условиях NADH, образующийся при гликолизе, подвергается реокислению путем переноса электронов внутрь митохондрий. Сам NADH не может проникнуть внутрь митохондрий. Для переноса электронов предусмотрены две системы.
Первая из них использует дигидроксиацетонфосфат (ДГАФ), образующийся при расщеплении фруктозо-1,6-дифосфата альдолазой. В цитоплазме электроны от NADHпередаются на ДГАФ с образованием глицерин-3-фосфата. Это происходит при участии фермента глицерин-3-фосфатдегидрогеназы (здесь фермент также назван по обратной реакции). Схема глицерофосфатной челночной системы представлена на рис. 8.8.
Рис. 8.8. Схема глицерофосфатной челночной системы, передающей электроны от цитоплазматического NАDН на митохондриальную дыхательную цепь
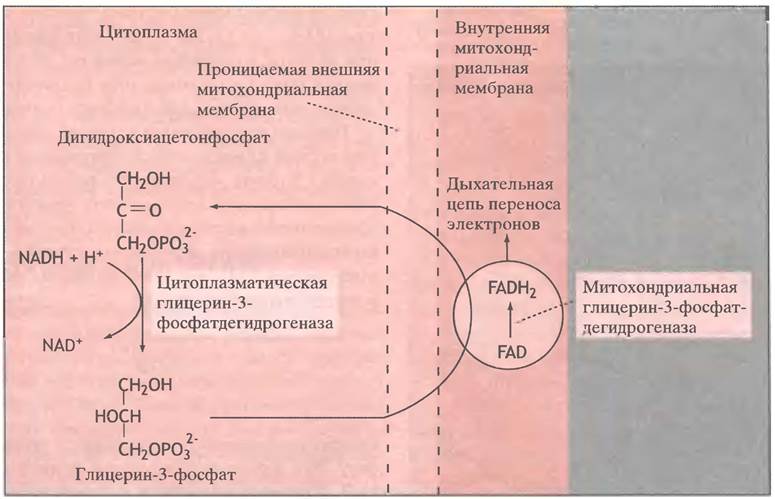
Глицерин-3-фосфат достигает внутренней мембраны митохондрий (вспомним, что внешняя мембрана для большинства низкомолекулярных веществ не является преградой), где глицерин-3-фосфатдегидрогена- за, встроенная в мембрану (простетической группой фермента служит FAD), передает электроны с глицерин-3-фосфата в митохондриальную электронтранспортную цепь. Образующийся при этом ДГАФ возвращается в цитоплазму, замыкая таким образом челночный цикл. Необходимо отметить, что переносчик электронов глицерин-3-фосфат не проникает в матрикс митохондрий. Его задача - перенести электроны с цитоплазматического NADH на митохондриальную электронтранспортную цепь.
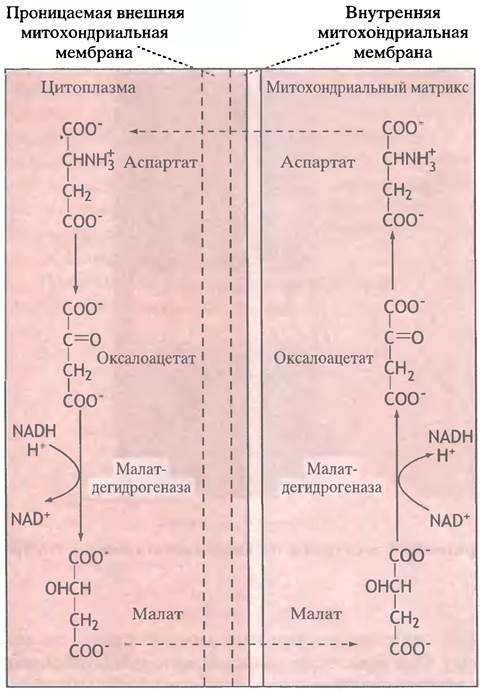
Другая челночная система - малат-аспартатная - переносит электроны от цитоплазматического NADH к митохондриальному NAD+. Это приводит к образованию митохондриального NADH, который далее окисляется в электронтранспортной цепи. В цитоплазме NADH восстанавливает оксалоацетат до малата. Последний с помощью специального переносчика попадает в митохондрии, где реокисляется в оксалоацетат с восстановлением NAD+. Сам оксалоацетат выйти из митохондрий не может, поэтому он сначала превращается в аспартат, который и транспортируется переносчиком в цитоплазму. В цитоплазме аспартат дезаминируется, превращаясь в оксалоацетат и замыкая тем самым челночный цикл (рис. 8.9). Результатом этого цикла является окисление цитоплазматического NADH митохондриальным NAD+.
В различных тканях глицерофосфатный и малат-аспартатный челночные механизмы, по-видимому, работают с разной интенсивностью. Они существенно отличаются. Первый с помощью цитоплазматического NADH обеспечивает восстановление митохондриального FAD, являющегося простетической группой флавопротеина - глицерин-3-фосфатдегидрогеназы. Редокс-потенциал у FADH2 выше, чем у NADH. FADH2 передает электроны далее по цепи переноса. Чем дальше в этой цепи кислород расположен от переносчика, тем больше АТР будет синтезировано при движении электронов к кислороду. При окислении молекулы цитоплазматического NADH и реокислении митохондриального FADH2 образуется 1,5 молекулы АТР. Начинаясь с молекулы цитоплазматического NADH, малат-аспартатный челночный цикл завершается восстановлением молекулы митохондриального NAD+, при реокислении которой образуется 2,5 молекулы АТР.
Рис. 8.9. Малат-аспартатная челночная система для переноса электронов от цитоплазматического NADH к митохондриальному NAD+. Механизм взаимопревращения оксалоацетата и аспартата, в отличие от глицерофосфатного, обратим и поставляет NADH в митохондрии лишь при условии, что отношение NADH/NAD+ в цитоплазме выше, чем в митохондриальном матриксе
Транспорт пирувата в митохондрии
Наряду с NADH продуктом гликолиза является пируват. Если он не восстанавливается до лактата, то попадает внутрь митохондрий благодаря транспортной системе, обеспечивающей его антипорт с ионами ОН-.
Стадия 2. Цикл лимонной кислоты
Продукт гликолиза пируват вступает в метаболические превращения, относящиеся к циклу лимонной кислоты, не сам по себе, а будучи предварительно переработанным в ацетил-СоА. Поэтому мы и начнем этот раздел с рассмотрения механизмов образования ацетил-СоА из пирувата.
Превращение пирувата в ацетил-СоА - предварительный этап цикла лимонной кислоты
В матриксе митохондрий пируват превращается в ацетил-СоА, после чего ацетильная группа пирувата включается в цикл лимонной кислоты. Суммарно реакцию, катализируемую пируватдегидрогеназой, можно описать следующим уравнением:
Пируват + NAD+ + СоА-SH —> Ацетил-S-СоА + NADH + Н+ + СО2.
Реакция превращения пирувата в ацетил-СоА необратима (∆G°′ = -33,5 кДж • моль1). Это означает, что жирные кислоты в организме животных не могут превращаться прямо в глюкозу, хотя бактерии и растения делают это с помощью специального механизма.
Пируватдегидрогеназа устроена довольно сложно. Она состоит из множества полипептидных цепей и объединяет в одной молекуле три различные ферментативные активности, каждая из них ответственна за протекание одной из стадий реакции. Первая стадия - декарбоксилирование, в результате которого от пирувата отщепляется СО2, а остаток молекулы превращается в гидроксиэтильную группу
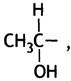
которая присоединяется к кофактору тиаминпирофосфату. Этот кофактор образуется в организме из витамина В1 (тиамина), недостаток которого приводит к нарушениям метаболизма углеводов.
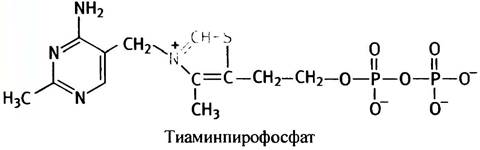
Гидроксиэтильная группа пирувата в несколько стадий преобразуется в ацетильный остаток ацетил-СоА, причем такое превращение сопровождается восстановлением NAD+. По понятным причинам этот процесс называется окислительным декарбоксилированием. В окислительно-восстановительных реакциях здесь участвует еще один важный кофактор - липоевая кислота, которая может существовать в двух формах: ациклической (восстановленной) и циклической (окисленной).
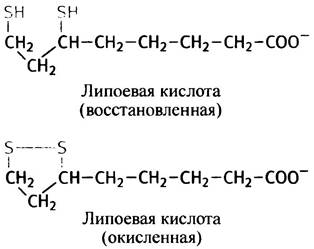
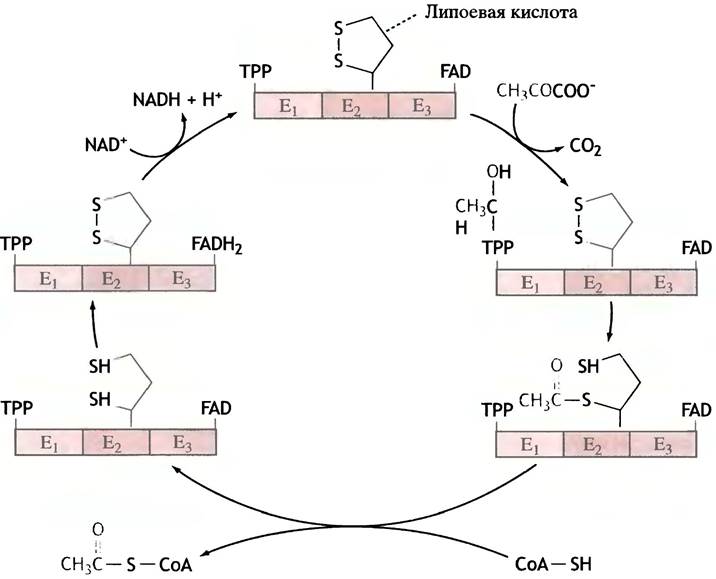
Остаток липоевой кислоты входит в состав фермента в качестве простетической группы: он прикреплен к боковой цепи одного из лизиновых остатков посредством амидной связи -CO-NH-. На рис. 8.10, который иллюстрирует участие липоевой кислоты в синтезе ацетил-СоА, липоиллизиновые остатки изображены в виде дисульфидного фрагмента, а символами Е1, Е2 и Е3 обозначены три фермента, входящих в состав единого ферментного комплекса.
Рис. 8.10. Механизм пируватдегидрогеназной реакции. ТРР - тиаминпирофосфат; Е1, Е2, Е3 - ферменты в составе комплекса
В чем истинная магия цикла?
Цикл лимонной кислоты, на первый взгляд представляющий серию обычных химических реакций, является примером удивительной изобретательности природы, придумавшей, как получить универсальное топливо в форме восстановительных эквивалентов NADH и FADH2, часть которых образуется при расщеплении воды. Это топливо далее используется митохондриальной цепью переносчиков электронов для генерации АТР из ADP и Pi. Расщепление воды не является здесь стартовым процессом накопления энергии, как при фотосинтезе (см. главу 14), а кислород высвобождается не в свободном виде, а в составе СO2. Для управления процессом используется энергия превращения ацетильной группы ацетил-СоА. Необходимо последовательно разобраться в деталях цикла, чтобы понять его суть и значение.
Ацетил-СоА вступает в цикл, взаимодействуя с оксалоацетатом, в результате чего образуется цитрат (анион лимонной кислоты). В ходе этой реакции поглощается молекула воды. Когда цикл замыкается, вновь образуется оксалоацетат, а ацетильная группа ацетил-СоА исчезает. В результате одного оборота цикла (рис. 8.11) образуются 2 молекулы СO2; 3 молекулы NAD+ восстанавливаются до NADH; 1 молекула FAD восстанавливается до FADH2; синтезируется 1 молекула GTP из GDP и Pi; ацетил-СоА теряет ацетильную группу и превращается в CoA-SH.
Рис. 8.11. Включение в цикл и вывод веществ из цикла лимонной кислоты. Отдельные реакции цикла не показаны
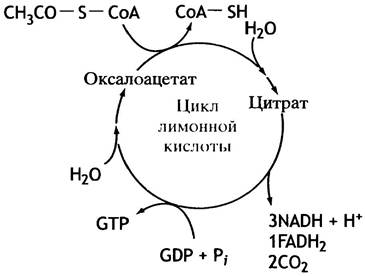
Если сложить все образующиеся восстановительные эквиваленты в трех NADH и одном FADH2, то всего их будет восемь, поскольку в обоих случаях восстановление является двухэлектронным. К этому числу надо прибавить единицу, поскольку еще один эквивалент выделяется в виде образовавшейся тиольной группы в СоА-SH. Итак, на один оборот цикла выделяется 9 восстановительных эквивалентов, что равносильно 9 атомам водорода.
Три атома водорода и один атом кислорода поставляются ацетильной группой CH3CO-S-CoA. Остается понять, откуда берутся остальные шесть атомов водорода и три атома кислорода. Кислород не участвует в цикле, поэтому нужно выявить источник трех атомов кислорода, необходимых для образования двух молекул СO2 (четвёртый - из ацетильной группы). Их, как, впрочем, и атомы водорода, могут поставлять молекулы воды. Одна из них используется при синтезе цитрата, другая - при образовании оксалоацетата. Остается объяснить происхождение еще двух атомов водорода и одного атома кислорода, однако это удобнее будет сделать несколько позже (см. с. 120).
Получается удивительный результат. Внешне все выглядит так, будто электроны воды сами собой поднимаются по энергетической шкале, достигая уровня восстановительных эквивалентов NADH и FADH2 (это же справедливо для электронов ацетильной группы ацетил-СоА). Однако речь идет не о прямом переносе атомов водорода воды на NADH и FADH2, а лишь о химическом балансе, в соответствии с которым водород из воды восстанавливает NAD+ и FAD, а кислород воды расходуется на образование СO2. Разумеется, это эндоэргонические процессы, которые требуют затрат свободной энергии. Источником этой энергии является превращение ацетильной группы пирувата в ацетил-СоА и последующие продукты.
Упрощенное описание цикла лимонной кислоты
Изучая одну за другой множество химических реакций, составляющих цикл, можно потерять представление о его «архитектуре» в целом. Поэтому имеет смысл сначала рассмотреть упрощенную версию цикла.
Оксалоацетат - вещество, с которого все начинается и которым все завершается. Ацетат - это СН3СОO-, оксалильная группа (ацильный остаток щавелевой кислоты) - это -ООС-СО-, а оксалоацетат имеет структуру:
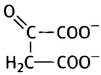
Ацетильная группа ацетил-СоА присоединяется к оксалоацетату, который при этом превращается в цитрат. Глядя на формулу последнего, можно понять, где идет присоединение:
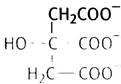
Цитрат - анион оптически симметричной трикарбоновой С6-кислоты - изомеризуется в анион другой трикарбоновой кислоты - изоцитрат, в молекуле которого есть один центр асимметрии. Изоцитрат далее последовательно превращается в α-кетоглутарат (С5), сукцинат (С4), фумарат (С4), малат (С4) и, наконец, в исходный оксалоацетат (рис. 8.12).
Рис. 8.12. Реакции цикла лимонной кислоты. Рисунок знакомит со структурой кислот, участвующих в цикле, и их взаимосвязью
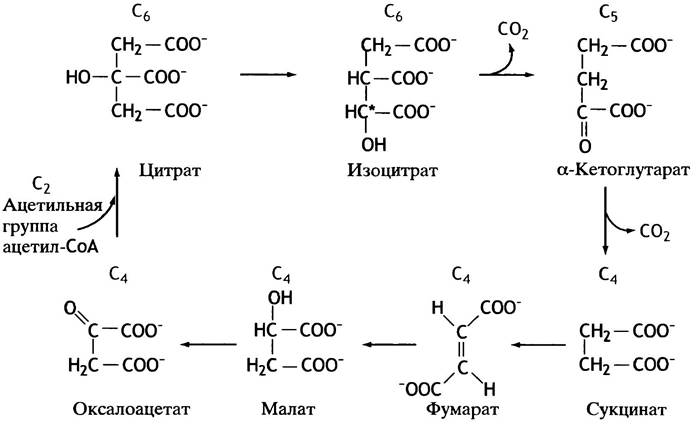
Цикл завершился, а ацетильный остаток исчез. Теперь перейдем к более подробному рассмотрению химических превращений всех веществ, участвующих в цикле.
Механизмы реакций цикла лимонной кислоты
Для удобства эти реакции можно разбить на три группы: 1) синтез цитрата - реакция, благодаря которой в цикл вводится ацетильная группа; 2) превращение цитрата (С6) в α-кетоглутарат (С5); 3) превращения С4-соединений - сукцината в оксалоацетат.
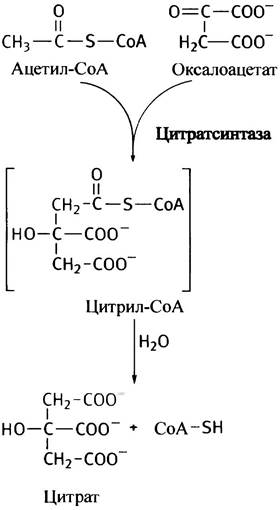
Синтез цитрата
Фермент, ответственный за синтез цитрата, называют цитратсинтазой (заметим, не синтетазой, поскольку в реакции не участвует АТР). Он катализирует реакцию конденсации ацетил-СоА с оксалоацетатом, приводящую к образованию цитрил-СоА, который неустойчив и быстро гидролизуется до цитрата и свободного СоА. Суммарная реакция необратима, поскольку ∆G°′ = -32 кДж • моль-1.
Превращение цитрата в α-кетоглутарат
Суть реакции Цитрат —> Изоцитрат состоит в перемещении гидроксильной группы симметричной молекулы цитрата из положения 3 в положение 2 с образованием
асимметричной молекулы изоцитрата. Механизм реакции заключается в одновременной обратимой дегидратации цитрата и изоцитрата в общий для них продукт - цис-аконитат (аконитовую кислоту впервые нашли в растениях рода Aconitum).
Обе реакции катализирует фермент аконитаза. Это название - дань традиции, поскольку ферменты этого класса принято называть дегидратазами.
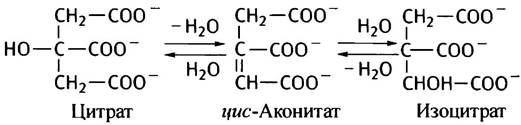
В клетке изоцитрат легко превращается в α-кетоглутарат, поэтому равновесие реакции сдвинуто в сторону образования изоцитрата:
Цитрат —> цис-Аконитат —> Изоцитрат.
На примере лактатдегидрогеназы мы уже познакомились с NАD+-зависимыми дегидрогеназами. Реакция окисления изоцитрата и лактата принадлежит к одному типу реакций:
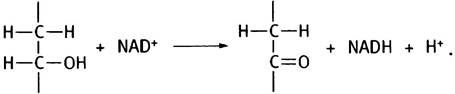
В цикле изоцитратдегидрогеназа катализирует реакцию образования α-кетоглутарата:
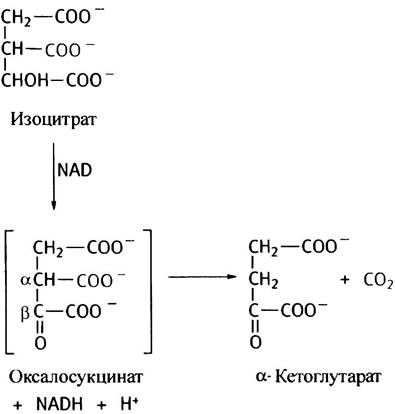
Промежуточным продуктом окисления изоцитрата является оксалосукцинат, который, как и все β-кетокислоты (кетогруппа здесь в β-положении по отношению к центральному карбоксилу), нестабилен и легко теряет карбоксильную группу в виде СO2. Декарбоксилирование происходит на поверхности изоцитратдегидрогеназы с образованием α-кетоглутарата (С5).
Четырехуглеродные кислоты
α-Кетоглутарат является аналогом пирувата, и оба эти соединения имеют общую формулу:
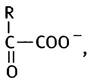
в которой пирувату соответствует R= -СН3, а α-кетоглутарату - R= -СН2СН2СОО-. Ранее мы встречались с превращением пирувата в ацетил-СоА и СO2, которое катализирует пируватдегидрогеназа:
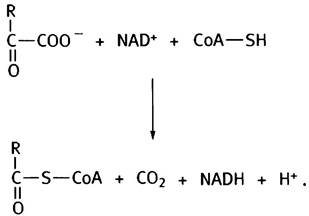
Подобно пируватдегидрогеназному комплексу, α-кетоглутаратдегидрогеназа (также ферментный комплекс) катализирует образование сукцинил-СоА из α-кетоглутарата:
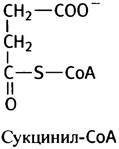
Однако, если ацетил-СоА в цикле используется для синтеза цитрата, то сукцинил-СоА гидролизуется до сукцината и свободного СоА-SН. Изменение свободной энергии гидролиза этого тиоэфира составляет ∆G°′ = -35,5 кДж • моль-1. Этого достаточно для синтеза макроэргического фосфата, что и происходит на следующем этапе.
Сопряжение гидролиза сукцинил-СоА с синтезом GTP
Суммарное уравнение для сопряженных реакций выглядит так:
Сукцинил-СоА + GDP + Рi <-> Сукцинат + GTP + СоА-SH
∆G°' = -2,9 кДж • моль-1.
Фермент, катализирующий эту реакцию, называется сукцинил-СоА-синтетаза (и здесь по номенклатурным соображениям фермент назван по обратной реакции, которая в клетке не протекает). У растений, в отличие от животных, аналогичный фермент синтезирует не GTP, а АТР.
Сукцинил-СоА-синтетазная реакция начинается с фосфоролиза тиоэфирной группы в сукцинил-СоА:
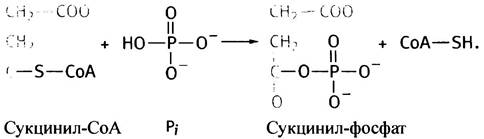
Ранее (см. с. 118) мы подводили баланс атомов водорода и кислорода в цикле, и для сведения этого баланса не хватило двух атомов водорода и одного - кислорода. Теперь можно указать причину этого дисбаланса: участие неорганического фосфата в расщеплении сукцинил- СоА. Для ясности представим истинную реакцию в виде эквивалентной комбинации двух реакций:
GDР + Рi —> GТР + Н2O,
Сукцинил-СоА + Н2O —> Сукцинат + СоА-SН.
Подчеркнем, что такая комбинация двух реакций не отражает истинного механизма процесса, но зато позволяет разобраться, откуда берется недостающая молекула воды.
Превращение сукцината в оксалоацетат
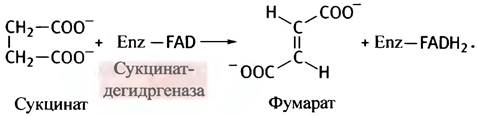
На первом этапе этого превращения FАD-содежащий фермент сукцинатдегидрогеназа окисляет сукцинат до фумарата. Это окисление сопровождается отщеплением двух атомов водорода:
Почему для окисления сукцината здесь используется FAD, а не NAD+? Дело в величине редокс-потенциала пары сукцинат-фумарат. По термодинамическим причинам электроны перетекают от пары с меньшим редокс-потенциалом к паре с большим редокс-потенциалом. Сукцинат оказывается слишком слабым восстановительным агентом для NAD+, однако он может восстановить FAD. Эта реакция описывается уравнением:
Последний этап, который замыкает цикл, состоит в превращении фумарата в оксалоацетат. Сначала из фумарата в результате присоединения молекулы воды образуется малат (малат - анион яблочной кислоты). Фермент, осуществляющий эту реакцию, логично было бы назвать фумаратгидратазой, однако за ним закрепилось традиционное название - фумараза.
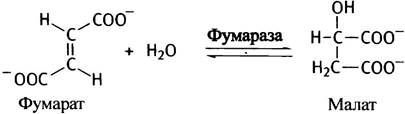
Малат далее окисляется в оксалоацетат с помощью NAD+-зависимoro фермента малатдегидрогеназы:

Это эндоэршничная реакция (∆G°′ = +29,7 кДж • моль-1), и сама по себе она бы не протекала. Однако образование оксалоацетата замыкает цикл, и дальше следует первая из рассмотренных нами реакций - превращение оксалоацетата в цитрат. Это очень экзоэргоничный процесс, вследствие чего концентрация оксалоацетата мала. Равновесие реакции Малат <-> Оксалоацетат смещается в сторону образования оксалоацетата. Иными словами, реальная величина ∆G гораздо меньше, чем стандартная ∆G°′, благодаря чему малат окисляется.
Полностью цикл лимонной кислоты представлен на рис. 8.13.
Рис. 8.13. Полный цикл лимонной кислоты. Цветом помечено образование восстановительных эквивалентов. FАD - простетическая группа сукцинатдегидрогеназы
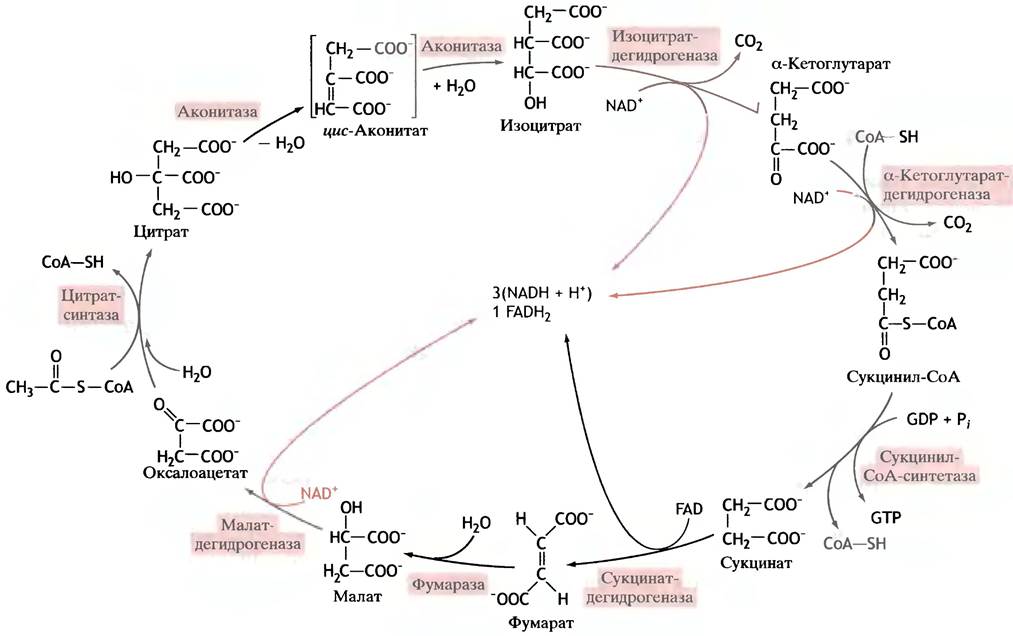
Что определяет общее направление реакций в цикле?
Из рис. 8.13 следует, что все реакции в цикле протекают согласованно в одном направлении. Это обусловлено тем, что трем из всех реакций отвечают столь большие по абсолютной величине отрицательные значения ∆G°′, что они являются практически необратимыми. Одна из таких реакций - это синтез цитрата из ацетил-СоА и оксалоацетата (∆G°' = -32,2 кДж • моль-1), другая - декарбоксилирование изоцитрата в α-кетоглутарат (∆G°'= -20,9 кДж • моль-1), третья -образованиесукцинил-СоА из α-кетоглутарата (∆G°' = -33,5 кДж • моль-1).
Это приводит к тому, что цикл работает в одном направлении, несмотря даже на то, что равновесие малат- дегидрогеназной реакции сдвинуто в противоположную сторону (∆G°'= +29,7 кДж • моль-1). Суммарная величина изменений свободной энергии всех реакций цикла отрицательна, что и обеспечивает его протекание в одном направлении.
Стехиометрия цикла
Суммарное уравнение, подводящее итоги работы цикла, имеет следующий вид:
СН3СО-S-СоА + 2Н2О + 3NAD+ + FAD + GDP + Pi—> 2CO2 + 3NADH + 3H+ + FADH2 + CoA-SH + GTP
∆G°' = -40 кДж • моль-1.
Если попытаться подвести в этом уравнении баланс атомов водорода и кислорода, обнаружится нехватка одного моля Н2O.
Субстратное обеспечение цикла лимонной кислоты
Цикл начинается с реакции конденсации оксалоацетата и ацетил-СоА и заканчивается образованием оксалоацетата. Цикл существует не изолированно от других
процессов метаболизма, и некоторые из участвующих в нем кислот используются для других целей. Однако они не поступают в организм с пищей в достаточных количествах. Метаболизм пищевых углеводов сопровождается образованием большого количества С3-соединений в форме пирувата, превращением липидов - появлением С2-соединений в виде ацетильных групп. Характерные для цикла С4-, С5- и С6-кислоты могут образовываться из аминокислот, но они и расходуются для синтеза некоторых из них (см. главу 15), да и других метаболитов, в силу чего их содержание в клетке ограничено. В действительности между разными метаболическими системами устанавливаются сложные стационарные состояния. Главной задачей цикла является бесперебойное обеспечение «топливом» процесса генерации энергии в митохондриях, поэтому особое значение имеет так называемая анаплеротическая реакция, заключающаяся в синтезе оксалоацетата из пирувата и СO2:
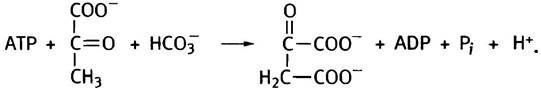
Реакцию катализирует фермент пируваткарбоксилаза (не надо путать с пируватдекарбоксилазой дрожжей!). Особенность анаплеротической реакции заключается в том, что она является уникальным процессом превращения С3-кислоты в С4-кислоту. Рабочим элементом пируваткарбоксилазы служит биотин. Он является кофактором синтетических реакций карбоксилирования, в которых используется так называемый активный СO2. Биотин представляет собой водорастворимый витамин группы В. Будучи ковалентно связанным с ферментом, он реагирует с бикарбонатом, образуя карбоксибиотин. Эта реакция энергетически сопряжена с гидролизом АТР. Карбоксибиотин является реакционноспособным, но достаточно устойчивым соединением; он может карбоксилировать другие вещества, перенося на них карбоксильный остаток. Движущей силой таких реакций служит значительная отрицательная величина изменения свободной энергии при отщеплении СO2 от карбоксибиотина (∆G°' = -19,7 кДж • моль-1). В данном случае субстратом фермента служит пируват, но и другие карбоксилазные ферментные системы используют биотин в качестве кофактора.
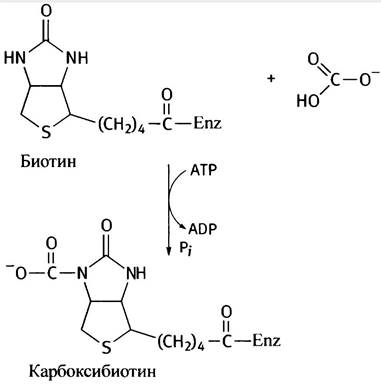
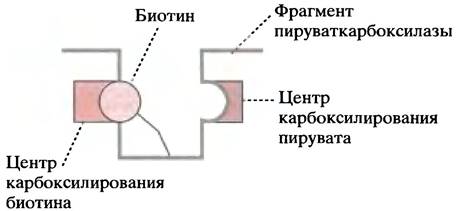
Пируваткарбоксилаза содержит два каталитических центра: один для карбоксилирования биотина, а другой - для переноса карбоксильной группы с биотина на пируват (у некоторых бактерий эти функции выполняют два разных фермента). Биотин образует амидную связь с одним из белковых остатков лизина. Таким образом, он оказывается связанным с белком как бы длинной гибкой «ножкой». Полагают, что изгиб этой ножки позволяет биотину перемещаться из одного каталитического центра фермента в другой (рис. 8.14).
Рис. 8.14. Биотин в активном центре пируваткарбоксилазы. Рабочий элемент биотина прикреплен к белку с помощью длинной «ножки». Она позволяет биотину перемещаться от одного активного центра к другому
Стадия 3. Цепь переноса электронов от NАDН и FАDН2 на кислород
Окисление глюкозы (или гликогена) включает три основных этапа. Первым, является гликолиз, вторым - цикл лимонной кислоты. Теперь мы подошли к рассмотрению конечного этапа. С точки зрения генерации энергии, на первых двух этапах результат весьма скромен: всего 2 молекулы АТР на 1 молекулу глюкозы образуется в процессе гликолиза и столько же - в цикле лимонной кислоты (с учетом энергетической эквивалентности GTP и АТР); еще одна молекула АТР образуется, если источником глюкозы служит гликоген. Весьма важно, что большая часть энергии после первых двух этапов запасается в виде 10 молекул NADH (две из гликолиза, две из пируватдегидрогеназной реакции и шесть из цикла лимонной кислоты) и 2 молекул FADH2 (из цикла лимонной кислоты). Следует помнить, что из глюкозы образуется 2 молекулы пирувата, которые обеспечивают 2 оборота цикла.
Итак, основное количество АТР, синтезируемого из ADP и Рi в ходе окисления глюкозы, образуется в результате окисления NADH и FADH2.
Цепь переноса электронов
Переносчики электронов размешены на поверхности или в глубине внутренней митохондриальной мембраны. Она уложена в кристы (см. рис. 7.4), число и плотность упаковки которых коррелирует с энергетическими потребностями клетки.
Что представляют собой переносчики электронов?
Многие переносчики электронов - это белки, содержащие в качестве простетической группы гем. Переносчики электронов называют цитохромами, так как они окрашены в красный цвет. Разные цитохромы обозначаются буквенными индексами: с1, с, а и a3-в порядке их расположения в цепи (роль двух цитохромов b обсудим позже). Главная часть структуры гема показана на рис. 8.15, а полностью она изображена на рис. 27.3.
Рис. 8.15. Схематическое изображение структуры гема
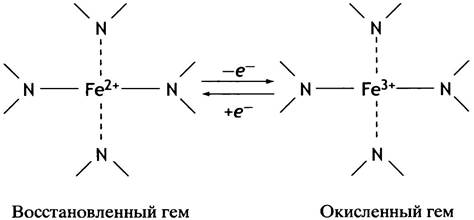
Основное, что нужно знать о геме как о простетической группе цитохромов-переносчиков, это изменение валентности его атома железа при их функционировании: Fe2+при получении электрона от предыдущего переносчика цепи и Fе3+ - после передачи электрона последующему. Свойства самой молекулы гема зависят от белка, к которому он присоединен. Кроме того, гемы в разных цитохромах могут отличаться строением боковых групп и способом прикрепления к апобелку. Поэтому нет никакого противоречия в том, что цитохромы отличаются редокс-потенциалами, хотя у них всех простетические группы почти одинаковы.
К другому типу негемовых железосодержащих переносчиков электронов относятся белки, в которых атомы железа связаны с сульфгидрильными группами остатков цистеина белка, а также с сульфидными анионами, образуя железосерные комплексы, или центры. Простейший из них показан на рис. 8.16.
Рис. 8.16. Строение простейшего железосерного центра. В более сложных центрах больше атомов железа и серы
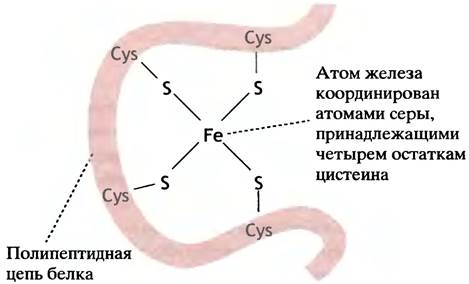
Как и в цитохромах, атомы железа в таких центрах могут принимать и отдавать электроны, поочередно переходя в ферро(Fе2+)- и ферри(Fе3+)-состояния. Железосерные центры функционируют совместно с флавинсодержащими ферментами, принимая электроны от сукцинатдегидрогеназы и дегидрогеназ, участвующих в окислении жиров (см. главу 9). Еще одним типом переносчиков является FМN-содержащий белок. FМN (флавинаденин-мононуклеотид) - соединение, которое представляет собой флавиновую половину молекулы FAD (см. с. 101). FMN переносит электроны от NADH на железо-серные центры.
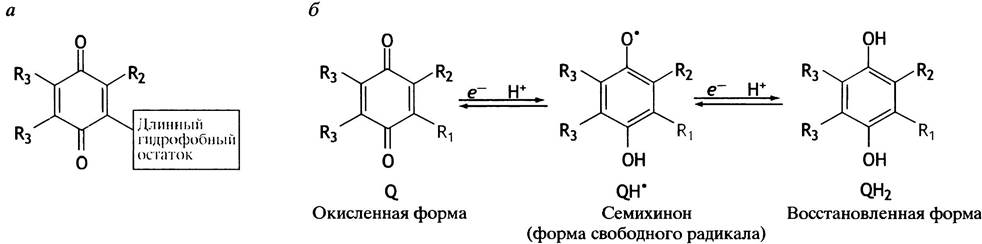
Единственный небелковый переносчик электронов - убихинон (рис. 8.17), названный так потому, что, с одной стороны, он - хинон, а с другой - встречается повсеместно (англ. ubiquitous - вездесущий). Сокращенно его обозначают CoQ, UQ или просто Q. Все железосерные центры отдают электроны убихинону.
Убихинон при восстановлении приобретает не только электроны, но и протоны. При одноэлектронном восстановлении он превращается в семихинон (органический свободный радикал), а при двухэлектронном - в гидрохинон. Именно промежуточное образование свободного радикала позволяет убихинону служить переносчиком не двух, а одного электрона. Очень длинный гидрофобный «хвост» (40 углеродных атомов в десяти последовательно соединенных изопреноидных остатках) придает убихинону способность легко внедряться и свободно перемещаться в неполярном слое внутренней митохондриальной мембраны.
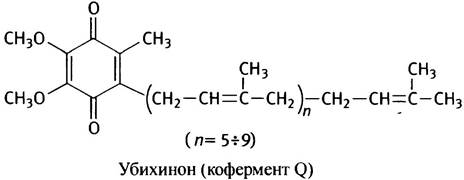
Итак, митохондриальная элекгронтранспортная цепь содержит:
✵ FМN-белок;
✵ белки, имеющие негемовые железосерные центры;
✵ убихинон, не связанный с белком и свободно перемещающийся в мембране;
✵ цитохромы - белки, содержащие гем.
Рис. 8.17. Убихинон - кофермент Q (а) и его окислительно-восстановительные превращения (б). R1 - длинный гидрофобный остаток; R2 = СН3; R3 = ОСН3. Семихинон может находиться в форме аниона (Q-.)
Важный момент заключается в том, что один из цитохромов - цитохром с (небольшой водорастворимый белок с молекулярной массой ~12,5 кДа, содержащий чуть больше 100 аминокислотных остатков), непрочно связан с внешней поверхностью внутренней митохондриальной мембраны и легко покидает ее. Все другие белковые переносчики - интегральные белки, занимающие в мембране строго фиксированное положение и ориентированные определенным образом.
Расположение переносчиков электронов
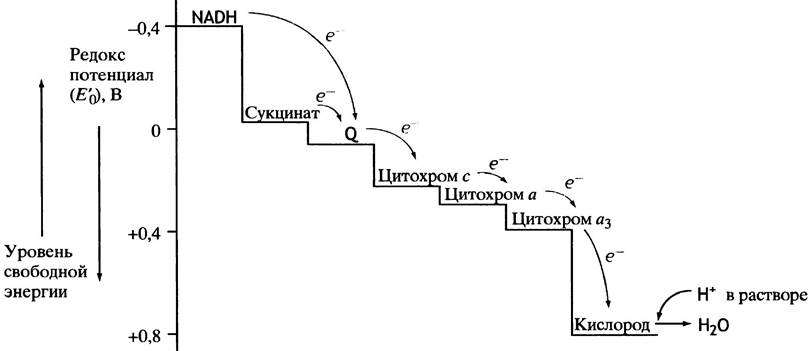
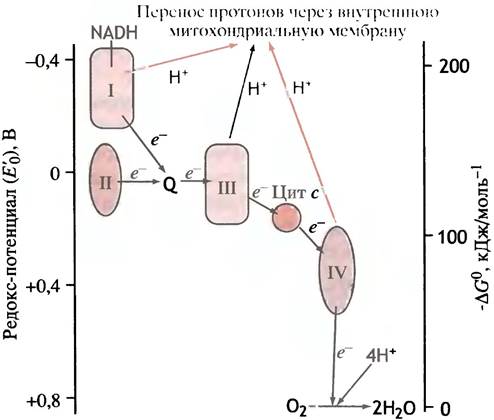
В главе 7 говорилось о редокс-потенциалах акцепторов электронов, в частности о том, что поток электронов между переносчиками направлен от переносчика с более высоким восстановительным потенциалом (т. е. меньшим редокс-потенциалом) к переносчику с более низким восстановительным потенциалом (т. е. более окисленному, с большим редокс-потенциалом). В митохондриальной цепи переносчики обладают разными редокс-потенциалами.
Значения редокс-потенциалов непосредственно связаны с изменениями свободной энергии (∆G°′). Переносчики электронов расположены в цепи так, что ∆G°′ постепенно уменьшается, а редокс-потенциал соответственно возрастает. Таким образом, на каждом этапе передачи электрона соседнему по цепи переносчику высвобождается свободная энергия (рис. 8.18).
Рис. 8.18. Редокс-потенциалы некоторых главных компонентов цепи переноса электронов в митохондриях (дыхательной цепи). Стрелки указывают направление переноса электронов
Применительно к окислению глюкозы, задача, стоящая перед электронтранспортной цепью, заключается в переносе электронов от NАDН и FАDН2 на кислород. В этом процессе участвует очень много переносчиков, однако их можно сгруппировать в четыре комплекса, которые встроены во внутреннюю митохондриальную мембрану (рис. 8.19). Между комплексами электроны перемещаются вместе с подвижными переносчиками: убихиноном и цитохромом с. Убихинон получает электроны от комплексов I и II и передает их комплексу III. Цитохром с служит посредником между комплексами III и IV. Комплекс I переносит электроны от NADH на Q; комплекс II - от сукцината через FADH2 на Q; комплекс III использует QH2 для восстановления цитохрома с, а комплекс IV передает электроны с цитохрома с на кислород. Комплексы I, III и IV называют соответственно NADH-CoQ-редуктазой, СоQН2-цитохром с-редуктазой и цитохромоксидазой.
Рис. 8.19. Четыре комплекса электронных переносчиков в митохондриальной дыхательной цепи. Комплекс I - NADH-CoQ-редуктаза; комплекс II - сукцинат- CoQ-редуктаза; комплекс III - CoQH2-цитохром с-редуктаза; комплекс IV - цитохромоксидаза. Q - убихинон, или кофермент Q. FADH2 образуется в цикле лимонной кислоты из сукцината в сукцинатдегидрогеназной реакции. Все комплексы встроены во внутреннюю митохондриальную мембрану. Кофермент Q и цитохром с - подвижные переносчики электронов. FADH2 входит в состав флавопротеинов - дегидрогеназ, окисляющих сукцинат и жирнокислотные производные СоА
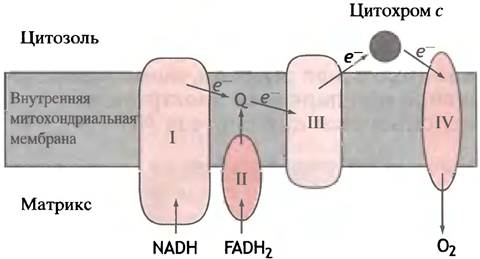
Комплекс IV - цитохромоксидаза - состоит из нескольких белков. Он получает электроны от цитохрома с с внешней стороны внутренней митохондриальной мембраны. На пути к кислороду эти электроны проходят через цитохромы а и a3, содержащие атомы меди, которые поочередно переходят в состояния Сu+ и Сu2+. Цитохромоксидаза осуществляет восстановление свободного кислорода:
O2 + 4е- + 4Н+ —> 2Н2O.
Позже (см. главу 17) мы объясним, почему так важно, чтобы цитохромоксидаза передала кислороду все четыре электрона, необходимые для его восстановления именно в воду, а не в какие-либо частично восстановленные продукты: перекись водорода или реакционноспособные свободные радикалы.
Как свободная энергия, высвобождающаяся при переносе электронов, используется для синтеза АТР?
Механизм синтеза АТР из ADP и Рi, сопряженный с транспортом электронов, принципиально отличается от субстратного фосфорилирования в процессе гликолиза (см. с. 112). В последнем случае синтез АТР неотделим от собственно гликолитических реакций. Реакция не протекает без образования АТР, который является ее неотъемлемым компонентом. Точно так же обстоит дело с синтезом GTP в цикле лимонной кислоты.
При рассмотрении движения электронов по цепи переносчиков мы даже не упоминали о синтезе АТР. Хотя именно ради синтеза АТР функционирует цепь, транспорт электронов происходит и в поврежденных митохондриях, которые вообще не способны синтезировать АТР. Эта ситуация десятилетиями ставила биохимиков в тупик. Если в клетках или интактных митохондриях транспорт электронов приводит к генерации АТР, то почему же в поврежденных митохондриях, где успешно осуществляется передача электронов, АТР не образуется? Ответить на этот вопрос с точки зрения хорошо известного по гликолизу субстратного фосфорилирования не представлялось возможным. Решение этой проблемы нашел английский биохимик Питер Митчелл, который в 1961 г., работая в своей домашней лаборатории, придумал принципиально новую концепцию механизма сопряжения транспорта электронов с синтезом АТР. Эта концепция оказалась столь оригинальной, что поначалу ее никто не принял всерьез, и прошло немало времени, прежде чем она была признана всеми (только в 1978 г. Митчеллу присудили Нобелевскую премию). Идея Митчелла предельно проста: источником энергии для совершения работы служат градиенты. Так, перепад уровня воды приводит в действие турбогенераторы гидростанций, разница атмосферного давления порождает воздушный поток, заставляющий работать ветряные мельницы, и т. д. Химические градиенты не могут быть исключением. Молекулы движутся по концентрационному градиенту (от высокой концентрации к низкой), и, если на их пути разместить подходящее устройство, этот поток можно использовать для выполнения полезной работы.
Исходя из своей концепции, Митчелл пришел к выводу, что для сопряжения транспорта электронов с синтезом АТР необходимо выполнение трех условий. Во-первых, транспорт электронов должен создавать некий градиент; во-вторых, обратный поток против градиента может осуществляться лишь через устройство, использующее энергию градиента для синтеза АТР из ADP и Рi. Третье условие концепции Митчелла заключается в том, что биохимическая машина, работающая на этих принципах, должна представлять собой замкнутый пузырек, целостная мембрана которого позволяет создать градиент. Однако градиент может существовать лишь в том случае, если мембрана пузырька непроницаема для создающего его вещества. Так просто и изящно был получен ответ на вопрос: почему при повреждении митохондриальной мембраны, когда все градиенты исчезают, синтез АТР прекращается - но ничто не препятствует транспорту электронов?
Митчелл обнаружил, что поток электронов вызывает выкачивание протонов из митохондрий в окружающую среду, создавая градиент протонов через мембрану (pH внешнего раствора уменьшается). Поскольку протоны являются положительно заряженными частицами, вследствие их выкачивания из митохондрий на мембране возникает разность электрического потенциала (минус - внутри) и разность pH (выше - внутри). В совокупности электрический и концентрационный градиенты составляют то, что Митчелл назвал протондвижущей силой, которая и является источником энергии для синтеза АТР. Ясно, что нативная мембрана при этом должна быть непроницаема для протонов. С другой стороны, в такой мембране должны существовать специальные каналы: проходя через них из окружающей среды обратно в матрикс, протоны отдают свою энергию на синтез АТР.
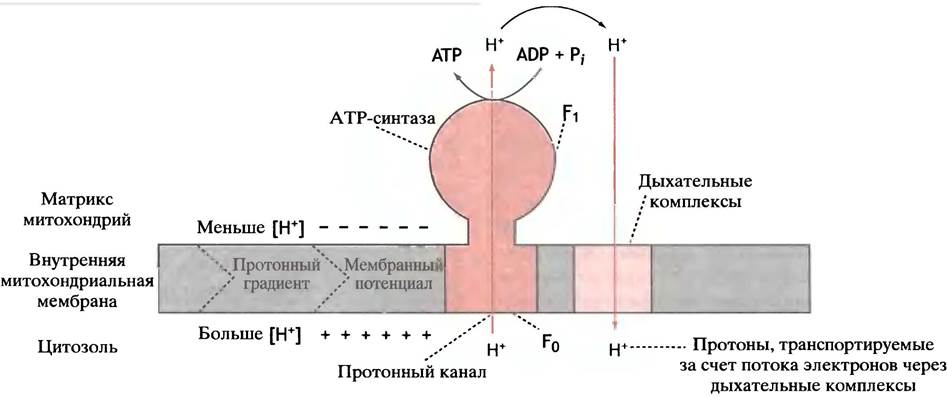
Такими специализированными протонными каналами являются грибовидные выросты, которыми покрыта внутренняя поверхность крист (рис. 8.20). Эти выросты представляют собой ATP-синтазные комплексы, использующие поток протонов для синтеза АТР из ADP и Pi. Такой комплекс представлен двумя связанными между собой компонентами F0 и F1, каждый из которых состоит из нескольких белковых молекул. F0 утоплен в мембране, a F1расположен на ее поверхности. Именно в F1синтезируется АТР, тогда как F0выполняет функцию собственно протонного канала. Под словом канал здесь следует понимать упорядоченную в пространстве последовательность заряженных боковых групп аминокислотных остатков. Протоны, перемещаясь вдоль этой последовательности, «перескакивают» с одной группы на другую.
Рис. 8.20. Система синтеза АТР во внутренней митохондриальной мембране. F1 состоит из девяти субъединиц. F0 также включает несколько субъединиц
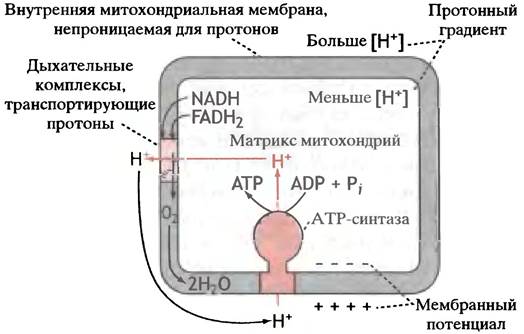
Общая схема, иллюстрирующая хемиосмотический механизм (так называют концепцию Митчелла), представлена на рис. 8.21.
Рис. 8.21. Синтез АТР в митохондриях по хемиосмотическому механизму. FADH2, получаемый при окислении сукцината и жирных кислот, используется одинаково
Возникают два вопроса.
1. Каким образом восстановление кислорода посредством NADH и FADH2вызывает выкачивание протонов из матрикса митохондрий в окружающую среду?
2. Как встречный поток протонов из окружающей среды в матрикс становится движущей силой для синтеза АТР из ADP и Рi?
Как выкачиваются протоны?
Механизм транслокации протонов в результате потока электронов через комплексы I и IV пока не вполне ясен. Иная ситуация складывается с комплексом III. Идея, выдвинутая в свое время Митчеллом для сопряжения потоков протонов и электронов, столь же проста, сколь остроумна. Она состоит в том, что на поверхности мембраны, обращенной к матриксу, атомы водорода формируются из протонов, забираемых из матрикса, и электронов, поставляемых цепью. Эти атомы образуются
на молекуле убихинона Q, который превращается в восстановленную форму QН2. Последняя диффундирует к противоположной стороне мембраны, где события протекают в обратном направлении: электроны отщепляются от атомов водорода, а образующиеся протоны уходят наружу. Иными словами, Q восстанавливается на одной стороне мембраны, движется в виде QН2 к другой, там окисляется до Q и возвращается обратно. Дело в том, что Q участвует в двух редокс-парах, разнесенных по обе стороны мембраны и способных передавать атомы водорода через мембрану с одной поверхности на другую. Как восстановление Q, так и окисление QН2 катализируют специализированные белки. Вся эта система получила название Q-цикла (рис. 8.22).
Рис. 8.22. Сопряжение переноса электронов через дыхательный комплекс III с транспортом протонов через мембрану. Цветом помечены траектории подвижных переносчиков электронов убихинона и его производных; черным - химические превращения; прерывистой черной линией - транспорт электронов
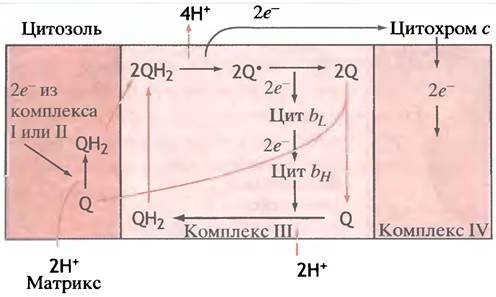
Его схема, на первый взгляд, кажется сложной, но в действительности она очень проста.
Полная схема Q-цикла включает два разных циклических процесса, каждый из которых приводит к выбросу из мембраны 2 протонов. В мембране существует стационарный общий фонд Q и QН2. В левой части рис. 8.22 показано, что восстановление Q до QН2 комплексами I и II сопровождается поглощением 2 протонов из матрикса митохондрий. Образовавшийся QH2 мигрирует к внешней поверхности мембраны, где отдает 1 электрон на восстановление цитохрома с, переносящего его к комплексу IV (цитохром с, подобно убихинону, подвижен, но не в мембране, а в воде и располагается с наружной стороны мембраны, как и участок комплекса IV, акцептирующий электрон). Одновременно с потерей электрона QН2 отдает во внешнюю среду 2 протона и превращается в анион-радикал семихинона Q-.. Последний далее снова отдает 1 электрон, но уже не цитохрому с, а цитохрому b. Этими событиями заканчивается первая половина рассказа о Q-цикле. Молекула QН2, покинувшая комплекс II, была окислена, 2 электрона (по одному) были переданы от нее цитохромам с и b, а 2 атома водорода в виде протонов вышли наружу во внемитохондриальное пространство. Убихинон поступает в общий фонд этого вещества в мембране. Другая половина истории начинается с того, что вторая молекула QН2 подвергается точно такому же окислению, что и первая, отдавая 2 протона в окружающую среду. Таким образом, после окисления 2 молекул QН2 2 электрона передаются комплексу IV через цитохром с, а еще 2 электрона - цитохрому b. Далее электроны с одного гема, входящего в состав цитохрома b, переходят на другой гем, связанный с тем же белком, но обладающий большим редокс-потенциалом (или, что, то же самое, меньшей энергией). Этот перенос эквивалентен переходу электронов на другую, обращенную к матриксу сторону мембраны. Здесь они расходуются на восстановление Q в QH2, при этом атомы водорода в виде протонов извлекаются из матрикса. Далее QH2 возвращается к внешней стороне мембраны, цикл замыкается, и эта «карусель» готова к очередному обороту. (Для простоты и ясности на рис. 8.22 показано, будто каждая из изображенных молекул последовательно обегает цикл, подобно детали, движущейся по автоматической линии станков. В действительности же каждая из окислительно-восстановительных реакций протекает с молекулой, произвольно выбранной из общего фонда.) Если рассматривать только процессы, протекающие в пределах комплекса III, то их можно описать уравнением, согласно которому окисление одного QH2 сопровождается выбросом из мембраны не двух, а четырех протонов:
QH2 + 2Н+(матрикс) + 2 Цит с (Fe3+) —> Q + 4Н+(цитозоль) + 2 Цит с (Fe2+).
Рис. 8.23. Примерное расположение главных переносчиков электронов относительно шкалы редокс-потенциала. Справа - шкала, позволяющая оценить, сколько энергии высвобождается при переносе пары электронов от данного переносчика на кислород. Q - убихинон
Анализ Q-цикла наглядно демонстрирует, что на работу, совершаемую при выкачивании протонов, расходуется свободная энергия, которая освобождается при переносе электронов по градиенту редокс-потенциала.
Как поток протонов может привести к синтезу АТР?
Грибовидные выросты F1 в пробирке обладают АТРазной активностью (гидролизуют АТР до АДР и Рi), но в митохондриях они осуществляют обратную реакцию - синтезируют АТР.
Вопрос заключается в том, как поток протонов делает возможной реакцию ADP + Рi —> АТР + Н2O? Наиболее примечательная особенность синтеза АТР митоходриальной синтазой F1 состоит в том, что не удалось обнаружить никаких признаков промежуточных продуктов, в которых ADP или фосфат были бы ковалентно связаны с белком. Создается впечатление, что происходит прямая конденсация этих двух молекул. По- видимому, когда ADP и Рi. связаны с каталитическим центром, для образования АТР (тоже связанного с каталитическим центром) достаточно небольшого изменения свободной энергии; а вот для высвобождения АТР из каталитического центра необходимы существенные затраты энергии. Полагают, что свободная энергия, высвобождаемая при переносе электронов по дыхательной цепи, вызывает конформационные изменения в молекуле белка. Конформационные переходы, вероятно, требуют затрат энергии того же порядка, что и синтез АТР в растворе.
До сих пор мы встречались с транспортом веществ через мембрану, движущей силой которого является гидролиз АТР. ATP-синтазу можно рассматривать как протонный насос, движимый АТР, но работающий в обратном направлении.
Есть нечто магическое в концепции Митчелла. Миллионы лет все аэробные формы жизни на Земле существуют благодаря созданию градиента pH и заряда через липидный бислой мембраны. Воистину, это одна из самых великих и замечательных концепций в биологии!
Транспорт ADP в митохондрии и АТР из митохондрий
В большинстве эукариотических клеток синтез основного количества АТР происходит внутри митохондрий, но основные потребители АТР расположены вне ее. Следовательно, должны существовать механизмы, обеспечивающие поступление ADP и фосфата в матрикс митохондрий и выведение АТР из него наружу. Эти заряженные молекулы пересечь липидный бислой сами никак не могут. Существует так называемая ATP-ADP-транслоказа, которая обменивает внутримитохондриальный АТР на ADP, находящийся вне митохондрии (рис. 8.24).
Рис. 8.24. Трансмембранный транспорт в митохондриях, связанный с синтезом АТР. Все потоки проходят через специализированные белковые транслоказы
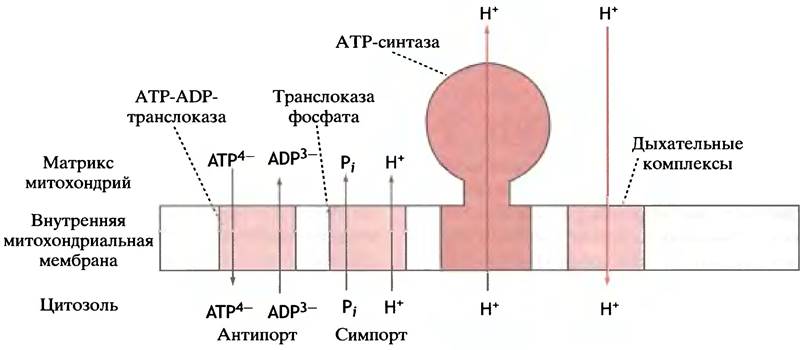
Откуда берется энергия для ADP-ATP обмена? Мы уже упоминали о том, что выкачивание протонов из митохондрий создает на внутренней мембране не только градиент pH, но и разность электрических потенциалов (минус - внутри). Молекула АТР несет четыре отрицательных заряда, a ADP - только три. Нетрудно видеть, что ADP-ATP обмен эквивалентен переносу одного отрицательного заряда из митохондрии наружу, т. е. по градиенту потенциала. Другими словами, движущей силой такого обмена является мембранный потенциал, возникающий в результате переноса электронов. Расчет показывает, что на ADP-ATP-обмен расходуется около четверти свободной энергии, высвобождающейся при транспорте электронов по цепи. Другие транспортные системы также могут приводиться в действие электрохимическим
градиентом. К их числу, например, относится транслоказа, обеспечивающая поступление в митохондрии фосфата, необходимого для синтеза АТР (см. рис. 8.24).
Баланс между синтезом АТР и транспортом электронов
Если исходить из допущения, что ADP и фосфат уже находятся в матриксе, то каждой синтезированной молекуле АТР соответствует прохождение через синтазу 3 протонов. ADP-ATP-обмен в чистом виде создает на мембране электрический потенциал, поскольку заряды у этих молекул отличаются на единицу. Чтобы такой обмен стал электронейтральным, в митохондрию должно поступать эквимолярное количество протонов, которые затем предстоит выкачать обратно. Поэтому, с учетом «транспортных расходов», синтез 1 молекулы АТР (доступной для использования в цитоплазме) сопряжен с переносом 4 протонов из матрикса наружу.
Каждой паре электронов, перенесенных от NADH на кислород, соответствует 10 протонов, перекачанных из митохондриального матрикса. Таким образом, окисление 1 молекулы NADH, уже находящейся внутри митохондрии, должно привести к синтезу 2,5 молекул АТР, а окисление 1 молекулы FADH2 (что эквивалентно молекуле сукцината) - к синтезу 1,5 молекул АТР. Раньше полагали, что синтезируются соответственно, три и две молекулы АТР. Эти величины принято называть отношениями P/О, поскольку перенос 2 электронов эквивалентен восстановлению 1 атома кислорода.
Молекулы NADH, образовавшиеся в ходе гликолиза, находятся в цитозоле. Они отдают свои пары электронов либо внутримитохондриальному NAD+, либо митохондриальному FAD, в зависимости от того, какой челночный механизм преобладает в данной клетке (см. с. 114). Благодаря этой неопределенности одной цитоплазматической молекуле NADHотвечает синтез от 1,5 до 2,5 молекул АТР.
Выход АТР при окислении молекулы глюкозы до СO2 и Н2O
Если в процесс окисления вступает молекула глюкозы, а не гликогена, валовый выход АТР из расчета на полностью окисленную молекулу субстрата составляет от 30 до 32 молекул в зависимости от того, какой тип челнока используется для цитоплазматического NADH.
Откуда берутся эти значения?
Некоторое количество АТР синтезируется в ходе субстратного фосфорилирования: 2 молекулы АТР поставляет гликолиз (продуцируются 4, но 2 расходуются) и еще 2 молекулы АТР (у млекопитающих это GTP) образуются в цикле лимонной кислоты (из 1 молекулы глюкозы образуются 2 молекулы ацетил-СоА, запускающие два оборота цикла). Итак, в процессе субстратного фосфорилирования синтезируются всего 4 молекулы АТР, а все остальные образуются в митохондриях с участием цепи переноса электронов.
При гликолизе в цитоплазме образуется также 2 молекулы NADH на 1 молекулу глюкозы. Их окисление увеличит выход АТР на 3-5 молекул в зависимости от типа используемого челнока. Кроме того, в расчете на 1 молекулу глюкозы пируватдегидрогеназа производит 2 молекулы NADH, а цикл лимонной кислоты - 6 молекул NADH. Их окисление приводит к синтезу 20 молекул АТР. Еще 3 молекулы АТР образуются за счет окисления FADH2при превращении сукцината в фумарат.
Суммируя все эти числа (в скобках - значения для глицерин-3-фосфатного челнока), получаем:
2 + 5(3) + 2 + 20 + 3 = 32 (30).
Заметим, что эта величина приблизительна. Точно оценить выход АТР можно только при субстратном фосфорилировании, а соотношение между выбросом протонов и синтезом АТР не является фиксированным.
Клетка кишечной палочки Escherichia coli в известном смысле подобна митохондрии. Ее плазматическая мембрана выполняет функцию внутренней мембраны митохондрии, а цитоплазма - матрикса. В такой клетке не нужно прибегать к челнокам для доставки NADH к дыхательной цепи. Она не нуждается в транспортных системах для ADP и АТР, поэтому выход АТР на молекулу окисленной глюкозы у Е. coli заметно выше.
Используется ли потенциальная энергия в виде протондвижущей силы для выполнения других задач, не связанных с синтезом АТР?
У новорожденных детей поддержание температуры тела на постоянном уровне требует усиленного производства тепла, которое обеспечивают клетки бурого жира. Своим цветом они обязаны обилию митохондрий, содержащих окрашенные цитохромы. Уровень синтеза АТР в митохондриях зависит от проницаемости внутренней мембраны для протонов; если она ничтожна, обратный поток протонов вынужден проходить через АТР-синтазу. При увеличении проницаемости мембраны происходит «короткое замыкание»: АТР не вырабатывается, и вся энергия рассеивается в виде тепла. В митохондриях клеток бурого жира есть специальный белок термогенин, благодаря которому во внутренней мембране появляются протонные каналы. Такой же эффект можно получить и на обычных митохондриях, используя соединения,
увеличивающие протонную проницаемость липидных бислоев (самое популярное из них - 2,4-динитрофенол). Все вещества, действующие подобным образом, называют разобщителями окислительного фосфорилирования, ибо они нарушают передачу энергии от окислительных систем к фосфорилирующим.
Бактерии также используют протонные насосы для создания протонного градиента на плазматической мембране и протонные ATP-синтазы для синтеза АТР (мы уже отмечали, что бактериальная клетка во многом напоминает митохондрию). Однако у бактериальных клеток есть своя специфика: они используют мембранные градиенты для закачивания в цитоплазму различных веществ из окружающей среды. Примером может служить симпорт протонов и лактозы, протекающий подобно симпорту Na+-ионов и метаболитов в животных клетках. Удивительно, что протонный градиент служит движущей силой для вращения бактериальных жгутиков.
Вопросы к главе 8
1. Дайте химическое обоснование глюкозо-фосфатизомеразной реакции.
2. Что подразумевается под субстратным фосфорилированием? Приведите примеры.
3. Реакция, давшая название пируваткиназе, в действительности никогда не протекает. Почему ферменту дали такое название и почему не протекает эта реакция?
4. Сколько молекул АТР образуется при расщеплении в гликолитическом пути 1 молекулы глюкозы и 1 глюкозильного остатка гликогена?
5. Почему нельзя однозначно ответить на вопрос: сколько молекул АТР образуется при окислении молекулы цитоплазматического NADH митохондриями эукариотических клеток?
6. В цикле лимонной кислоты превращению каждой ацетильной группы соответствует образование 9 восстановительных эквивалентов (или, что, то же самое, 9 атомов водорода) и 2 молекул СО2 (4 атомов кислорода). Откуда они взялись? 3 атома водорода и 1 атом кислорода - из ацетильной группы, еще 4 водорода и 2 кислорода принадлежат 2 молекулам воды, вступающим в цикл. Итак, всего 7 атомов водорода и 3 атома кислорода. Для баланса элементов не хватает 1 молекулы Н2О. Откуда она берется?
7. Почему продукт окисления изоцитрата декарбоксилируется, а сам он - нет?
8. Объясните, какое значение для цикла лимонной кислоты имеет анаплеротическая реакция.
9. Какой кофактор участвует в реакции декарбоксили- рования? Объясните, как он работает.
10. Как дыхательные комплексы складываются в единую цепь переноса электронов?
11. Что общего у убихинона и цитохрома с и чем они различаются как переносчики электронов? Где они локализованы в клетке?
12. Для чего нужна митохондриям цепь переноса электронов?
13. Выход АТР при окислении глюкозы в эукариотических клетках составляет 30 или 32 молекулы. В случае бактериальных клеток выход больше. Чем это вызвано?