БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 7. ПОЛУЧЕНИЕ ЭНЕРГИИ ИЗ ПИЩИ. ВВЕДЕНИЕ
Генерация энергии в форме АТР осуществляется сложными и переплетенными путями, рассмотрение которых лучше всего начать с превращения глюкозы.
Образование энергии из глюкозы
Основные этапы окисления глюкозы
Окисление глюкозы можно описать суммарным уравнением:
С6Н12О6 + 6О2 —> 6СО2 + 6Н2О.
Изменение свободной энергии ∆G°′ этой реакции равно -2820 кДж • моль-1. В клетках окисление молекулы глюкозы сопряжено с синтезом более 30 молекул АТР из ADP и Рi. Окисление глюкозы до СO2 и Н2O можно разделить на три этапа.
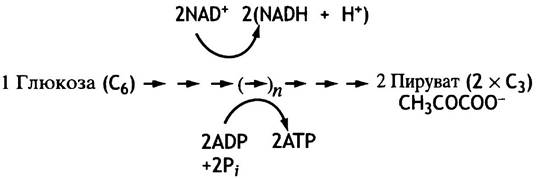
1. Гликолиз - процесс расщепления глюкозы на два трехуглеродных фрагмента (молекулы пировиноградной кислоты), сопряженный с восстановлением переносчика электронов; протекает в цитоплазме клетки.
2. Цикл Кребса (синонимы: цикл лимонной кислоты, цикл трикарбоновых кислот) - совокупность реакций, в результате которых второй и третий атомы углерода пировиноградной кислоты превращаются в СO2, с восстановлением переносчиков электронов. В этом процессе, проходящем внутри митохондрий, молекулярный кислород не участвует.
3. Электронтранспортная цепь - это цепь переноса электронов на O2, после чего он, забирая из окружающей среды водород в виде протонов, превращается в Н2O. У эукариот эта стадия происходит во внутренней мембране митохондрий, и именно она сопровождается образованием наибольшего количества АТР. Прежде чем подойти к более детальному рассмотрению окисления глюкозы, необходимо поговорить о природе биологического окисления.
Биологическое окисление и системы переноса водорода
Окисление совсем не обязательно должно быть связано с участием кислорода. Этот термин в общем случае отражает не что иное, как потерю электронов. Окисление может реализоваться либо в виде переноса электронов, как при превращении феррикатиона в феррокатион: Fe2+ —> Fe3+ + е-, либо в виде переноса электронов, сопровождаемого отщеплением водорода (протона) от окисляемой молекулы: АН2 —> А + 2е- + 2Н+.
В химических системах окисление можно рассматривать как перенос электронов от молекулы-донора к молекуле-акцептору. Протоны могут высвобождаться в окружающий раствор или переноситься вместе с электронами на акцептор, что эквивалентно переносу атомов водорода.
В аэробных клетках конечным окислителем служит кислород. Кислород электрофилен, т. е. может приобретать электроны; при этом образуется вода, причем требующиеся для этого протоны забираются из раствора:
O2 + 4e- + 4Н+ —> 2Н2O.
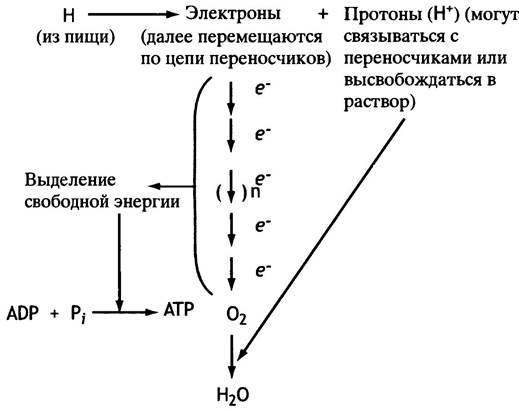
Между кислородом (конечным окислителем) и окисляемым метаболитом расположены промежуточные акцепторы электронов. Связывая электроны, они передают их следующему акцептору, образуя цепь, по которой электроны переносятся с исходного метаболита на кислород. Каждый из таких переносчиков попеременно выступает то акцептором электронов, то донором. Именно это позволяет рассматривать каждого из участников цепи в качестве переносчика электронов. С цепью переноса электронов связан синтез основного количества АТР. Общая схема устройства такой цепи изображена на рис. 7.1. Два участника этой цепи играют особенно важную роль, и их свойства нужно очень хорошо знать.
Рис. 7.1. Общая концепция переноса электронов на кислород и генерации АТР
NAD+ - важный переносчик электронов
Первым переносчиком электронов, который непосредственно встречается с большинством окисляемых метаболитов, является никотинамидадениндинуклеотид, или NAD+. На примере АМР (см. рис. 1.6) мы уже встречались с нуклеотидами - соединениями, имеющими строение типа азотистое основание-сахар-фосфат.
В молекуле АМР нуклеиновым основанием служит аденин (строение аденина и других оснований см. в главе 18). В случае NAD+ мы имеем дело с двумя нуклеотидами, которые связаны друг с другом своими фосфатными группами. Поэтому данное соединение и называют динуклеотидом. По своей структуре NAD+ отличается от динуклеотидных элементов нуклеиновых кислот, в которых мононуклеотиды также соединены фосфоэфирной связью. Строение NAD+ можно представить следующим образом: основание-сахар-фосфат- фосфат-сахар-основание. Одно из этих оснований - аденин, как и в АТР, а другое - никотинамид (амид никотиновой кислоты); сахара одинаковые - рибоза. Итак, строение NAD+можно изобразить следующим образом:
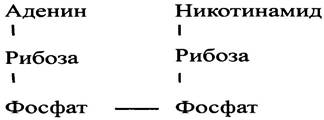
NAD+ является коферментом: так называют низкомолекулярные органические соединения, которые принимают участие в ферментативных реакциях. От обычного субстрата NAD+ отличается тем, что, будучи восстановленным, он покидает один фермент и тут же окисляется другим ферментом. Оба фермента - «всего лишь» катализаторы, так что в действительности NAD+ восстанавливается субстратом первого фермента, а окисляется субстратом второго, выполняя функцию переносчика электронов, постоянно окисляясь и восстанавливаясь.
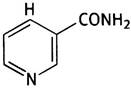
«Рабочим участком» этого кофермента служит остаток никотинамида; никотиновая кислота (другое название - ниацин) - витамин. Для некоторых животных он является необходимым компонентом пищи, однако организм человека способен синтезировать его самостоятельно из аминокислоты триптофана. Остальная часть молекулы NАD+служит для связывания с ферментами и не подвергается химическим превращениям в ходе каталитического цикла.
Никотинамид имеет следующее строение:
Строение NAD+ можно представить так:
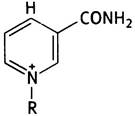
где R - остальная часть молекулы NАD+.
Восстановление NАD+ можно рассматривать как присоединение двух электронов и протона или, что эквивалентно, так называемого гидрид-иона (Н-). Восстановленный продукт (NАDН) имеет следующее строение:
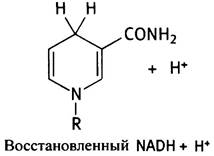
NAD+ служит коферментом различных дегидрогеназ, осуществляющих реакции типа:
АН2 + NAD+ «-» А + NADH + Н+
Восстановленный NAD+ затем диффундирует к другому ферменту, где подвергается окислению:
В + NADH + Н+ «-» ВН2 + NAD+
Таким образом, NAD+ действует в качестве переносчика двух атомов водорода от субстрата А к субстрату В:
АН2 + В —> А + ВН2.
В биохимии такие реакции часто изображают в виде карусели:
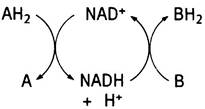
Хотя формально происходящее можно представить, как перенос двух атомов водорода, в действительности один из них «путешествует» с восстановленным NAD+, тогда как движение другого реализуется в виде двух последовательно протекающих и разнесенных в пространстве событий: отщепления протона с его выходом в окружающую среду и связывания протона из окружающей среды. Поэтому при использовании аббревиатуры NADH всегда подразумевается комбинация NADH + Н+.
FAD - важный переносчик электронов
FAD - флавинадениндинуклеотид - служит важным переносчиком электрона (водорода). Он является производным витамина В2 (рибофлавина). Восстанавливаясь, FADприсоединяет два атома водорода и превращается в FADH2. В отличие от NAD+, который перемещается от одной дегидрогеназы к другой, FAD прикреплен к апоферменту, являясь его простетической группой.
FAD имеет следующее строение: циклическая система изоаллоксазина-рибит-фосфат-фосфат-рибоза- аденин. Изоаллоксазин - это химическое название системы циклов в рибофлавине; рибит - пятиатомный спирт, остаток которого также входит в структуру рибофлавина. Термин «динуклеотид» еще менее применим к FAD, чем к NAD, поскольку рибит не является сахаром. Структурные изменения при восстановлении FAD, точнее изоаллоксазинового остатка, приведены ниже:
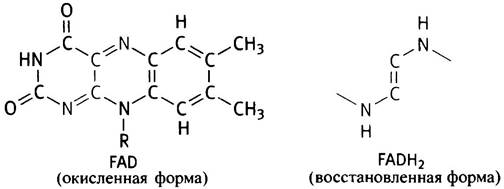
Еще одним переносчиком электронов является флавинмононуклеотид, или FMN. Он имеет следующее строение: циклическая система изоаллоксазина-рибит- фосфат и отличается от витамина В2 (рибофлавина) только наличием фосфата.
И окисленные, и полностью восстановленные формы FMN и FAD имеют тождественные структуры изоаллоксазинового остатка. Оба флавиновых кофермента
могут существовать и в форме так называемых семихинонов. На полное восстановление флавина расходуется два электрона, а на частичное - один. Это позволяет флавинам участвовать в реакциях как одноэлектронного, так и двухэлектронного переноса.
Гликолиз - первый этап окисления глюкозы
Окисление глюкозы происходит в три стадии, первой из которых является гликолиз. Это - бескислородный процесс, в ходе которого синтезируется всего две молекулы АТР на молекулу глюкозы. Как показано на рис. 7.2, конечными продуктами гликолиза являются пируват (т. е. анион пировиноградной кислоты) и NADH. Если гликолиз протекает в аэробных условиях (в присутствии кислорода), оба эти вещества поступают в митохондрии, где пируват окисляется до СO2 и Н2O, a NADH - в NAD+.
Рис. 7.2. Аэробный гликолиз глюкозы (общая схема)
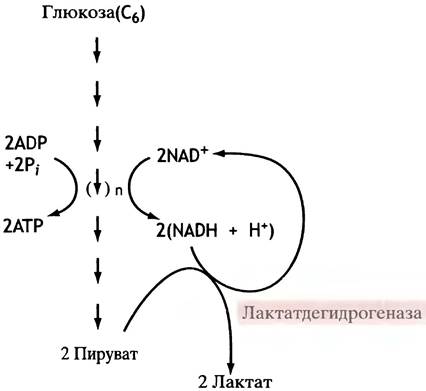
Однако обеспечение организма кислородом не всегда соответствует потребности в нем. Например, на начальных фазах реакции тревоги, когда частота сердечных сокращений возросла еще не очень сильно, резко повышается скорость гликолиза, чтобы обеспечить мышечное сокращение необходимым количеством АТР. Поскольку NAD+- это своего рода катализатор, присутствующий в клетках в малых количествах, очень важно, чтобы NADH успевал окисляться обратно в NAD+: ведь если нет NAD+, то нет и гликолиза. Никак нельзя допустить торможения гликолиза, который остается единственным источником энергообеспечения мышц, если митохондрии не справляются с этой задачей. На этот случай предусмотрена запасная система регенерации NAD+ из NADH, которая основана на окислении NADH пируватом. Эту реакцию катализирует лактатдегидрогеназа,которая в достаточном количестве присутствует в мышечных клетках.

Образование лактата (т. е. аниона молочной кислоты) из глюкозы называют анаэробным гликолизом, чтобы отличить его от аэробного гликолиза, при котором образуется пируват и окисляемый в митохондриях NADH. Подчеркнем, что смысл анаэробного гликолиза вовсе не в образовании лактата. Это лишь способ поддержать синтез АТР в условиях, когда блокирован нормальный путь реокисления NADH (рис. 7.3). Анаэробный гликолиз - экономически крайне невыгодный способ производства АТР, поскольку на каждую израсходованную молекулу глюкозы синтезируются всего лишь две молекулы АТР. Когда сердце переключится на ускоренный ритм и снабжение мышц кислородом станет адекватным их нагрузке, возобновляется реокисление NADH, и гликолиз становится аэробным. Накопившийся в мышцах лактат не является бесполезным шлаком, он выводится в кровь и утилизируется печенью (см. с. 151).
Рис. 7.3. Анаэробный гликолиз глюкозы (общая схема)
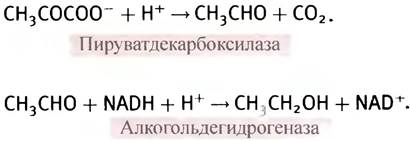
Заметим, что, используя аналогичный подход, дрожжи могут существовать в отсутствие кислорода сколь угодно долго только за счет анаэробного гликолиза. В их клетках пируват декарбоксилируется (т. е. теряет СO2) с образованием ацетальдегида. Последний же расходуется на окисление NADH, катализируемое алкогольдегидрогеназой. Из-за низкого выхода АТР огромное количество глюкозы расщепляется с образованием спирта и СO2.
Приведенное описание гликолиза упрощено, чтобы выделить его главные особенности. Так, основное количество глюкозы в мышцах сосредоточено в гликогене. Если продукцию АТР относить не к свободной глюкозе, а к одному из ее остатков в гликогене, то гликолиз приводит к образованию не двух, а трех молекул АТР на молекулу глюкозы.
Цикл лимонной кислоты - второй этап окисления глюкозы
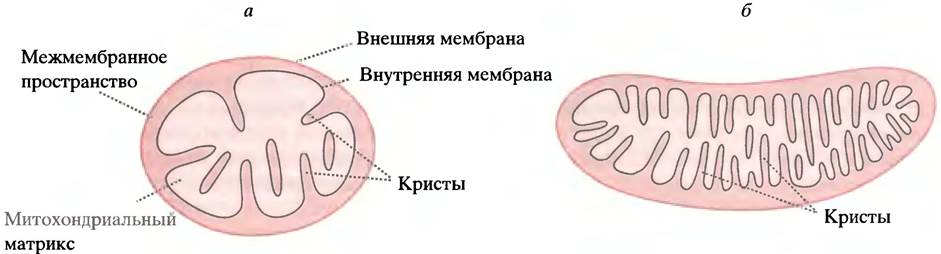
Митохондрии - небольшие внутриклеточные мембранные органеллы (см. рис. 3.15). Их можно считать главными электростанциями клеток, так как в них синтезируется основное количество АТР. Митохондрии окружены двумя мембранами. Внешняя мембрана проницаема для многих соединений и особой роли в производстве энергии не играет. Внутренняя мембрана обладает крайне низкой проницаемостью для большинства веществ, кроме тех, для которых в ней предусмотрены специализированные транспортные системы. Внутренняя мембрана образует складки, или кристы, увеличивающие ее площадь. Чем больше энергии образуется в ткани, тем больше крист в митохондриях и тем плотнее они упакованы (рис. 7.4). Внутри митохондрия заполнена концентрированным раствором ферментов: его называют матриксом. Вторая стадия метаболизма глюкозы - цикл лимонной кислоты - протекает в матриксе, и лишь одна из реакций цикла происходит во внутренней мембране.
Рис. 7.4. Митохондрии печени (а) и сердечной мышцы (б). Число крист отражает потребности клеток в АТР
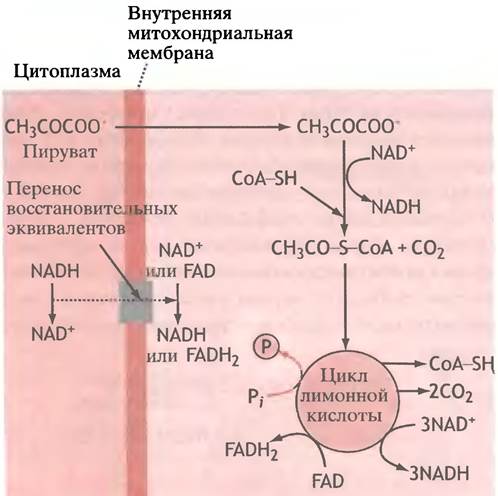
Как уже отмечалось, аэробный гликолиз, протекающий в цитоплазме, приводит к образованию пирувата и NADH. Пируват попадает в митохондриальный матрикс с помощью специальной транспортной системы, a NADH туда проникнуть не может. Вместо него посредством особого челночного механизма через внутреннюю мембрану переносится его «восстановительный эквивалент», который внутри митохондрий передается NAD+- и FAD-ферментам. В конечном итоге NADH, образовавшийся в ходе гликолиза, реокисляется митохондриями. NAD+ остается в цитоплазме для дальнейшего участия в гликолизе. Внутри митохондрий NADH и FADH2 окисляются электронтранспортной системой.
Необходимо отметить, что в некоторых клетках, например, эритроцитах, нет митохондрий, и у них гликолиз является единственным источником АТР. Естественно, что существование таких клеток полностью зависит от поступления глюкозы.
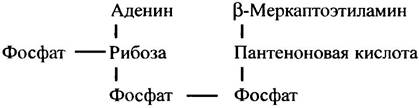
Рассмотрим ферментативную реакцию, посредством которой поступивший в митохондрии пируват превращается в соединение, играющее ключевую роль во многих метаболических превращениях - ацетил-кофермент А, или ацетил-СоА. Ацетил-кофермент А в биохимических реакциях часто обозначают как CoA-SH, потому что тиольная группа представляет собой реакционный центр его молекулы. В отличие от NAD+ и FAD, кофермент А служит для переноса не электронов, а ацильных остатков. Он является динуклеотидом, в состав которого входит остаток водорастворимого витамина - пантотеновой кислоты.
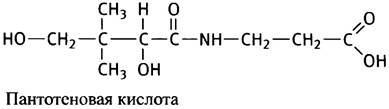
Любопытно, что пантотеновая кислота в коферменте А играет иную роль по сравнению с другими витаминами - ниацином в NAD+ и рибофлавином в FАD, которые принимают непосредственное участие в химических реакциях. Остаток пантотеновой кислоты, по-видимому, нужен для распознавания кофермента А белками, хотя совершенно непонятно, почему эволюция для этого избрала столь уникальную в биохимии структуру.
Строение кофермента А можно описать следующей схемой:
β-Меркаптоэтиламин - главная «рабочая» группа молекулы:
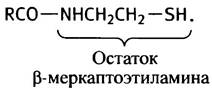
Молекула кофермента А переносит ацильные остатки в виде тиоэфиров, например, ацетил-СоА, который имеет строение: CH3CO-S-CoA. В отличие от обычных сложных эфиров, тиоэфиры являются макроэргическими соединениями. Величина ∆G°′ их гидролиза равна -31 кДж • моль-1, тогда как при гидролизе эфиров карбоновых кислот ∆G°′ -20 кДж • моль-1. Разницу в значении ∆G°′ можно объяснить тем, что эфиры карбоновых кислот резонансно стабилизированы и, следовательно, характеризуются более низким содержанием свободной энергии, чем тиоловые эфиры, резонансно не стабилизированные. Эта особенность тиоэфиров используется в разных биохимических системах.
Пируват в митохондриях подвергается окислительному декарбоксилированию, которое включает отщепление СO2 (декарбоксилирование), перенос двух электронов на NAD+ (окисление) и перенос образовавшейся ацетильной группы на кофермент А. В дрожжах тоже происходит декарбоксилирование пирувата, катализируемое пируватдекарбоксилазой, однако оно не сопровождается окислением (NAD+ не участвует в реакции) и приводит к образованию не ацетильного остатка, а ацетальдегида. Большое отрицательное изменение свободной энергии свидетельствует о том, что окислительное декарбоксилирование пирувата необратимо:
Пируват + СоА - SH + NAD+ —> Ацетил-S-СоА + NADH + Н+ + СO2
∆G°′ = - 33,5 кДж • моль-1.
Ацетильный остаток в ацетил-СоА - это та форма, в которой пируват вводится в цикл лимонной кислоты. Иначе этот цикл называют циклом Кребса (по имени первооткрывателя), или циклом трикарбоновых кислот (поскольку ряд участвующих в нем метаболитов содержит три карбоксильные группы). Ацетильные углеродные атомы в ацетил-СоА, которые ранее принадлежали пирувату, превращаются в СO2, и параллельно с этим 3 молекулы NAD+ восстанавливаются в NADH, а 1 молекула FAD - в FADH2. Кроме того, следствием всех этих превращений является синтез одной «высокоэнергетической» фосфорильной группы из Pi на каждую исчезнувшую ацетильную группу (рис. 7.5).
Рис. 7.5. Упрощенное изображение, показывающее, что происходит с NАDН, образовавшимся при гликолизе, и как осуществляется генерация NАDН и FАDН2 в митохондриях
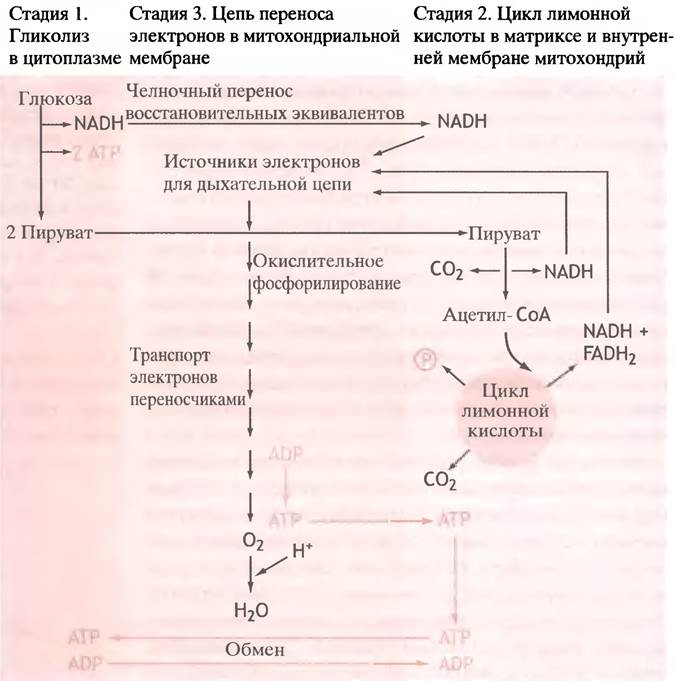
Итак, молекула пирувата, поступившая из цитоплазмы в митохондрию, превратилась в 3 молекулы СO2; при этом восстановились 3 молекулы NAD+ и 1 молекула FAD, а также образовалась одна молекула АТР. Учитывая, что 1 молекула глюкозы расщепляется на 2 молекулы пирувата, гликолиз вместе с циклом лимонной кислоты позволяет получить 4 моля АТР на моль глюкозы. Но еще 30 молекул АТР будет образовано потом.
Перенос электронов на кислород - третий этап окисления глюкозы
Речь пойдет об окислении NADH и FADH2, которое происходит во внутренней мембране митохондрий, где осуществляется последовательная передача электронов специальными переносчиками.
Иерархия переносчиков электронов в электронтранспортной цепи
Напомним, что задача состоит в переносе электронов от NАDН и FАDН2 к кислороду с образованием воды:
NADН + Н+ + 1/2О2 —> NAD+ + H2O.
Изменение свободной энергии этого процесса ∆G°′составляет-220 кДж • моль-1. Чтобы разобраться в том, как он протекает, нужно воспользоваться данными об окислительно-восстановительных потенциалах, участвующих в нем соединений (их часто называют редокс-потенциалами). В любой окислительно-восстановительной реакции участвуют акцептор электронов (окислитель) и донор электронов (восстановитель). Суммарную реакцию:
X- + У <-> X + Y-
можно условно разделить на две полуреакции:
X- <-> X + е (1)
Y + е <-> Y- (2)
В каждой из них участвуют окисленная и восстановленная формы одного соединения; их называют сопряженной парой, окислительно-восстановительной парой, или редокс-парой. Здесь такими парами являются X и X-, а также Y и Y-. Ясно, что в действительности в реакции участвуют обе редокс-пары, одна из которых отдает электрон, а другая его принимает.
Разные редокс-пары обладают различным сродством к электрону. Те, у которых это сродство меньше, отдают электрон тем, у кого оно больше. Мерой сродства редокс-пары к электрону служит так называемый окислительно-восстановительный потенциал (или редокс-потенциал) E’0. Значение этого параметра позволяет предугадать направление переноса электрона между реактантами. Не менее важно и то, что величина Е'0 непосредственно связана с изменениями свободной энергии.
Величину Е0 выражают в вольтах. Чем она меньше (отрицательнее), тем меньше сродство вещества к электронам, тем выше способность их отдавать, тем значительнее восстановительный потенциал и тем выше энергия электронов.
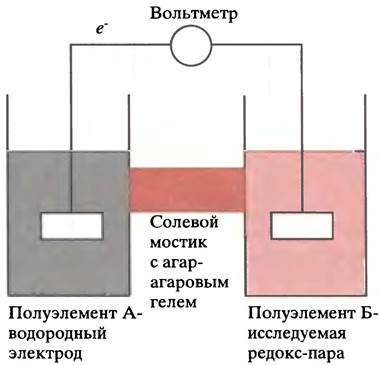
Причина, по которой, казалось бы, чисто химическое свойство веществ выражается в вольтах, объясняется способом измерения редокс-потенциала. В окислительно-восстановительной реакции должны участвовать две редокс-пары, между которыми осуществляется перенос электронов. Они могут быть разнесены по разным сосудам (полуэлементам). Если соединить такие полу- элементы медным проводом (проводником электронов), можно направлять электронный поток. При измерении Е'0 в качестве одной из редокс-пар используют реакцию 2Н+ + 2е- <-> Н2, катализируемую платиновой чернью (так называемый водородный электрод), тогда как другой сопряженной парой служит смесь окисленной и восстановленной форм интересующего нас соединения. Помимо положительных ионов в каждом полуэлементе присутствуют еще и анионы. Электроны перетекают по проводу в направлении, зависящем от величины их потенциалов (от сродства двух систем к электрону). Допустим, что водородный электрод соединен с полу- элементом, содержащим ионы Fе2+ и Fе3+. Перераспределение электронов приведет в этом случае к изменению количества катионов в обоих сосудах. Чтобы ток продолжал идти по проводу, нужно сохранить электронейтральность каждого раствора, обеспечив поток анионов для выравнивания заряда. С этой целью сосуды соединяют трубкой, заполненной агар-агаровым гелем (чтобы совместить ионную проводимость с отсутствием потока жидкости). Такое устройство называют агаро-солевым или агаровым мостиком (рис. 7.6). Разность электрических потенциалов полуэлементов измеряют вольтметром, врезанным в соединительный провод. Потенциал водородного электрода принято считать равным нулю. Таким образом, все экспериментальные значения Е'0 рассчитываются исходя из этого стандарта, и потому они являются относительными величинами. У физиков принято считать, что электрический ток направлен навстречу движению электронов. Поэтому полуэлемент, отдающий электроны, находится под более отрицательным напряжением.
Рис. 7.6. Схема прибора для измерения редокс-потенциалов. Водородный электрод сравнения (А) содержит редокс-пару Н2/2Н+, окислительно-восстановительная реакция которой катализируется платиновой чернью, нанесенной на электрод. Второй полуэлемент (Б) содержит редокс-пару, потенциал которой должен быть измерен. Если Б более восстановлен (Е'0 имеет более отрицательное значение, чем Е'0 водородного электрода), чем А, электроны будут двигаться от Б к А и восстанавливать 2Н+ до Н (если полуэлементы соединены медным проводом), а анионы будут перемещаться от А к Б по агар-солевому мостику, чтобы нейтрализовать заряд. Если Б менее восстановлен, чем А (величина Е'0 более положительна, чем Е'0 водородного электрода), весь процесс будет протекать в противоположном направлении
Величина Е0 (без штриха) - стандартная величина окислительно-восстановительного потенциала, которая определяется в стандартных условиях, когда концентрации всех веществ равны 1 М, а давление водорода составляет 1 атмосферу. В биохимии обычно используют значения потенциала E'0, отвечающее pH 7 (вместо pH 0). При этом потенциал электрода сравнения (т. е. водородного электрода) равен -0,42 В. Для реакции NАD+ + 2Н+ + 2е- —> NАDН + Н+ величина Е'0 = -0,32 В, а для 1/2O2 + 2Н+ + 2e- —> Н2O значение Е'0 = +0,82 В. Столь большая разница значений редокс-потенциалов указывает на то, что NАDН способен восстановить кислород до воды, а обратная реакция невозможна.
Редокс-потенциалы E'0 связаны с изменением свободной энергии ∆G°′ уравнением Нернста:
∆G°′ = - nF∆Е0',
где n - число перенесенных в реакции электронов; F - постоянная Фарадея (96,5 кДж • В-1 • моль-1); ∆Е'0 - разность редокс-потенциалов электронодонорной и электроноакцепторной пар.
Реакцию окисления NADH:
NADH + Н+ + 1/2O2 —> NAD+ + Н2O
можно представить, как комбинацию двух полуреакций:
NADH + Н+ —> NAD+ + 2Н+ + 2е- Е'0 = -0,320 В;
1/2O2 + 2Н+ + 2е- —> Н2O Е'0 = -0.816 В.
Для суммарной реакции: Е'0 = - 0,320 - 0,816 = 1,136 В,
поэтому:
∆G°′ = -2(96,5 кДж • В-1 • моль-1)(-1,136 В) = -219,25 кДж • моль-1.
Рис. 7.7. Цепь переноса электронов (принципиальная схема). Некоторые переносчики принимают только электроны, а протоны высвобождаются в воду. Другие переносчики передают и электроны, и протоны. Конечная стадия - перенос электронов на молекулу кислорода. FАDН, расположен в цепи переноса ниже, чем NADH. (Число переносчиков выбрано произвольно)
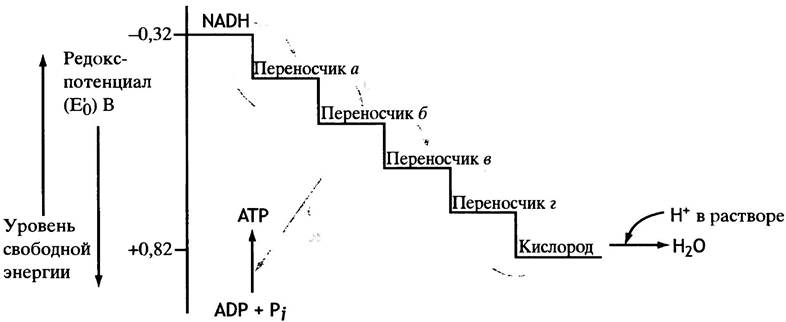
Транспорт электронов к кислороду происходит не в один этап. Система транспорта электронов в митохондриях представляет собой цепочку из переносчиков электронов, у которых по мере приближения к кислороду возрастает редокс-потенциал (и соответственно уменьшается восстановительный потенциал). Движение электронов от NADH и FADH2 к кислороду можно уподобить скатыванию с лестницы, ступеньками которой служат переносчики электронов. При каждом прыжке со ступеньки на ступеньку высвобождается порция свободной энергии (рис. 7.7), которая не пропадает впустую, рассеиваясь в виде тепла, как при горении глюкозы, а с помощью особых механизмов используется для синтеза АТР из ADP и Рi. Вот почему этот сложный процесс называют окислительным фосфорилированием. При окислении 1 моля глюкозы образуется более 30 молей АТР. Схемы всех трех рассмотренных выше этапов окисления глюкозы объединены на рис. 7.8.
Рис. 7.8. Окисление глюкозы. Для простоты показаны только продукты превращений (очевидно, что восстановленный NADH образуется из NAD+). При окислении гликогена на каждый остаток глюкозы при гликолизе образуются три молекулы АТР. В цикле лимонной кислоты в качестве макроэргического соединения образуется не АТР, a GTP. АТР из митохондрий поступает в цитоплазму в обмен на ADP. NADH и FADH2 вырабатываются не только при окислении глюкозы, но также при окислении жирных кислот и др. NADH и FADH2 передают электроны дыхательной цепи в разных ее участках
Генерация энергии при окислении жиров и аминокислот
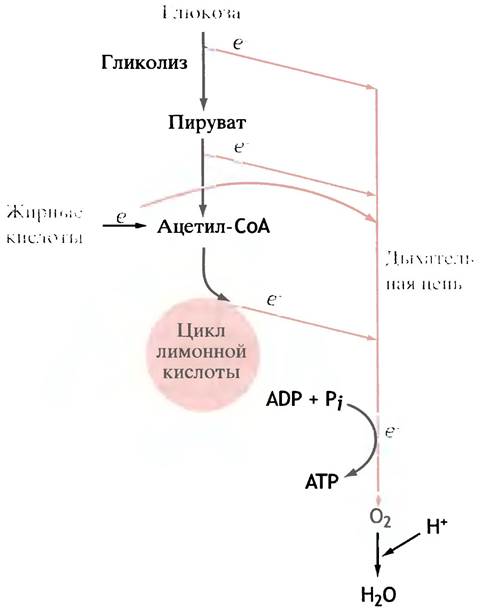
Для обеспечения себя энергией в виде АТР организм окисляет не только глюкозу и гликоген, но также жиры и избыточные количества аминокислот. В случае триглицеридов с точки зрения энергообеспечения главное значение имеет окисление не глицеринового остатка, а жирной кислоты. Химическое строение жирных кислот ничего общего не имеет со строением глюкозы, и естественно ожидать, что механизм их окисления совершенно иной. Именно поэтому так поражает магическая простота, с которой увязаны воедино метаболические пути самых разных веществ. В ходе превращений глюкозы образуется ацетил-СоА, который вступает в цикл лимонной кислоты. Жирные кислоты подвергаются последовательному расщеплению, в результате каждого из них пара углеродных атомов также превращается в ацетильную группу ацетил-СоА, поступающего в цикл лимонной кислоты. Поэтому метаболизм жирных кислот и глюкозы различается только до момента образования ацетил-СоА. Более того, на первых стадиях превращения глюкозы и жирных кислот образуются восстановленные формы NAD (NADH) и FAD (FADH2), которые далее окисляются в митохондриальной цепи переноса электронов (рис. 7.9).
Рис. 7.9. Окисление жиров и глюкозы. На рисунке показано, как формируется поток электронов, поступающий в дыхательную цепь
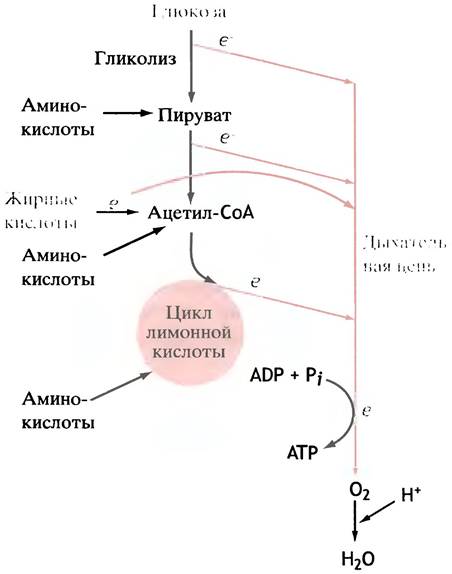
Окисление аминокислот сходно с окислением глюкозы и жирных кислот, хотя и сложней в деталях. Все 20 аминокислот могут использоваться для генерации энергии, если их количество превышает сиюминутные потребности организма в синтезе белков. Схема их метаболизма, несмотря на различия в строении, универсальна: они дезаминируются, а лишенная азота углеводородная часть молекулы используется в конечном итоге на образование пирувата и/или ацетил-СоА, вовлекающихся в цикл лимонной кислоты (рис. 7.10). Таким образом, этот цикл играет центральную роль в метаболизме.
Рис. 7.10. Окисление глюкозы, жиров и аминокислот для генерации энергии
Взаимозаменяемость разных видов «топлива»
Избыток глюкозы может перерабатываться в жиры. Это происходит благодаря тому, что жирные кислоты синтезируются из ацетил-СоА:
Глюкоза —> пируват —> ацетил-СоА —> жирные кислоты.
Однако у животных жирные кислоты не могут быть переработаны в глюкозу, поскольку ее синтез протекает с непременным участием пирувата, а его нельзя получить из ацетил-СоА из-за необратимости реакции, катализируемой пируватдегидрогеназой. Поэтому жирные кислоты не могут превращаться в глюкозу (рис. 7.11), но глюкоза может превращаться в триглицериды.
Рис. 7.11. Упрощенное изображение, показывающее, почему у животных глюкоза превращается в жиры, но жиры не могут быть превращены в глюкозу. Обратные пути превращений не полностью совпадают с прямыми. Растения и бактерии могут превращать жиры в глюкозу, не прибегая к обращению пируватдегидрогеназной реакции
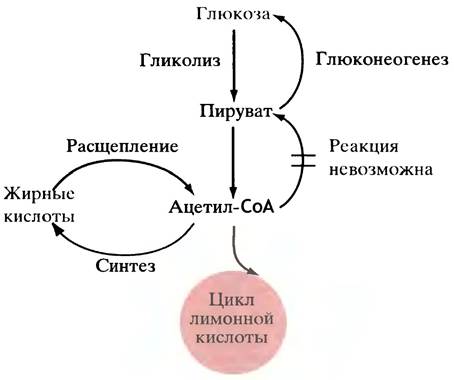
Те аминокислоты, которые при распаде поставляют пируват или карбоновые кислоты для цикла лимонной кислоты, могут перерабатываться животными в глюкозу (их называют глюкогенными). В условиях голода мышечные белки расщепляются, а образующиеся при этом аминокислоты утилизируются печенью для образования глюкозы. Растения и бактерии умеют превращать в глюкозу жир и двухуглеродные соединения вроде
ацетата, однако они используют для этого особый, так называемый глиоксилатный цикл (разновидность цикла лимонной кислоты), которого нет у животных.
Вопросы к главе 7
1. Что представляют собой три этапа окисления глюкозы и где они протекают?
2. Опишите строение NAD+. Изобразите его электроноакцепторную группу в окисленной и восстановленной форме. Каким образом NAD+ переносит водород между субстратами?
3. Расскажите о строении и функции FAD.
4. В чем разница между аэробным и анаэробным гликолизом в мышцах? Когда используется анаэробный гликолиз?
5. Опишите строение кофермента А. Какая часть его молекулы используется в качестве акцептора ацильных остатков? Каково ∆G°′ гидролиза тиолового эфира? Сравните эту величину с ∆G°′ гидролиза карбоксильного эфира.
6. Опишите реакцию, катализируемую пируватдегидрогеназой, и приведите значения ∆G°′.
7. Какова в норме судьба образующегося в пируватдегидрогеназной реакции ацетил-СоА?
8. В результате гликолиза и цикла лимонной кислоты образуются NADH и FADH2. Какова дальнейшая судьба этих соединений?
9. Редокс-пара FAD + 2H+ + 2e- —> FADH2 характеризуется E′0 = -0,219 В, а редокс-пара 1/2 O2 + 2Н+ + 2е- —> Н2O имеет Е′0 = +0,816 В. Вычислите ∆G0’ при окислении FADH2 кислородом до воды.
10. Как помимо пируватдегидрогеназной реакции в организме может синтезироваться ацетил-СоА?
11. А. Может ли глюкоза превращаться в жиры? Объясните ваш ответ. Б. Могут ли жирные кислоты у животных превращаться в глюкозу? Объясните ваш ответ. В. Могут ли жирные кислоты у Е. coli превращаться в глюкозу? Объясните ваш ответ.