БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 6. БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ТРАНСПОРТА, ХРАНЕНИЯ И МОБИЛИЗАЦИИ ПИЩИ
Превращение глюкозы в организме
Механизм синтеза гликогена
Прежде всего отметим, что синтез гликогена из глюкозы - процесс эндоэргонический, т. е. требующий затрат энергии. ∆G°′ гидролиза гликозидной связи составляет -16 кДж • моль-1, так что равновесному состоянию отвечает практически полное гидролитическое расщепление гликогена до глюкозы (гликоген + Н2O —> глюкоза). Образование гликозидной связи протекает в организме сопряженно с гидролизом макроэргического фосфатного производного.
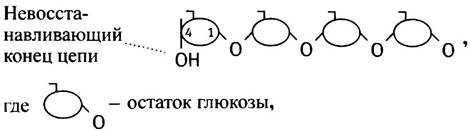
Синтез гликогена происходит путем увеличения существующей затравки молекулы гликогена (именуемой праймером) за счет последовательного присоединения отдельных молекул глюкозы. Таким праймером служит белок гликогенин, к одному из тирозиновых остатков которого с помощью О-гликозидной связи присоединена олигосахаридная цепочка из 8 остатков глюкозы. Этот белок так и остается включенным в гранулу гликогена. Молекулы глюкозы всегда присоединяются к невосстанавливающему (нередуцирующему) концу полисахарида. Глюкоза принадлежит к классу сахаров, называемых альдозами. В водных растворах ее циклическая (преобладающая) форма находится в равновесии с открытой формой, которая содержит альдегидную группу.
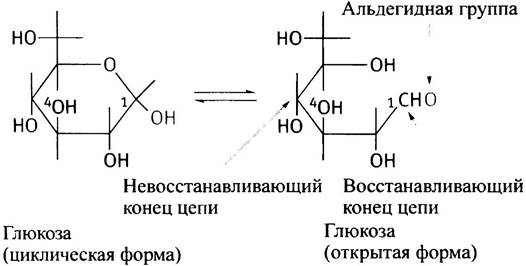
Альдегидная группа - это восстанавливающий агент, так что С-1 -конец кольцевой формы называется восстанавливающим, а С-4-конец - невосстанавливающим. Цепь гликогена поэтому всегда имеет невосстанавливающий конец.
Итак, молекула гликогена схематически может быть представлена в следующем виде:
а ее биосинтез с участием АТР можно описать схемой:
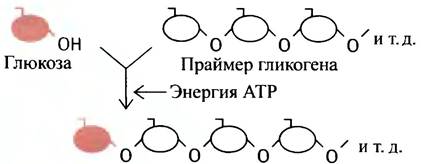
Этот процесс повторяется многократно, что и приводит к образованию длинной полисахаридной цепи.
Как синтез гликогена обеспечивается необходимой энергией?
Когда глюкоза входит в клетку, она подвергается фосфорилированию посредством АТР. Эту реакцию в мозге и мышцах катализирует фермент гексокиназа.
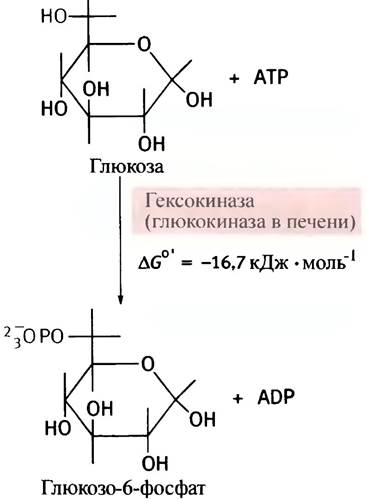
Киназы - семейство ферментов, переносящих фосфорильный остаток с АТР на различные молекулы, а глюкоза - один из представителей моносахаридов - гексоз; отсюда и название гексокиназа. В печени эту же реакцию катализирует другой фермент - глюкокиназа.
Фосфорилирование - экзоэргоническая и поэтому практически необратимая реакция. Образующийся глю- козо-6-фосфат в отличие от самой глюкозы является сильно заряженной молекулой, из-за чего она не может диффундировать через плазматическую мембрану. В то же время фосфорилирование сопровождается уменьшением концентрации свободной глюкозы в цитоплазме. Оба эти фактора способствуют диффузии глюкозы в клетки из окружающей среды в соответствии с ее концентрационным градиентом. Фосфорильный остаток в молекуле глюкозофосфата под влиянием фермента фосфоглюкомутазы может обратимо мигрировать между гидроксильными группами при С-6- и С-1-атомах.
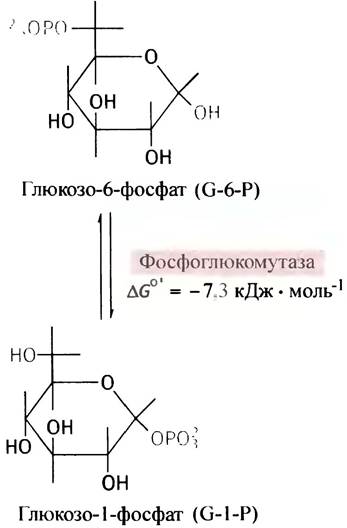
Величины свободной энергии гидролиза глюкозо-1-фосфата и гидролиза α-(1 —> 4)-гли- козидной связи гликогена одинаковы и равны -21,0 кДж • моль-1. Свободная энергия гидролиза α-(1 —>4)-гликозидной связи в дисахариде мальтозе равна -15,5 кДж • моль-1. Поэтому вполне естественно предположить, что наращивание цепи гликогена происходит в результате реакции между глюкозо-1-фосфатом и праймером гликогена. Но это ошибочное мнение. Биохимические реакции комбинируются таким образом, чтобы суммарный процесс оказался термодинамически необратимым. Между тем прямой синтез гликогена из глюкозо-1-фосфата оказался бы реакцией обратимой и, следовательно, не контролируемой.
Чтобы придать синтезу гликогена термодинамическую необратимость, в него введена дополнительная стадия. Чтобы разобраться в ней, вспомним структуру АТР (см. рис. 1.6). Его аналогом является уридинтрифосфат (UTP), в молекуле которого место аденина занимает урацил. Клетка синтезирует UTP, используя АТР в качестве источника энергии. Оказалось, что при синтезе гликогена промежуточным продуктом является уридиндифосфоглюкоза (UDP-глюкоза), образующаяся из UTP и глюкозо-1-фосфата.
По чисто формальной причине (так требуют правила номенклатуры) фермент, катализирующий эту реакцию, назван по обратной реакции, реально в клетке не протекающей - UDP-глюкозопирофосфорилазой. Необратимость этой реакции достигается тем, что неорганический пирофосфат (продукт прямой реакции) в клетке чрезвычайно быстро гидролизуется пирофосфатазой.
Именно UDP-глюкоза, а не глюкозо-1 -фосфат, выступает как донор остатка глюкозы при синтезе гликогена. Ее можно рассматривать как активированный сахар, и в таком качестве UDP-производные сахаров участвуют в биосинтетических реакциях у животных. Почему именно они - загадка, вторую еще предстоит разгадать. Во всяком случае, в растениях синтез крахмала происходит с участием не урацильных, а адениновых соединений. Схема синтеза гликогена с участием UDP-глюкозы в качестве донора глюкозного остатка представлена на рис. 6.2. Эту реакцию катализирует фермент гликоген- синтаза (синтазами называют ферменты, катализирующие синтетическую реакцию без использования АТР; в противном случае используют термин синтетазы). Еще раз вернемся к вопросу о необратимости реакции образования UDР-глюкозы из UТР и глюкозо-1-фосфата. В ходе этой реакции (см. рис. 6.1) образуется неорганический пирофосфат, гидролиз которого протекает необратимо (∆G°′ = -33,5 кДж • моль-1). Именно это обстоятельство придает необратимость всей совокупности реакций, включенных в биосинтез гликогена (рис. 6.3). Этим же объясняется невозможность распада гликогена простым обращением реакций его синтеза.
Рис. 6.2. Синтез гликогена путем удлинения затравки
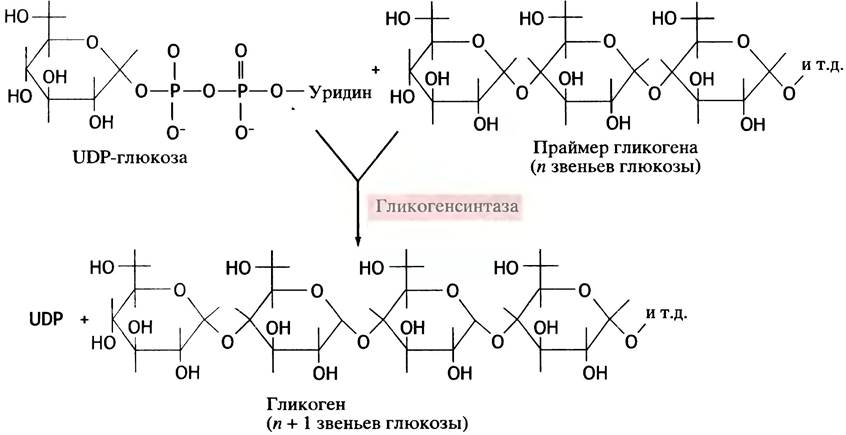
Рис. 6.3. Синтез гликогена из глюкозы
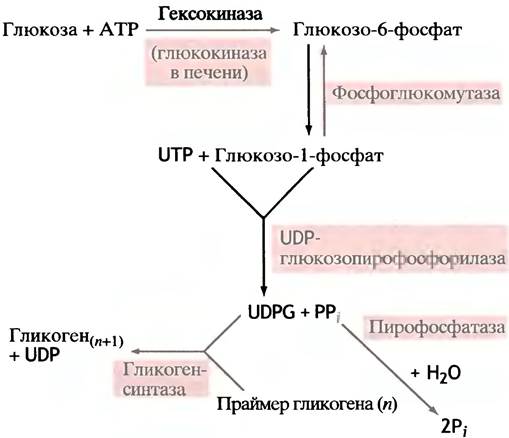
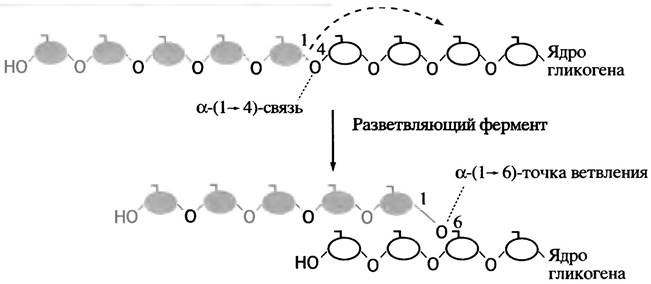
Эта схема не отражает полностью процесса синтеза гликогена, поскольку он должен представлять собой неопределенно длинную олигосахаридную цепь, наподобие той, которая встречается у амилозы - линейного компонента растительного крахмала. Между тем гликоген, так же, как и другой компонент крахмала - амилопектин, имеет разветвленную структуру. Такую структуру ему придает специальный фермент, который называют разветвляющим ферментом. Как только синтаза изготовила очередной линейный участок цепи длиной примерно в 11 глюкозных остатков, разветвляющий фермент переносит ее концевой фрагмент, содержащий в среднем 7 остатков глюкозы, на гидроксильную группу С-6-атома глюкозы этой или другой цепи (рис. 6.4). Энергия образования α-( 1 —> 6) связи примерно такая же, что и связи α-(1 —> 4). Следовательно, это - реакция простого переноса, не требующая затрат энергии. По мере синтеза в гликогене лавинообразно возрастает число концов цепей, являющихся как точками роста молекулы, так и местами ее последующей фрагментации.
Итак, после еды глюкоза из крови поступает в ткани и превращается в ходе рассмотренных реакций в гликоген.
Рис. 6.4. Действие разветвляющего фермента при синтезе гликогена
Как в печени образуется глюкоза?
Печень запасает глюкозу в виде гликогена не столько для своих собственных нужд, сколько для обеспечения постоянного поступления глюкозы к другим тканям, особенно к мозгу и эритроцитам. В перерывах между приемами пищи печень расщепляет накопленный в ней гликоген с такой скоростью, чтобы по возможности удержать на постоянном уровне концентрацию глюкозы в крови. Эта скорость обусловлена внешним сигналом, который определяется соотношением глюкагон/инсулин.
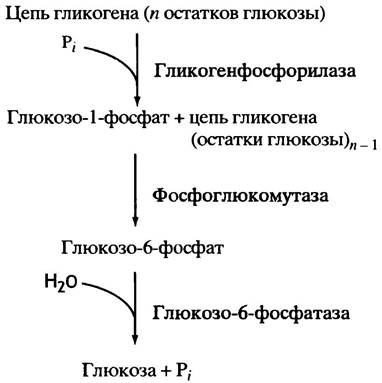
Так же, как и синтез, расщепление гликогена происходит с невосстанавливающего конца полисахаридных цепей. При этом гликозидная связь атакуется не водой, а фосфатным анионом; такого рода реакции по аналогии с гидролизом называют фосфоролизом. Соответственно и катализирующий эту реакцию фермент носит название гликогенфосфорилазы.
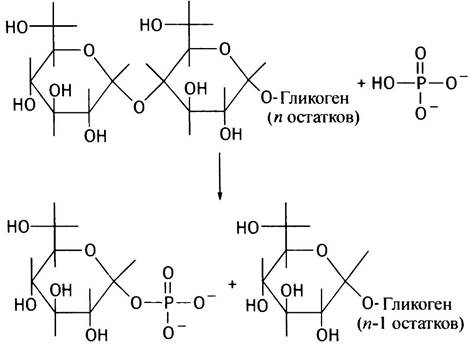
Образующийся при фосфоролизе глюкозо-1-фосфат далее изомеризуется фосфоглюкомутазой в глюкозо-6-фосфат (реакция, обратная описанной выше),
который гидролизуется до глюкозы, и последняя выделяется в кровь (такой гидролиз, катализируемый глюкозо- 6-фосфатазой, происходит только в печени и почках):
Глюкозо-1-фосфат <-> Глюкозо-6-фосфат
Глюкозо-6-фосфат + Н2O —> Глюкоза + Рi.
Общая схема образования глюкозы из гликогена представлена на рис. 6.5.
Рис. 6.5. Расщепление гликогена путем фосфоролиза, завершающееся высвобождением глюкозы в кровь
Глюкозо-6-фосфатаза локализована на мембране эндоплазматического ретикулума. Этот фермент примечателен тем, что его активный центр обращен не в цитоплазму, а в просвет ретикулума. Чтобы связаться с ним, глюкозо-6-фосфат с помощью особого транспортного белка пересекает мембрану и только после этого гидролизуется. В свою очередь, продукты гидролиза - глюкоза и фосфат - с помощью специальных транспортных систем возвращаются обратно в цитоплазму.
Точки ветвления в гликогене затрудняют работу фосфорилазы, видимо, из-за ее размера и особенностей строения активного центра. Она не может справиться со своей задачей, если конец цепи и точка ветвления разделены четырьмя или меньшим числом гликозидных остатков. Эта проблема преодолевается в два этапа. На первом этапе три концевых остатка переносятся под действием деветвящего фермента на гидроксильную группу С-4-концевого остатка другой короткой цепи, что удлиняет последнюю и тем самым делает ее доступной для фосфорилазы. Второй этап заключается в гидролитическом отщеплении оставшегося бокового α-( 1 —> 6)-гликозильного остатка (рис. 6.6). Примечательно, что оба эти процесса катализирует один и тот же белок - деветвящий фермент, который, следовательно, обладает двумя разными ферментативными активностями.
Рис. 6.6. Удаление разветвлений в молекуле гликогена
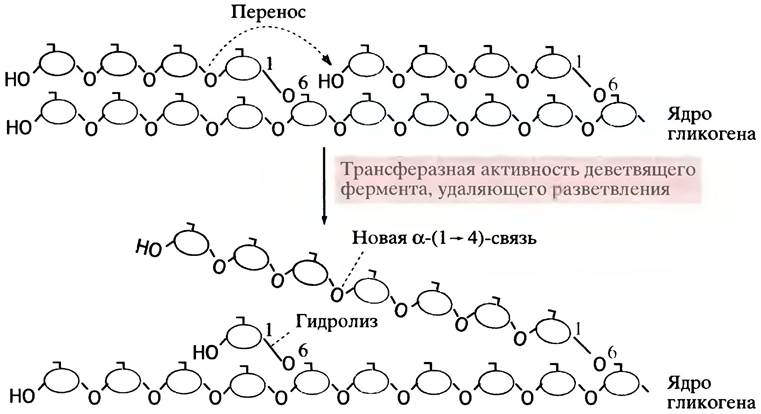
Рис. 6.7. Поглощение, хранение и высвобождение глюкозы в печени. Инсулин и глюкагон непосредственно не влияют на ферменты метаболизма гликогена
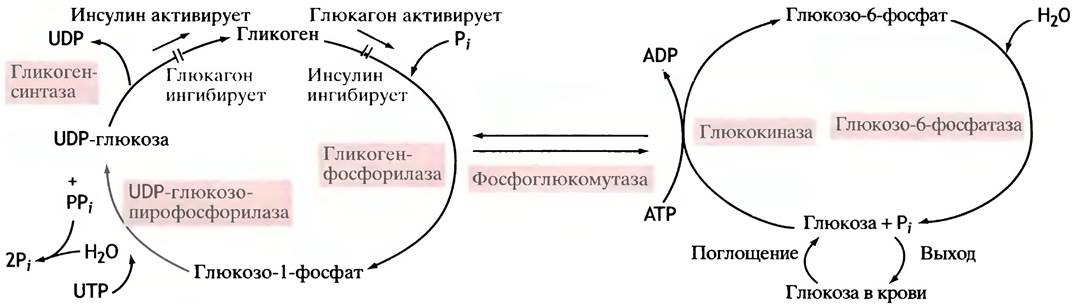
Общая схема поглощения, хранения и высвобождения глюкозы из печени показана на рис. 6.7.
Отметим некоторые принципиально важные особенности процессов, отображенных на этой схеме.
1. Синтез и распад гликогена проходят разными путями, а потому оба процесса могут регулироваться независимо друг от друга.
2. Только в печени и почках глюкозо-6-фосфат, образующийся из гликогена, превращается в глюкозу, которая далее высвобождается в кровь, становясь доступной другим тканям.
3. И в печени, и в других тканях глюкозо-6-фосфат служит субстратом окисления (см. главу 8).
4. Инсулин побуждает клетки накапливать гликоген, одновременно блокируя его распад. Глюкагон действует наоборот.
Таким образом, инсулин вызывает синтез гликогена, тогда как глюкагон стимулирует выход глюкозы из печени. Механизм действия этих гормонов будет рассматриваться в последующих главах, посвященных молекулярным сигналам, которые управляют жизнью клеток.
Почему в печени работает глюкокиназа, а в других тканях - гексокиназа?
Как только глюкоза поступает в клетку, она немедленно фосфорилируется в глюкозо-6-фосфат. Эту реакцию в печени катализирует глюкокиназа, а в мозгу и других тканях - гексокиназа. В условиях голода, когда поступление глюкозы в кровь становится первоочередной задачей, ее использование мышечными и другими клетками ограничено уровнем инсулина, тогда как потребление глюкозы мозгом, эритроцитами и печенью не зависит от инсулина. Это кажется нелогичным. Получается, что мышцы жертвуют своими белками ради того, чтобы печень из аминокислот синтезировала глюкозу для поддержания жизнеспособности клеток мозга, и в то же время сама печень конкурирует с мозгом за эту глюкозу. Этого, однако, не происходит! Дело в том, что глюкокиназа печени обладает значительно меньшим сродством к глюкозе по сравнению с гексокиназой мозга (рис. 6.8). Это означает, что в условиях голода печень поглощает гораздо меньше глюкозы, чем мозг, поскольку пассивный транспорт глюкозы в клетки определяется скоростью ее внутриклеточного фосфорилирования.
Рис. 6.8. Влияние концентрации глюкозы на активность гексокиназы (1) и глюкокиназы (2)
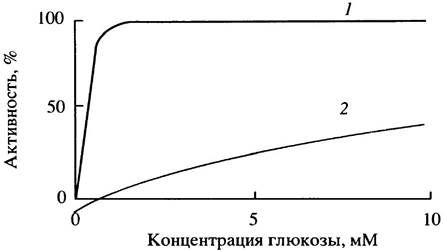
После еды, когда уровень глюкозы в крови высок, а инсулин побуждает печень синтезировать гликоген, глюкокиназа работает с максимально возможной скоростью. Есть еще одно различие между гексокиназой и глюкокиназой: последняя не ингибируется продуктом реакции - глюкозо-6-фосфатом. Благодаря этому синтез гликогена в печени может происходить при высоком внутриклеточном содержании глюкозо-6-фосфата. Кроме того, у транспортного белка, ответственною за поступление глюкозы в клетки печени, константа Михаэлиса (Км) выше, чем в других клетках. Аналогичная ситуация наблюдается в тех клетках поджелудочной железы, которые секретируют инсулин и координируют его секрецию с уровнем глюкозы в крови.
Что происходит с другими сахарами, поглощенными в тонком кишечнике?
При переваривании животными пищи в портальную вену из кишечника наряду с глюкозой поступает много других сахаров. К их числу относится галактоза, образующаяся из молочного сахара - лактозы, и фруктоза - продукт гидролиза другого пищевого дисахарида - сахарозы. Для энергообеспечения организма необходимо превратить галактозу и фруктозу либо в глюкозу, либо в продукты ее метаболизма в печени. Тогда эти сахара вместе с глюкозой в конечном итоге будут преобразованы в гликоген и жир либо же подвергнутся окислению до СO2 и Н2O.
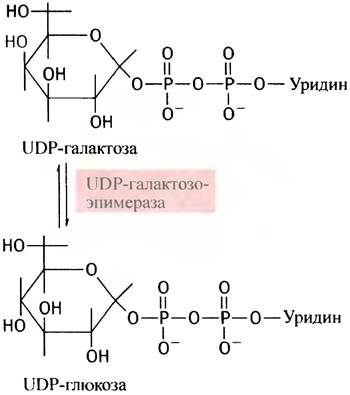
Чтобы превратить галактозу в глюкозу, необходимо изменить оптическую конфигурацию С-4-атома сахарного остатка (в химии этот процесс называют эпимеризацией).
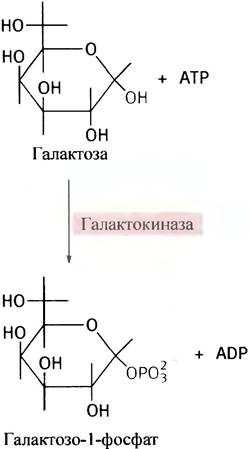
Эпимеризовать галактозу клетки не могут, но в них есть фермент эпимераза, который превращает UDР-галактозу в UDР-глюкозу. Последняя является промежуточным соединением при синтезе гликогена. Сначала галактоза фосфорилируется галактокиназой в галактозо-1-фосфат:
Теперь, казалось бы, галактозо-1-фосфат должен, по аналогии с глюкозо-1-фосфатом, вступить в реакцию с UТР. Однако вместо этого галактозо-1 -фосфат замещает глюкозо-1-фосфат в UDР-глюкозе, в результате чего и образуется UDР-галактоза:
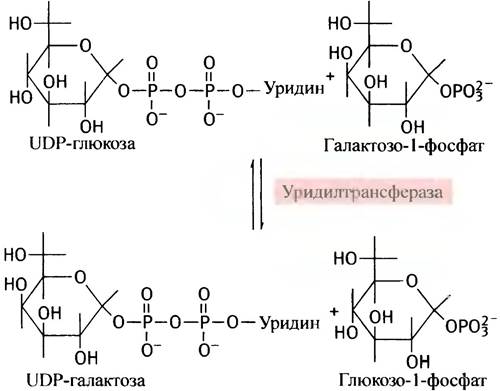
Поскольку эту реакцию можно рассматривать как перенос уридинфосфатного (уридильного) остатка с UDР-глюкозы, катализирующий ее фермент называют уридилтрансферазой. Лишь после образования UDР-галактозы происходит реакция эпимеризации.
Если все эти реакции собрать вместе, можно представить следующую схему превращений галактозы, конечным продуктом которых является глюкозо-1-фосфат (рис.6.9).
Рис. 6.9. Вхождение галактозы в главные метаболические пути посредством ее превращения в глюкозо-1-фосфат
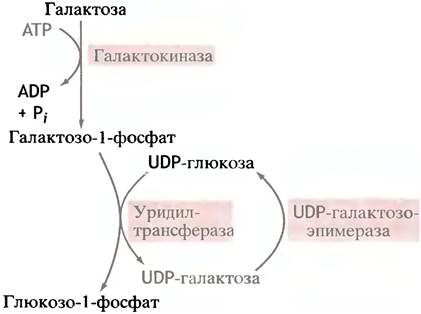
Известен генетический дефект, который проявляется у детей в форме заболевания, называемого галактоземией. У таких больных нет уридилтрансферазы, вследствие чего в организме накапливается галактоза и продукты ее метаболизма. Это приводит к нарушениям развития мозга и слепоте. Чтобы избежать столь тяжелых последствий, достаточно исключить галактозу из пищевых продуктов. Потребности организма таких больных в галактозе для синтеза собственных гликолипидов и гликопротеинов удовлетворяются благодаря тому, что эпимеризация UDР-галактозы в UDР-глюкозу обратима, а указанные синтетические процессы требуют, как раз UDР-галактозу в качестве донора галактозильных остатков.
Пути превращения аминокислот в организме (в рамках проблемы энергоснабжения)
Хотя для аминокислот не предусмотрено таких специализированных способов запасания, как для глюкозы и жира, тем не менее, и они участвуют в энергоснабжении. Особенно важна их роль при голодании: в этих условиях расщепляются мышечные белки, а образующиеся аминокислоты переносятся в печень и становятся там субстратами для синтеза глюкозы.
Пути превращения жиров и холестерина в организме
Следует пояснить, почему мы говорим о холестерине при анализе энергоснабжения, хотя он не вносит в него никакого вклада. Дело в том, что холестерин после пищеварения вместе с жирами транспортируется в составе липопротеинов. Отсюда и целесообразность совместного рассмотрения судьбы этих веществ.
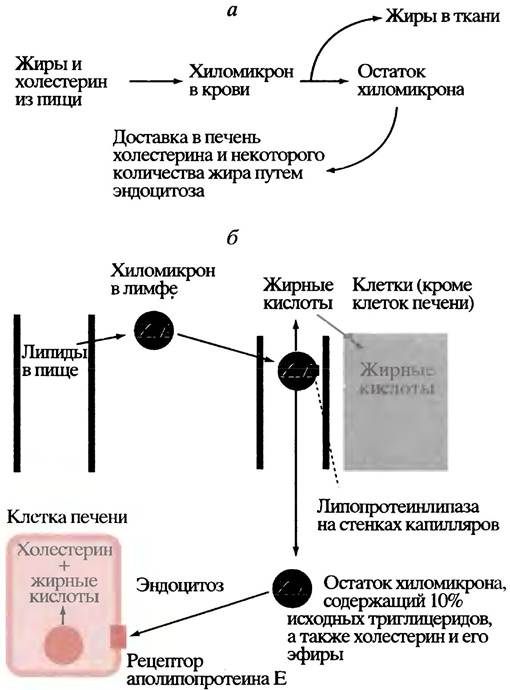
Поглощение жира клетками из хиломикронов
После приема жирной пищи кровь насыщается хиломикронами - частицами, оболочка которых образована фосфолипидами, холестерином и белками, а ядро состоит из нейтральных жиров (триглицеридов) и эфиров холестерина (см. рис. 4.5).
Триглицериды откладываются про запас в жировых клетках, в молочных железах млекопитающих (выделяются при секреции с молоком), а также в мышцах и других тканях, где используются для производства энергии.
В отличие от триглицеридов свободные жирные кислоты легко проходят через мембраны. Видимо, именно поэтому триглицериды в хиломикронах гидролизуются в кровотоке липазой, расположенной на поверхности клеток, выстилающих капилляры. Продуктами гидролиза являются жирные кислоты и глицерин, которые тут же поглощаются близлежащими клетками.
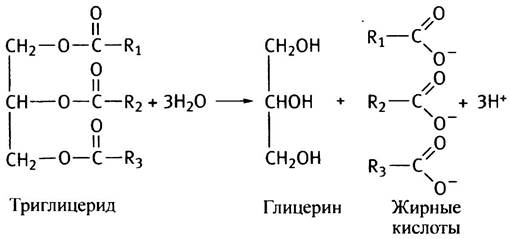
Количество жирных кислот, поступающих при этом из крови в ткань, определяется суммарной активностью липазы в пронизывающих ткань капиллярах. Эта активность особенно велика в жировой ткани и в молочных железах в период лактации. Содержание липазы зависит от физиологических потребностей организма. Оно, например, возрастает с увеличением соотношения инсулин/глюкагон. Поскольку хиломикрон можно рассматривать как липопротеин (комплекс липида с белком), липазу в капиллярах называют липопротеинлипазой, чтобы отличать ее от других липаз. Видимо, эта липаза может служить своего рода мостиком, временно скрепляющим хиломикрон с поверхностью клетки.
По мере удаления триглицеридов из хиломикронов последние уменьшаются в размерах и превращаются в так называемые остатки, содержащие исходные количества холестерина и его эфиров, а также около 10% исходного количества триглицеридов. Эти остатки поглощаются печенью в ходе рецептор-опосредованного эндоцитоза (рис. 6.10) и заканчивают свое существование внутри печеночных клеток, доставляя туда триглицериды и холестерин. Полностью судьба хиломикронов отражена на рис. 6.11.
Рис. 6.10. Поглощение остатка хиломикрона клеткой печени путем эндоцитоза, управляемого рецептором, который специфичен к аполипопротеину Е в хиломикроне
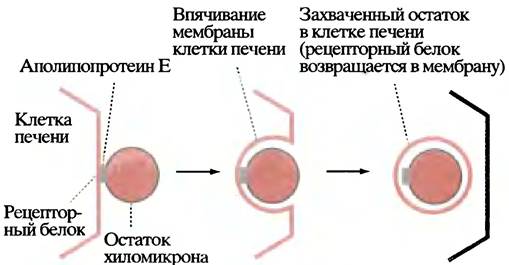
Рис. 6.11. Транспорт жира и холестерина с помощью хиломикронов (ХМ): а - Общее изображение; б - детальное изображение
Судьба жиров и холестерина
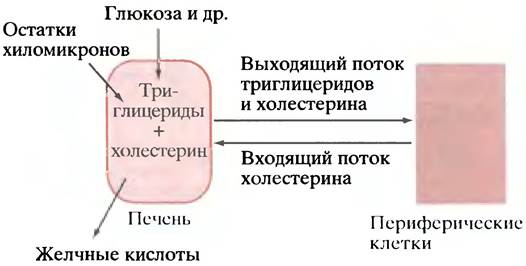
Кроме хиломикронов, переносящих жир и холестерин непосредственно из кишечника, существенный вклад в транспорт этих веществ вносят липопротеины, в виде которых жир и холестерин поступают в кровь из печени. Печень сама способна синтезировать триглицериды из глюкозы и других метаболитов, а некоторое количество триглицеридов она получает извне вместе с остатками хиломикронов. Тем не менее печень никак нельзя рассматривать как место хранения липидов (ожирение печени - патология). Триглицериды экспортируются из печени в другие ткани в виде так называемых липопротеинов очень низкой плотности (ЛПОНП), которые по своему строению напоминают хиломикроны. В результате именно печень оказывается главным поставщиком жиров, снабжающим основных потребителей: мышцы, где жиры окисляются, и жировые клетки, где происходит их запасание.
Печень не только собирает холестерин пищи, поступающий в нее в составе остатков хиломикронов, но является основным местом синтеза холестерина в организме. Из печени холестерин вместе с триглицеридами разносится по всему телу в составе ЛПОНП. Вместе с тем существует и встречный поток холестерина из периферических тканей в печень (рис. 6.12). Смысл такого встречного движения пока не вполне ясен, тем более что большинство клеток сами способны синтезировать холестерин. Одно из возможных объяснений заключается в том, что таким образом достигается наиболее гибкая регуляция общего содержания холестерина в организме, поскольку печень способна удалить его избыток в виде желчных кислот. Другая гипотеза предполагает, что выход холестерина из печени - необходимое следствие «секреции» триглицеридов, поскольку холестерин является непременным компонентом переносящих их ЛПОНП. Согласно этой гипотезе, встречный поток холестерина в печень есть не что иное, как способ замкнуть транспортный цикл, вернув переносчик (холестерин) назад. Решение этой проблемы имеет важное значение для медицины, ибо оно тесно связано с пониманием природы атеросклероза.
Рис. 6.12. Движение триглицеридов и холестерина в печень и из печени (схематично). В печени эти вещества синтезируются из метаболитов и включаются в составе остатков хиломикронов. Там же холестерин превращается в желчные кислоты
Использование холестерина в организме
Холестерин - важный компонент плазматической мембраны животных клеток. В то же время его избыток в организме служит причиной сердечно-сосудистых заболеваний. Вот почему важное значение имеют механизмы выведения холестерина из организма.
Главным из этих механизмов является переработка холестерина в желчные кислоты в печени. Таким способом у человека выделяется примерно около 0,5 г холестерина за сутки. Из печени желчные кислоты в составе желчи поступают в тонкий кишечник, затем всасываются его стенками вместе с жиром. Поэтому одна из терапевтических задач - снижение содержания холестерина - заключается в подавлении обратного всасывания желчных кислот. Это достигается введением в пищу веществ, образующих в кишечнике прочные комплексы с желчными кислотами, которые не могут быть поглощены эпителиальными клетками. Другой, более современный подход состоит в регуляции синтеза желчных кислот. В надпочечниках и в половых органах из холестерина синтезируются не только желчные кислоты, но и стероидные гормоны. В форме эфиров холестерин хранится в клетках и в составе липопротеинов транспортируется в организме.
Липопротеины, участвующие в транспорте жира и холестерина
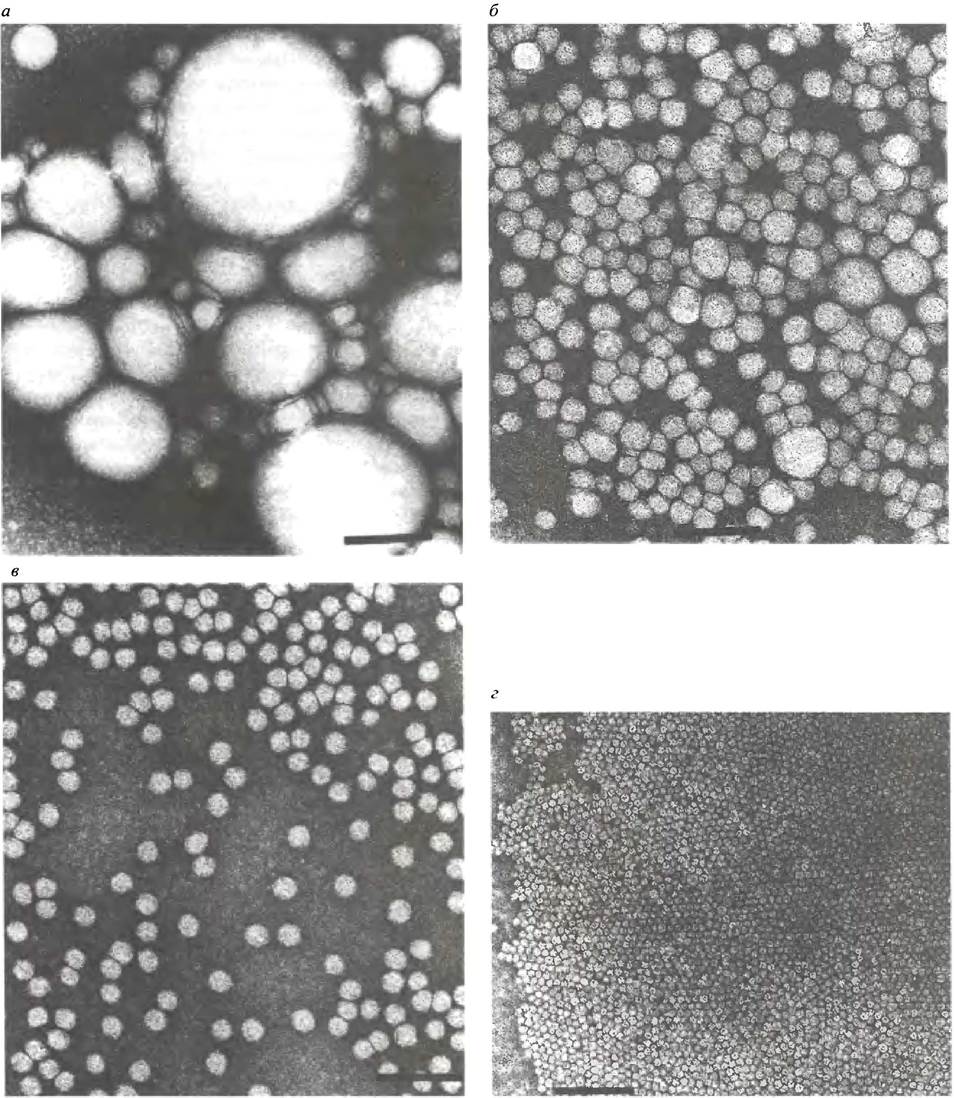
Печень производит липопротеины двух типов: ЛПОНП и ЛПВП (липопротеины высокой плотности). В этом процессе принимают участие эндоплазматический ретикулум и аппарат Гольджи, где липопротеины упаковываются в покрытые мембраной пузырьки, которые выводятся с помощью экзоцитоза. У крыс около 80% липопротеинов (не хиломикронов) образуется в печени, а остальная часть - в клетках кишечника. Далее мы коснемся превращения ЛПОНП в ЛППП (липопротеины промежуточной плотности) и ЛПНП (липопротеины низкой плотности). Так что вместе с хиломикронами речь идет о пяти типах липопротеинов. Электронные микрофотографии некоторых из них представлены на рис. 6.13.
Рис. 6.13. Электронные микрофотографии хиломикронов и липопротеинов: а - Хиломикроны; б - липопротеины очень низкой плотности; в - липопротеины низкой плотности; г - липопротеины высокой плотности. Масштаб, указанный жирной чертой на каждой фотографии, соответствует 100 нм. Фотографии предоставлены доктором Т. Forte (Lawrence Berkeley Laboratory, University of California)
Аполипопротеины
Каждому из пяти липопротеинов отвечает свой набор аполипопротеинов, т. е. входящих в их состав чисто белковых компонентов. Известно более двенадцати таких белков. Функция каждого из них точно не определена, но в целом роль этих белков сводится к следующему.
1. Некоторые аполипопротеины необходимы для образования липопротеинов. Таковы белки ароВ48 в хиломикронах и ароВ100 в ЛПОНП.
2. Другие апобелки отвечают за распознавание липопротеина рецепторами на поверхности клеток-мишеней. Такое распознавание, в свою очередь, является сигналом к запуску эндоцитоза (см. рис. 6.10). Избирательное распознавание позволяет отдельным липопротеинам связываться только с предназначенными для них клетками. Примерами адресных аполипопротеинов могут служить ароВ100 в ЛПНП, который связывается с ЛПНП- рецепторами, и ароЕ, позволяющий клеткам печени распознавать остатки хиломикронов.
3. Часть аполипопротеинов служит активаторами ферментов. Так, ароСII в хиломикронах активирует липопротеинлипазу, которая отщепляет жирные кислоты от триглицеридов. Не все апобелки изначально присутствуют в липопротеинах. Некоторые включаются в них в процессе внеклеточного транспорта. Тот же ароСII синтезируется в печени, но встраивается в хиломикроны уже после их образования.
Механизм транспорта триглицеридов и холестерина из печени к другим тканям и обратный перенос холестерина в печень
Начнем с выхода из печени триглицеридов и холестерина в составе ЛПОНП. У больных с нарушениями синтеза ЛПОНП происходит накопление триглицеридов в печени.
Как только ЛПОНП попадают в кровоток, они постепенно теряют триглицериды благодаря действию липопротеинлипазы. При этом в них возрастает относительное содержание холестерина и его эфиров (табл. 6.1), увеличивается их плотность и уменьшаются линейные размеры. В результате ЛПОНП превращаются сначала в ЛППП, а затем в ЛПНП. Именно ЛПНП распознаются рецепторами клеток периферических тканей и далее поглощаются ими путем эндоцитоза, снабжая эти клетки остатками триглицеридов и холестерином. Интенсивность такого поглощения регулируется изменением числа рецепторов на поверхности клеток-мишеней.
Таблица 6.1. Содержание (в % от сухой массы) триглицеридов и холестерина в различных липопротеинах
Показатель |
Хиламикроны |
ЛПОНП |
ЛППП |
ЛПНП |
ЛПВП |
Триглицериды |
80 |
50 |
30 |
10 |
8 |
Холестерин и его эфиры |
8 |
20 |
30 |
50 |
30 |
Выход холестерина из печени компенсируется его встречным потоком из периферических тканей. Это происходит благодаря ЛПВП. Они образуются в основном в печени и представляют собой дископодобную структуру, состоящую из апобелков, фосфолипидов и относительно малого количества триглицеридов и холестерина. В периферических тканях ЛПВП обогащаются холестерином, предположительно благодаря диффузии последнего из плазматических мембран в прикрепившийся к ним липопротеин. Исходно гидроксильные группы молекул холестерина экспонированы в водное окружение ЛПВП и доступны для этерификации. Преобразование амфипатического холестерина в полностью гидрофобные эфиры сопровождается изменением формы ЛПВП: из диска он превращается в сферу.
Внутри клеток для этерификации холестерина (CHOL) требуется энергия АТР, в отличие от внеклеточной этерификации; поэтому для этерификации холестерина в ЛПВП используется другая стратегия. Особый фермент лецитин-холестерин-ацилтрансфераза (ЛХАТ) катализирует перенос остатков жирных кислот с лецитина, присутствующего в ЛПВП, на холестерин.
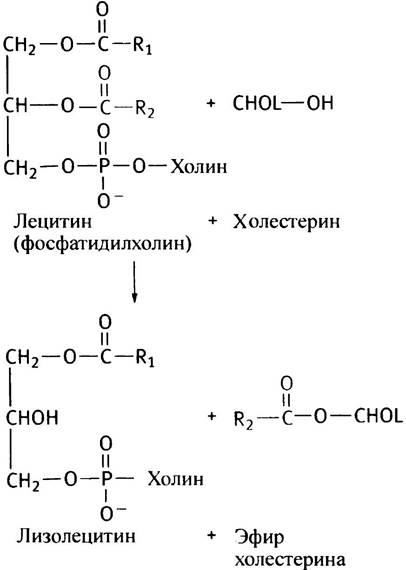
Эта реакция не требует внешнего источника энергии, поскольку исходный и образующийся сложные эфиры энергетически почти эквивалентны.
Эфиры холестерина, заключенные в ЛПВП, переносятся на хиломикроны, ЛПОНП, ЛППП и ЛПНП с помощью особого белка-переносчика (белок-переносчик эфировхолестерина). Хотя главная функция ЛППП и ЛПНП состоит в транспорте их содержимого в периферические ткани, некоторая доля возвращается в клетки печени. Таким образом, механизм встречного потока холестерина может быть описан в виде нескольких стадий.
1. Холестерин переносится из мембран периферических клеток в ЛПВП.
2. Холестерин ЛПВП этерифицируется; образующиеся при этом эфиры мигрируют с периферии липопротеина к центру.
3. Эфиры холестерина переносятся из ЛПВП в хиломикроны, ЛПОНП, ЛППП и ЛПНП.
4. Некоторая доля ЛППП и ЛПНП (а после еды - и хиломикронов) передает эфиры холестерина клеткам печени, обусловливая перенос холестерина из периферических клеток в печень (рис. 6.14).
Рис. 6.14. Роль липопротеинов в переносе холестерина в печень и из печени. Жирными линиями показано перемещение эфиров холестерина между липопротеинами. Все его этапы обратимы, а сам рисунок упрощен
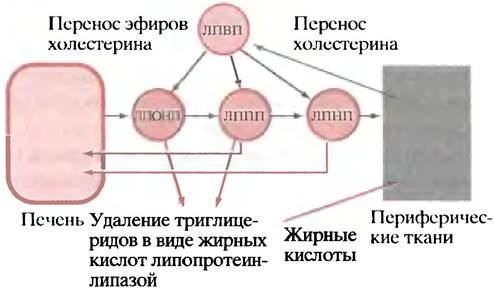
В действительности все обстоит гораздо сложнее, поскольку параллельно с описанными здесь процессами осуществляется обмен между разными липопротеинами, триглицеридами и эфирами холестерина, обмен триглицеридов на эфиры холестерина и т. п. Все эти явления в деталях пока не изучены.
Медики рассматривают ЛПНП как «плохой холестерин», потому что избыток холестерина в организме, повышающий вероятность атеросклероза, коррелирует с долей липопротеинов этого типа. Атеросклероз проявляется в образовании специфических бляшек внутри кровеносных сосудов, в значительной степени состоящих из холестерина. Такие бляшки закупоривают сосуды. В коронарных сосудах это приводит к сердечным приступам. Известен генетический дефект, при котором в клетках мало рецепторов ЛПНП. В результате ослабляется «откачка» содержащих холестерин ЛПНП из крови, вследствие чего в ней увеличивается уровень ЛПНП-связанного холестерина. Это заболевание, называемое семейной гиперхолестеринемией, сопровождается поражениями сердечно-сосудистой системы. Напротив, ЛПВП врачи называют «хорошим холестерином», поскольку высокое содержание ЛПВП связано с уменьшением риска заболеть атеросклерозом. Благодаря ЛПВП ускоряется поток холестерина в печень, однако механизм их защитного действия до конца еще не ясен. Возможно (хотя это и не доказано), что ЛПВП способны остановить развитие атеросклероза, извлекая холестерин из атеросклеротических бляшек в кровеносных сосудах.
Как жиры покидают жировые клетки?
Липаза высвобождает свободные жирные кислоты, хранящиеся в виде нейтральных жиров. Однако липаза, функционирующая внутри жировых клеток, принципиально отличается от липазы кровяных капилляров. Это отличие состоит в том, что внутриклеточная липаза регулируется гормонами: ее активирует глюкагон и ингибирует инсулин (см. главу 12). После еды, когда инсулина много, а глюкагона мало, жировые клетки поглощают глюкозу из плазмы крови и жирные кислоты из хиломикронов, превращая их в триглицериды; гидролиз последних заторможен. При голоде ситуация противоположная: образуются жирные кислоты, которые затем выходят из жировых клеток в кровь и доставляются к другим тканям. При юношеском диабете, когда у больных очень низкое соотношение инсулин/глюкагон, гормон-чувствительная липаза обеспечивает поступление в кровь большого количества жирных кислот, которые улавливаются печенью и перерабатываются ею в кетоновые тела, что приводит к сильной кетонемии(избыток кетоновых тел в крови) - дополнительному тяжелому осложнению сахарного диабета.
Гормон-чувствительную липазу активирует не только глюкагон, но и адреналин. После «адреналинового» сигнала жировые клетки выбрасывают жирные кислоты, которые доставляются мышцам и позволяют им развить максимальную активность (см. главу 12). Жировые клетки иннервированы симпатическими нервными
волокнами, окончания которых при возбуждении секретируют норадреналин. Этот нейромедиатор также активирует гормон-чувствительную липазу.
Как жирные кислоты переносятся кровью?
Если бы жирные кислоты присутствовали в крови в свободном виде, она была бы похожа на мыльный раствор, потому что в нейтральной среде эти кислоты полностью диссоциированы. В действительности жирные кислоты в крови адсорбированы на поверхности белка - сывороточного альбумина (СА). На его молекуле имеются гидрофобные участки, к которым прилипают различные гидрофобные молекулы. Образующиеся нековалентные комплексы не слишком прочны, что делает связывание обратимым.
Вопросы к главе 6
1. Объясните, как достигается термодинамическая необратимость синтеза гликогена из глюкозо-1 -фосфата.
2. Как вы истолкуете название UDP-глюкозопирофос- форилаза?
3. Какие ткани способны выделять в кровь глюкозу, образующуюся при расщеплении гликогена, и почему?
4. Какую реакцию катализируют ферменты глюкокиназа и гексокиназа? Почему печень содержит глюкокиназу, а мозг и другие ткани - гексокиназу?
5. Детскую галактоземию предотвращают диетой, лишенной галактозы. Это возможно благодаря UDP-галактозоэпимеразе. Почему?
6. Как триглицериды покидают хиломикроны и усваиваются тканями?
7. Что такое ЛПОНП и для чего они нужны?
8. Что имеется в виду под встречным переносом холестерина?
9. Каким образом большая часть холестерина выводится из организма?
10. Этерификация холестерина - эндоэргоническая реакция. Каким образом тогда в ЛПВП холестерин этерифицируется без участия АТР?
11. Как и при каких условиях жировые клетки освобождаются от жира?