БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 10. ПЕРЕХОД ОТ КАТАБОЛИЗМА К АНАБОЛИЗМУ. СИНТЕЗ В ОРГАНИЗМЕ ЖИРОВ И РОДСТВЕННЫХ ИМ СОЕДИНЕНИЙ
В предыдущих главах, посвященных метаболизму, речь шла о катаболических реакциях, в ходе которых происходит расщепление жиров и углеводов. Другая задача метаболизма - синтез молекул, или анаболизм. Начать изучение анаболизма лучше всего с синтеза жиров.
Синтез жиров осуществляется главным образом из углеводов, поступающих в избыточном количестве и не используемых для пополнения запаса гликогена. Кроме того, в синтезе участвуют и некоторые аминокислоты. Накоплению жиров способствует и избыток пищи. Жир - наиболее компактная форма запасания энергии организмом. Нам пришлось бы сильно увеличить свои размеры, если бы мы запасали энергию исключительно в виде гликогена.
Механизм синтеза жиров
Общие принципы
В процессе метаболизма жирные кислоты превращаются в ацетил-СоА. В свою очередь, и ацетил-СоА превращается снова в жирные кислоты (тот факт, что жирные кислоты синтезируются из ацетил-СоА - двухуглеродного соединения, приводит к тому, что число углеродных атомов в природных жирных кислотах почти всегда четное). Избыточное поглощение углеводов сопровождается отложением жиров, так как глюкоза расщепляется до пирувата, который превращается в ацетил-СоА. Эта последняя реакция, катализируемая пируватдегидрогеназой, необратима. Поэтому в животных клетках ацетил-СоА не может превращаться в пируват и, соответственно, жиры не могут превращаться в глюкозу, в отличие от бактерий и растений, осуществляющих подобные превращения.
Любой метаболический путь включает по меньшей мере одну стадию, которая в прямом и обратном направлениях реализуется разными биохимическими реакциями. Это справедливо для расщепления и синтеза жиров. Соответствующие им метаболические пути местами совпадают, а местами - нет. Благодаря этому оба процесса термодинамически выгодны, необратимы и регулируются по-разному.
Чтобы синтез жирных кислот из ацетил-СоА стал термодинамически выгодным, он должен включать необратимую стадию, для которой требуется дополнительная
энергия. Уже на первом этапе синтеза жирных кислот - образовании малонил-СоА из ацетил-СоА и СО2 - используется энергия гидролиза АТР. Позже молекула жирной кислоты теряет СО2.
Это выглядит, на первый взгляд, бессмысленно, однако таким путем превращению придается термодинамическая необратимость; решается не столько химическая, сколько энергетическая проблема. Малоновая кислота имеет структуру НООС-СН2-СООН, а малонил-СоА - HOOC-CH2-CO-S-CoA. Приведенную ниже реакцию катализирует ацетил-СоА-карбоксилаза:
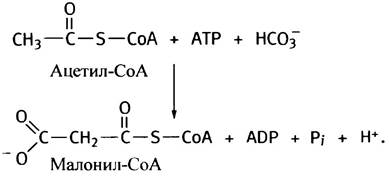
Простетической группой этого фермента является биотин. Как вы уже знаете, все карбоксилазы используют энергию гидролиза АТР для введения в субстраты СО2. В качестве промежуточного продукта в этой реакции образуется «активированный СО2» - карбоксибиотин (см. с. 123).
Таким образом, чтобы синтезировать жирные кислоты, нужно последовательно присоединять к ацетил-СоА двухуглеродные единицы. Активным донором таких единиц является малонил-СоА, хотя малонильный остаток сам по себе содержит не два, а три С-атома. Но прежде чем остановиться на синтезе жирных кислот подробнее, нужно пояснить, что такое ацилпереносящий белок, или АПБ.
Ацилпереносящий белок и β-кетоацил-синтаза
Все катаболические превращения происходят не с самими жирными кислотами, а с тиоэфирами, которые они образуют с СоА. Во всех реакциях синтеза жирных кислот также участвуют тиоэфиры, но не СоА, а более простой молекулы, которую можно рассматривать как половину СоА. Напоминаем, как выглядит структура СоА.
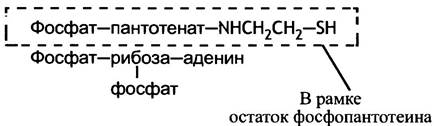
Выделенная часть молекулы и есть тиолсодержащий «носитель» - 4-фосфопантотеин, который используется при синтезе жирных кислот. В отличие от ацетил-СоА, он функционирует не в свободном виде, а будучи связанным с АПБ. Можно рассматривать АПБ как белок, встроенный в СоА, или наоборот, как гигантскую молекулу СоА, в которой АМР-фрагмент заменен белком.
Другой фермент, или точнее, функциональный домен - β-кетоацил-синтаза, также содержит реакционноспособную тиольную группу. Она принадлежит остатку цистеина, который входит в активный центр фермента. И АПБ, и β-кетоацил-синтаза у млекопитающих являются компонентами большого мультифункционального комплекса.
Механизм синтеза СоА-производных жирных кислот
Рассмотрим случай, когда обе тиольные группы в СоА-синтазном комплексе свободны (рис. 10.1, а).
Рис. 10.1. Синтез жирных кислот. Хотя β-кетоацил-синтаза у животных является одним из доменов большой белковой молекулы, здесь мы изображаем ее как отдельный белок. После семи успешных оборотов цикла образуется пальмитил-АПБ, который гидролизуется с образованием свободного пальмитата
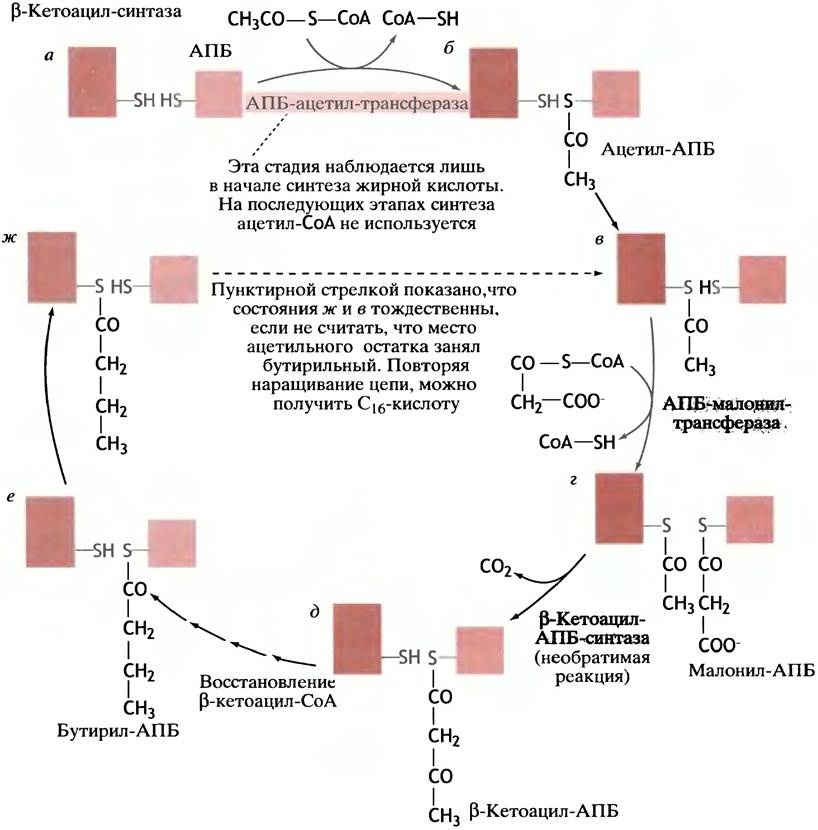
Ацетильная группа (СН3СО-) переносится с ацетил-СоА на тиольную группу АПБ специальной трансферазой (рис. 10.1,6). Далее она передается на тиольную группу ß-кетоацил-синтазы, в результате чего место ее посадки в АПБ снова становится вакантным (рис. 10.1, в). Его занимает малонильный остаток, перенесенный другой трансферазой с малонил-СоА; образуется малонил-АПБ (рис. 10.1, г). После этого синтаза катализирует реакцию переноса ацетильной группы на малонильную группу, что приводит к образованию β-кетоацил-АПБ и СО2 В данном случае речь идет о β-кетобутирил-АПБ (рис. 10.1,6). Последний, оставаясь в составе белкового комплекса, восстанавливается в бутирил-АПБ (рис. 10.1, е). В конечном итоге система переходит в состояние (рис. 10.1, ж), аналогичное изображенному на рис. 10.1, в: тиольная группа АПБ свободна, а в синтазе она ацилирована остатком насыщенной жирной кислоты. Единственное различие состоит в том, что место ацетильного остатка (см. рис. 10.1, в) теперь занимает бутирильный (см. рис. 10.1, ж). Если все описанные выше реакции пройдут еще раз, бутирильный остаток превратится в гексаноильный. Еще пять оборотов цикла приведут к образованию пальмитоил-АПБ; затем под действием фермента гидролазы происходит высвобождение в раствор пальмитиновой кислоты (С16):
СН3(СН2)14СО-S-АПБ + Н2О —> СН3(СН2)14СОО- + АПБ-SH.
Реакция, катализируемая β-кетоацил-АПБ-синтазой, необратима, так как имеет место процесс декарбоксилирования. Благодаря этой стадии весь путь синтеза жирных кислот становится подобен дороге с односторонним движением.
Если требуется синтезировать жирную кислоту, содержащую более 16 углеродных атомов, например, стеариновую (С18), удлинением цепи пальмитиновой кислоты будут заниматься другие ферментные системы.
Организация процесса синтеза жирных кислот
Описанная последовательность реакций кому-то покажется простой, а кому-то сложной, но несомненно одно: этот свойственный животным ансамбль ферментов организован удивительно. В клетках Е. coli ту же последовательность реакций катализируют отдельные ферменты, так что после каждой реакции продукты диссоциируют в раствор и диффундируют к следующему ферменту. У животных все стадии синтеза жирных кислот, следующие за образованием малонил-СоА, реализуются
внутри одного гигантского белкового комплекса, состоящего из нескольких субъединиц. Каждая из них обладает ферментативной активностью, но функционирует обычно только в составе комплекса (на самом деле два таких мультифермента объединены в димер). Растущий жирнокислотный остаток поочередно связывается с тиольными группами АПБ и β-кетоацил-синтазы, ни разу не покидая комплекс, пока синтез не завершится образованием пальмитата. И удлинение цепи, и восстановление кетогрупп происходит, когда субстраты связаны с АПБ. Длинная гибкая ножка 4-фосфопантотеина, вероятно, нужна, чтобы позволить различным промежуточным соединениям взаимодействовать с нужными каталитическими центрами мультиферментного комплекса. Такая организация ускоряет синтез, так как позволяет избежать многократной диссоциации и диффузии продукта и способствует его связыванию с другим ферментом.
Стадии восстановления в ходе синтеза жирных кислот
В последовательности событий, приводящих к удлинению жирнокислотной цепи, присоединенной к АПБ, важное место занимает восстановление β-кетоацильных остатков, которое проходит в три стадии (рис. 10.2).
Рис. 10.2. Восстановительные стадии синтеза жирных кислот
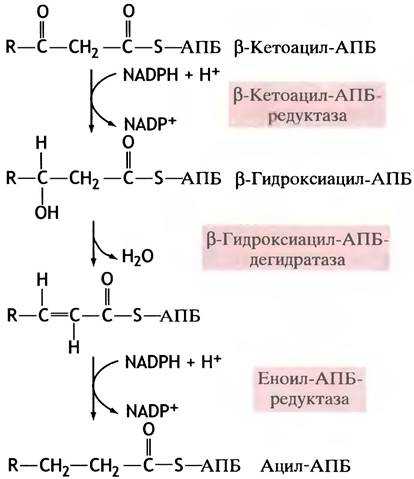
Восстановителем здесь служит NАDРН (не NADH!) - переносчик электронов.
Что такое NADP+?

Дополнительная фосфатная группа в молекуле NАDРН присоединена к 2'-гидроксильной группе рибозы, связанной с аденином:
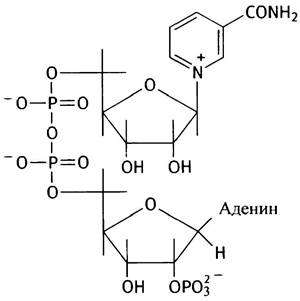
Эта фосфатная группа практически не сказывается на редокс-потенциале молекулы и фактически используется в качестве сигнала при идентификации и распознавании этой молекулы белками. NАD+-ферменты не реагируют с NАDР+ и наоборот (за редкими исключениями).
Долгое время думали, что использование NАDРН в процессе синтеза жирных кислот - не более чем прихоть природы, своего рода курьез. Однако постепенно стало ясно, что параллельное существование двух пиридиновых коферментов играет важную роль при разделении путей метаболизма. Чтобы в этом разобраться, необходимо вспомнить, что производство энергии можно представить, как окисление восстановительных эквивалентов, а синтез жира - как потребление восстановительных эквивалентов. Цели диаметрально противоположные! Клетка разделяет эти задачи, не разводя их в пространстве: окислительные ветви метаболизма используют NAD+ в качестве переносчика электронов, а восстановительные ветви метаболизма для этих целей используют NАDР+. По-разному протекает восстановление этих химически сходных соединений. NAD+восстанавливается в ходе гликолиза, в пируватдегидрогеназной реакции, в цикле лимонной кислоты, при окислении жира. А как восстанавливается NADP+? Об этом - в следующем разделе.
Где синтезируются жирные кислоты?
Основным местом синтеза жирных кислот является печень и в меньшей степени жировые клетки, хотя жиры образуют и многие другие органы, например, молочные железы в период лактации.
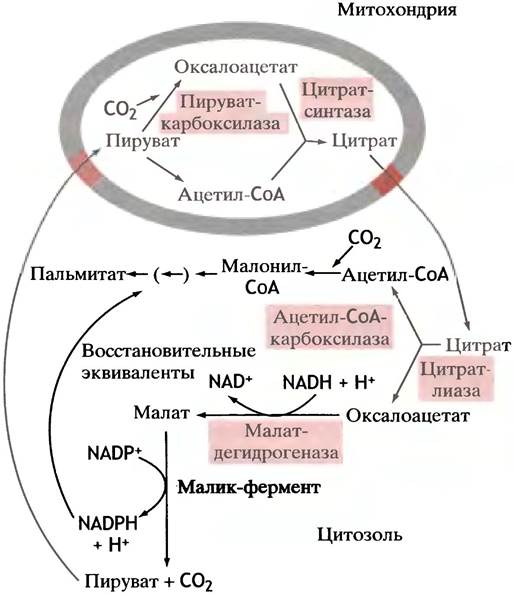
Внутри клетки синтез пальмитата из ацетил-СоА сосредоточен в цитозоле, в то время как окисляются жирные кислоты в митохондриях. Главным источником ацетил-СоА для синтеза жирных кислот служит пируватдегидрогеназная реакция, протекающая в митохондриальном матриксе (см. с. 116). Ацетил-СоА не может самостоятельно пройти через митохондриальную мембрану, поэтому должен существовать механизм переноса ацетильных остатков из митохондрий в цитозоль, к месту синтеза жирных кислот. В митохондриях ацетил-СоА превращается в цитрат (см. с. 119), который переносится из митохондрий в цитозоль особой транспортной системой. В цитозоле цитрат расщепляется ферментом цитратлиазой на ацетил-СоА и оксалоацетат. Эта реакция сопряжена с гидролизом АТР, благодаря чему практически необратима:
Цитрат + ATP + СоА-SH + Н2О —> Ацетил-СоА + Оксалоацетат +ADP+ Pi.
Оксалоацетат не может вернуться в митохондрию сам, так как митохондриальная мембрана для него непроницаема, а переносчиков не существует. Он восстанавливается в малат посредством NADH (заметим, не NADPH!). Малат же подвергается окислительному декарбоксилированию в пируват с помощью особого «малик»-фермента, использующего в качестве кофермента NADP+ (не NAD+). Образующийся NADPH участвует в синтезе жирных кислот (рис. 10.3).
Рис. 10.3. Восстановление NАDР+ для синтеза жирных кислот. Суммарный эффект обеих реакций состоит в переносе восстановительных эквивалентов с NАDН на NАDР+. Образующийся в цитоплазме пируват поступает в митохондрии. Источник оксалоацетата представлен на рис. 10.4
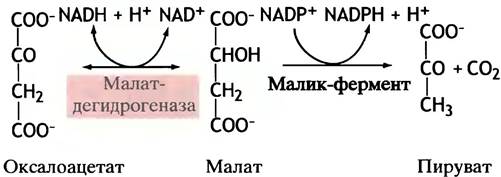
Рис. 10.4. Изображение, объясняющее происхождение ацетильных групп (ацетил-СоА) и восстановительных эквивалентов (NADPH + Н+), необходимых для синтеза жирных кислот. Действие цитратлиазы сопряжено с расщеплением АТР до ADP и Рi
Пируват может теперь транспортироваться назад в митохондрии, где он снова превращается в оксалоацетат с помощью пируваткарбоксилазы (см. с. 120):
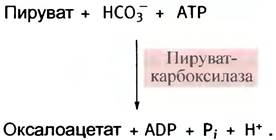
Реально цитрат покидает митохондрии лишь тогда, когда его концентрация в матриксе достаточно высока. Так бывает при избытке углеводов, в противном случае он не поступает в цитозоль.
Таким образом, цитратный механизм не только выводит ацетильные группы из митохондрий, но и обеспечивает образование NАDРН, который используется при
синтезе жирных кислот. Восстановление в цитоплазме оксалоацетата в малат с помощью NADH и окисление малата в пируват посредством NADP+ в совокупности представляют собой изящный механизм переноса электронов из фонда NADH в фонд NADPH, используемый в реакциях «восстановительного» синтеза. In vitro цитрат способен активировать начальную реакцию синтеза жиров, катализируемую ацетил-СоА-карбоксилазой, в результате которой образуется малонил-СоА. Однако физиологическое значение такой активации пока остается неопределенным. Регуляция активности этого фермента обсуждается в главе 12.
Из приведенной схемы видно, что на каждую молекулу ацетил-СоА, образующуюся в цитозоле из цитрата, приходится одна молекула NADPH. Однако каждый цикл работы синтазы жирных кислот требует две молекулы NADPH (см. рис. 10.2). Процесс, восполняющий недостаток NADPH, будет описан в главе 13, так как он относится к другой ветви метаболизма - превращениям пентозофосфатов.
Синтез ненасыщенных жирных кислот
Ненасыщенные жирные кислоты нужны организму как для синтеза полярных липидов, входящих в состав мембран, так и для некоторых других целей. В печени есть специальная ферментная система, которая может внедрить одну двойную связь в середину цепи стеариновой кислоты, превращая ее в олеиновую кислоту.
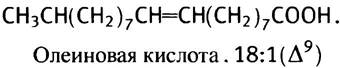
Однако эта ферментная система не может образовать еще одну двойную связь между центральной двойной связью и метильным концом молекулы. Поэтому ее нельзя использовать для синтеза в животном организме линолевой кислоты с двумя двойными связями и линоленовой кислоты с тремя двойными связями.
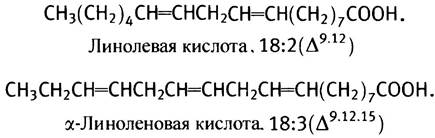
Поскольку эти кислоты необходимы для синтеза мембранных липидов и эйкозаноидов, их единственным источником служит пища (у растений есть ферменты, синтезирующие полиненасыщенные жирные кислоты с двойной связью в концевой части молекулы). В печени же могут происходить дальнейшее удлинение линолевой кислоты и образование в ней дополнительных двойных связей. Таким способом синтезируется арахидоновая С20-кислота (20:4, ∆5,8,11,14) с четырьмя двойными связями, а также С22- и С24-кислоты, входящие в состав липидов нервных тканей. Все эти превращения совершаются с ацильными производными СоА.
Синтез триглицеридов и мембранных липидов из жирных кислот
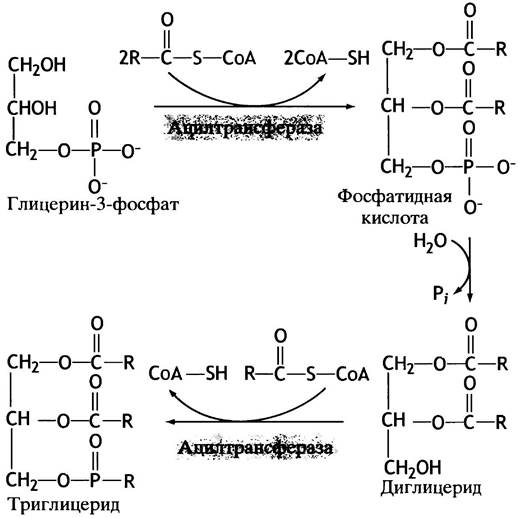
Организм синтезирует нейтральные жиры с целью пополнения запасов. Для образования эфирной связи между глицерином и жирными кислотами последние нужно активировать путем присоединения ацил-СоА; эту реакцию катализирует ацил-СоА-синтетаза:
RСООН + СоА-SН-АТР —> RСО-S-СоА + АМР + РРi.
У обычных эфиров карбоновых кислот свободная энергия гидролиза меньше, чем у соответствующих тиоэфиров, поэтому такая активация жирных кислот делает синтез триглицеридов экзэргоническим процессом.
Обратите внимание, что акцептором ацильных групп выступает не глицерин, а глицерин-3-фосфат, который образуется в результате восстановления дигидроксиацетонфосфата - промежуточного продукта гликолиза.
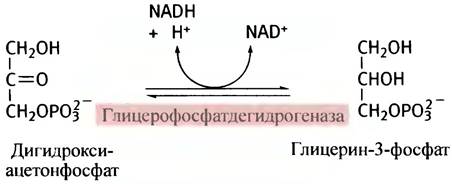
В печени (но не в жировых клетках) глицерин-3-фосфат образуется также в реакции прямого фосфорилирования глицерина. Все этапы синтеза триглицеридов представлены на рис. 10.5.
Рис. 10.5. Синтез триглицеридов (нейтральных жиров) из глицерин-3-фосфата
Синтез глицерофосфолипидов
В состав мембраны входят фосфолипиды, основу структуры которых составляет остаток глицерина.
Фосфоглицериды различаются лишь природой спиртового остатка, связанного фосфоэфирной связью с фосфатидной кислотой.
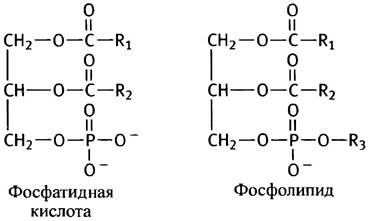
В роли R3 может выступать остаток серина, этанол- амина, холина, инозита или диацилглицерина. В мембранах эукариот преобладают фосфатидилэтаноламин и фосфатидилхолин, поэтому рассмотрим сначала их синтез. Этаноламин и холин имеют следующее строение:
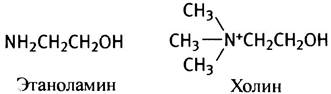
Оба эти соединения - спирты и могут быть обозначены как R-OH. Для участия в синтезе фосфолипидов эти спирты предварительно «активируются» в ходе двухстадийного процесса. На первой стадии они фосфорилируются с помощью АТР:
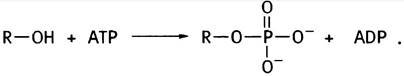
На второй стадии фосфорилированные спирты реагируют с цитидинтрифосфатом (СТР), который является аналогом АТР. В нем адениновый остаток заменен на цитозиновый (цитидином называют цитозилрибозу). СТР присутствует во всех клетках, поскольку он необходим для синтеза РНК и ДНК (см. главу 21). Почему при фосфорилировании спиртов используется именно СТР, а не АТР, остается только гадать. То ли это «причуда» эволюции, то ли нам пока не известен ее замысел. Во всяком случае, реакция СТР с фосфоэфирами очень похожа на образование UDP-глюкозы из глюкозо-1 -фосфата и UTP (см. с. 87):
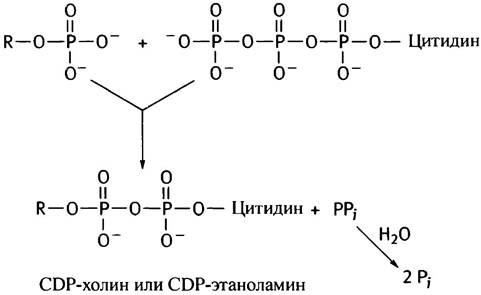
Гидролиз пирофосфата делает эту реакцию необратимой и сильно экзоэргоничной. В конечной реакции синтеза фосфатидилэтаноламина и фосфатидилхолина участвует 1,2-диглицерид, образующийся под действием фосфатазы на фосфатидную кислоту (см. с. 54).
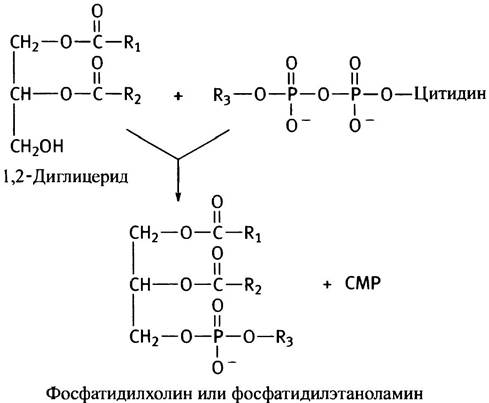
Таким образом, описанный путь синтеза фосфоглицеридов сводится к активации спиртовой полярной головки СТР с последующим переносом фосфорилированного спирта на другой спирт - диглицерид. Энергетически возможен и другой путь - активация диглицерида и перенос остатка диглицеридфосфата на холин или этаноламин. Так в клетках эукариот синтезируются фосфатидилинозит и кардиолипин (см. с. 55). В последнем случае роль спирта играет вторая молекула диглицерида.
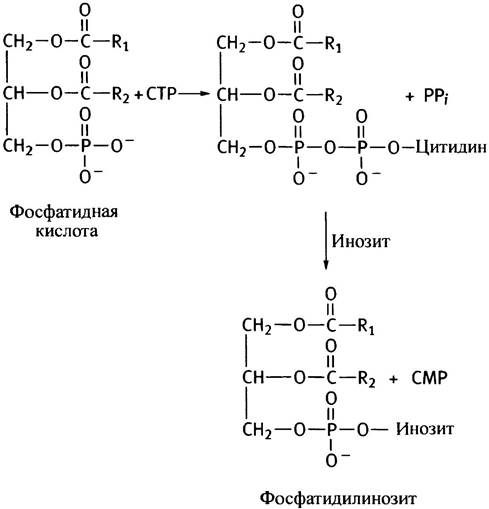
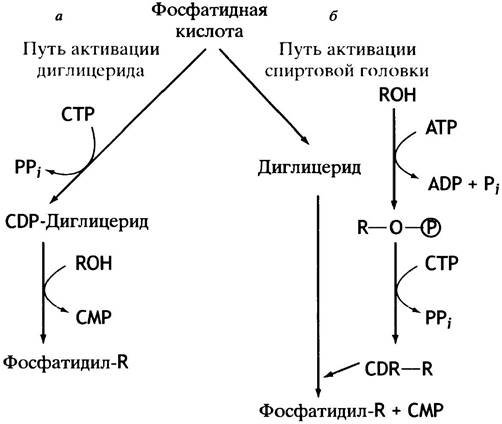
Схема обоих путей синтеза глицерофосфолипидов представлена на рис. 10.6. В действительности все обстоит значительно сложнее из-за различных взаимопревращений фосфолипидов. Например, они могут обмениваться остатками серина и этаноламина, фосфатидилсерин декарбоксилируется с образованием фосфатидилэтаноламина, а последний метилируется до фосфатидилхолина. Все эти процессы в разной степени представлены у различных организмов.
Рис. 10.6. Два пути синтеза фосфоглицеридов. RОН - спирт, остаток которого служит полярной головкой в синтезируемом фосфолипиде. У млекопитающих кардиолипин и фосфатидилинозит синтезируются по пути а, а фосфатидилхолин, фосфатидилэтаноламин и фосфатидилсерин - по пути б. Синтез фосфолипидов в бактериях протекает по пути а
Место синтеза мембранных липидов
В животных клетках синтез мембранных липидов осуществляется на поверхности гладкого эндоплазматического ретикулума. Синтезированные липиды транспортируются по назначению либо в виде мембранных пузырьков, которые отпочковываются от мембран аппарата Гольджи, либо с помощью белков-переносчиков (механизм такого переноса до конца не выяснен).
Синтез простагландинов и родственных им соединений
Название этой группы соединений - эйкозаноиды - происходит от греческого числительного «двадцать». Именно столько углеродных атомов содержится в их молекулах, биосинтез которых начинается с полиненасыщенных жирных кислот. Хотя эйкозаноиды присутствуют в организме в незначительных количествах, диапазон их физиологических функций очень широк.
Эйкозаноиды делятся на три основные группы по названию клеток, в которых они впервые были открыты: простагландины, тромбоксаны и лейкотриены. Простагландины были обнаружены в семенной жидкости. Сначала думали, что они попадают туда из предстательной железы (простаты), но позже оказалось - из семенных пузырьков. Теперь известно, что простагландины синтезируются во многих тканях. Тромбоксаны были найдены в кровяных пластинках (тромбоцитах), а лейкотриены - в белых кровяных тельцах (лейкоцитах).
Простагландины и тромбоксаны
Известно много простагландинов, различающихся деталями структуры. Их делят на подклассы, обозначаемые как РGА, РGЕ и РGF. Цифровой индекс при них
указывает на число двойных связей в боковых цепях, прикрепленных к циклопентановому кольцу. В качестве примера на рис. 10.7, б показана структура РСЕ2. У человека основную роль играют соединения с двумя двойными связями, которые синтезируются из арахидоновой кислоты (рис. 10.7, а). Остальные простагландины образуются из других полиненасыщенных жирных кислот. Арахидоновая кислота присутствует в организме главным образом в виде жирнокислотного остатка фосфолипидов. Для синтеза простагландинов она предварительно отщепляется фосфолипазой.
Рис. 10.7. Структура простагландинов и родственных им соединений: а - Арахидоновая кислота; б - простагландин Е2 (РGЕ2); в - тромбоксан А2 (ТХА2); г - лейкотриен А4 (LTА4)
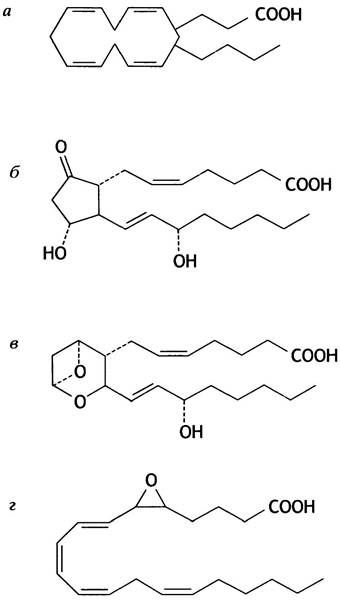
Первая стадия синтеза простагландинов осуществляется циклооксигеназой, которая превращает арахидоновую кислоту в циклическое соединение (см. рис. 10.7, а). Этот фермент ингибируется аспирином (ацетилсалициловой кислотой), который ацетилирует гидроксильную группу серинового остатка в активном центре фермента.
Поскольку тромбоксаны (рис. 10.7, в) образуются путем модификации некоторых простагландинов, аспирин блокирует и их синтез.
Простагландины выполняют множество физиологических функций. Сразу после синтеза они выбрасываются из клеток и служат в качестве местных гормонов, воздействуя на рецепторы соседних клеток. Они вызывают боль, воспаление и жар, стимулируют сокращение гладкой мускулатуры, участвуют в регуляции давления крови, подавляют секрецию соляной кислоты в желудке. Тромбоксаны вызывают агрегацию тромбоцитов, тем самым стимулируя свертывание крови.
Ингибируя циклооксигеназу, аспирин подавляет многие из перечисленных эффектов. В частности, в малых дозах (100 мг в день) он блокирует синтез тромбоксанов, уменьшая агрегацию тромбоцитов. Такая профилактическая терапия предотвращает инфаркт, поскольку снижает вероятность образования сгустков в коронарных артериях.
Лейкотриены
Строение одного лейкотриена показано на рис. 10.7, г. Лейкотриены также синтезируются из арахидоновой кислоты, но другим ферментом - липоксигеназой. Вызывая продолжительное сокращение гладкой мускулатуры, они сужают дыхательные пути, участвуя тем самым в развитии астматических приступов. Кроме того, лейкотриены играют роль в регуляции деятельности лейкоцитов.
Синтез холестерина и его регуляция
Считается, что большинство клеток нашего тела может синтезировать холестерин. Он является необходимым компонентом плазматических мембран и служит предшественником желчных кислот и стероидных гормонов. Печень и в меньшей степени тонкий кишечник - наиболее активные продуценты холестерина. В главе 6 рассказывалось о двух механизмах, посредством которых холестерин в печени и других тканях образует единый сбалансированный фонд.
Удивительно, что при синтезе большой сложной молекулы холестерина единственным исходным материалом служит ацетил-СоА. Путь этого синтеза очень сложен. Наиболее интересны первые этапы синтеза, поскольку именно на этом уровне определяется количество продуцируемого холестерина. Речь идет о биосинтезе мевалоновой кислоты - первого метаболита, предназначенного исключительно для синтеза холестерина. Соответствующие реакции, показанные на рис. 10.8, протекают в цитозоле. Гидроксиметилглутарил-СоА служит также предшественником ацетоацетата при образовании кетоновых тел, однако для этой цели он синтезируется внутри митохондрий.
Рис. 10.8. Синтез мевалоната из ацетил-СоА
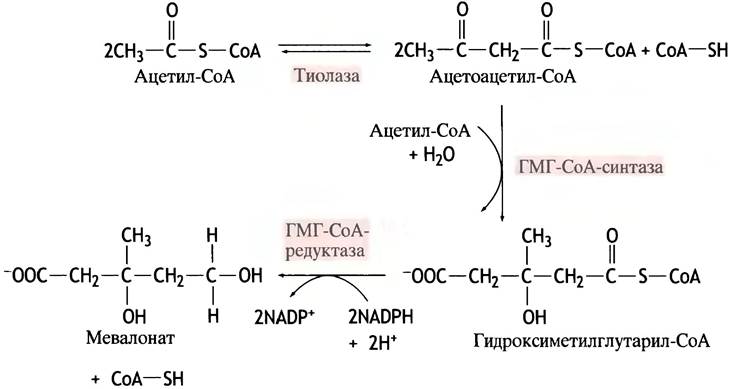
На уровне гидроксиметилглутарил-СоА-редуктазы синтез холестерина регулируется посредством трех механизмов. По механизму обратной связи холестерин: 1) подавляет синтез редуктазы на уровне гена; 2) вызывает деструкцию фермента; 3) инактивирует фермент с помощью фосфорилирования (о последнем см. с. 161). Для снижения в терапевтических целях уровня холестерина в крови разработаны специальные лекарственные препараты. Напоминая по структуре мевалоновую кислоту, они при взаимодействии с гидроксиметилглутарил-СоА-редуктазой выступают как аналоги переходного состояния, что обеспечивает их прочную ассоциацию с активным центром фермента. Два таких лекарства известны под названиями ловастатин и симвастатин.
Вопросы к главе 10
1. На ранних этапах синтеза жирных кислот ацетил-СоА сначала карбоксилируется, затем почти сразу декарбоксилируется. Для чего это нужно?
2. Изобразите с помощью диаграммы основные этапы цикла удлинения жирнокислотной цепи, опуская при этом восстановительные реакции.
3. Как устроена синтаза жирных кислот у эукариот? Чем она отличается от фермента Е. соli. Где более эффективно протекает синтез жирных кислот - у бактерий или у животных?
4. Изобразите структуру NАD+ и NАDР+. В чем причина одновременного существования обоих коферментов?
5. В каких тканях сосредоточен синтез жирных кислот у эукариот?
6. Синтез пальмитата из ацетил-СоА сосредоточен в цитоплазме, а главный производитель ацетил-СоА - пируватдекарбоксилаза - в митохондриях. Ацетил- СоА не проникает через мембрану. Как он попадает из митохондрий в цитоплазму?
7. Откуда берется NАDРН, необходимый для синтеза жирных кислот?
8. Опишите, как из жирных кислот синтезируются триглицериды.
9. Какую роль в метаболизме липидов играет СТР?
10. Что такое эйкозаноиды? Из чего они образуются? Каково их физиологическое значение? Какое отношение к ним имеет аспирин?
11. Как действуют лекарственные препараты, подавляющие синтез холестерина?