БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 23. ВИРУСЫ И ВИРОИДЫ
Помимо того, что вирусы имеют огромное биологическое и медицинское значение, они нашли широкое применение в биохимических исследованиях. Вирусы используются в качестве простых моделей для изучения сложных процессов функционирования гена и служат полезным инструментом, предназначенным для достижения самых разных целей, включая создание рекомбинантных ДНК (см. главу 24).
За исключением особых стратегических путей выживания, например, образования спор, в которых химические превращения сведены к минимуму, живые клетки всегда метаболически активны: синтезируют АТР, выполняют осмотическую работу, синтезируют клеточные компоненты и т. д. Еще клетка увеличивается в размерах и делится. Для этого требуются тысячи генов, кодирующих необходимые белки.
Вирусы отличаются от клеток. Они намного меньше, и чтобы их увидеть, необходим электронный микроскоп.
У вирусов отсутствует метаболизм. Вирусная частица - вирион - сама по себе не может ровным счетом ничего. Она не генерирует энергию, в ней не протекают химические реакции: это инертный организованный комплекс молекул.
Вирусы размножаются только после инфицирования живых клеток. Различные вирусы инфицируют животные и растительные клетки, а также бактерии (вирусы бактерий называются бактериофагами). Задача вирусов заключается в доставке генетического материала в клетки и в использовании аппарата клетки для своей собственной репликации.
Вирусная частица представляет собой нуклеиновую кислоту, окруженную одной или несколькими защитными оболочками. Хотя защитные оболочки содержат много копий белковых молекул, у большинства вирусов они образованы всего лишь несколькими видами белков. Общее число вирусных генов может изменяться от сотен (например, у вируса коровьей оспы) до трех-четырех.
Белковая оболочка, окружающая геном, называется капсидом, а геном вируса, покрытый этой оболочкой, - нуклеокапсидом. У некоторых вирусов есть дополнительная липидная бислойная оболочка, в которую встроены белковые молекулы, экспонированные на поверхность и участвующие в начальных стадиях инфекционного процесса.
Жизненный цикл вируса
Вирус должен войти в клетку, которую он инфицирует, внедрив в нее свой генетический материал (РНК или ДНК). Вирусные гены управляют синтезом вирусспецифических ферментов, нужных для репродукции вируса, а также белков, необходимых для сборки новых вирусных частиц. Вирус обязан произвести множество копий своего генома и из синтезированных компонентов собрать потомство вирионов, которое должно затем покинуть клетку.
Опишем стадии жизненного цикла вирусов, а затем для иллюстрации общих принципов более детально разберем ряд специфических вирусов.
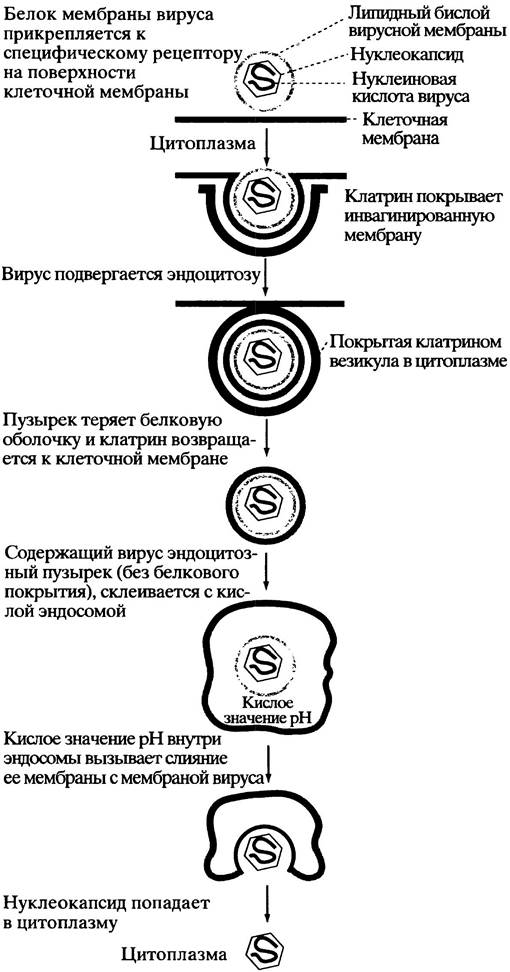
Живая клетка окружена липидной бислойной мембраной, которая препятствует проникновению вируса. Однако существуют пути для преодоления этого барьера, например, рецептор-опосредуемый эндоцитоз у животных клеток (с. 204). Некоторые вирусы используют этот клеточный механизм импорта для проникновения в клетку. На первом этапе вирион связывается с ее поверхностью при помощи покровного белка, комплементарного специфическому рецептору, расположенному снаружи клетки-хозяина. Наличие такого рецептора - главное условие для инфицирования вирусом данной клетки. После прикрепления комплекс вирус-рецептор движется в мембране к углублению, называемому окаймленной ямкой, внутренняя поверхность которой выстлана белком клатрином (рис. 23.1). Как и в случае нормального рецептор-опосредуемого эндоцитоза, ямка впячивается до поглощения вириона, заключенного в окаймленный пузырек (везикулу), внутрь клетки. Затем клатрин возвращается к клеточной мембране, а содержащий вирус пузырек сливается с цитоплазматическим пузырьком - эндосомой, оставляя вирус внутри последней. При нормальном (невирусном) эндоцитозе эндосомы доставляют содержимое к пузырькам, образованным аппаратом Гольджи (лизосомам), которые содержат набор гидролитических ферментов, разрушающих захваченную частицу (см. рис. 16.2). Работа протонного насоса поддерживает кислое значение pH внутри эндосомы. Кислая среда вызывает диссоциацию вируса от мембранного рецептора клетки-хозяина. В случае, если вирус имеет мембранную оболочку, она сливается с мембраной эндосомы - и содержимое вируса оказывается в цитоплазме. Здесь вирус теряет белковую оболочку, высвобождая в цитоплазму генетический материал. Механизм проникновения вируса, лишенного мембраны, из эндосомы в цитоплазму еще не выяснен до конца.
Рис. 23.1. Процесс инвазии животной клетки вирусом, содержащим мембранную оболочку, с использованием рецептор-опосредованного эндоцитоза
Второй путь, доступный только для вирусов, имеющих липидную мембрану, заключается в прямом слиянии с внешней мембраной клетки-хозяина. В этом случае прикрепление вируса к поверхности клетки является результатом взаимодействия вирусного и специфического клеточного белков. При этом происходит слияние двух мембран (вирусной и клеточной) с образованием сквозного отверстия, через которое содержимое вируса входит в клетку. Это путь использует вирус СПИДа.
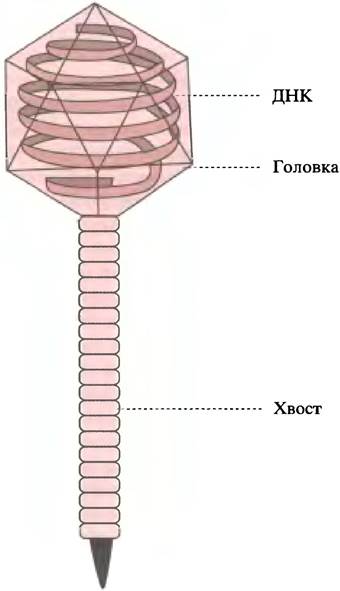
Бактериальные вирусы - бактериофаги - проникают в клетку другим способом. Бактерии имеют прочную клеточную стенку. Фаг лямбда (λ) похож на головастика (рис. 23.2), его головка представляет собой белковую капсулу, внутри которой находится молекула ДНК. Фаг прикрепляется к клеточной стенке нитевидным хвостом и с его помощью, словно шприцом для подкожных инъекций, вводит ДНК в бактериальную клетку.
Типы генетического материала у различных вирусов
Генетический материал вирусов может быть представлен двуцепочечной или одноцепочечной ДНК, двуцепочечной или одноцепочечной РНК. До сих пор в этой книге в качестве генетического материала рассматривалась двуцепочечная ДНК. Ранее мы отмечали (см. с. 232), что ДНК более стабильна, чем РНК: наличие у нее двух цепей означает, что повреждение в одной цепи можно исправить, используя для репарации другую цепь в качестве матрицы. Реплицирующий аппарат ядра включает исправление ошибок, что сильно уменьшает число последних. Для механизма синтеза РНК такой аппарат не предусмотрен, тем не менее у многих вирусов генетическим материалом служит РНК. Почему? Среди вероятных причин можно назвать следующие: 1) геномы вирусов крайне малы по сравнению с размером генома клетки, следовательно, вероятность вредных мутаций в ходе репликации вирусной РНК меньше; 2) хотя ошибок при репликации РНК больше, чем при репликации ДНК, и некоторые из них могут быть летальными, этот недостаток компенсируется высокой скоростью размножения. (В условиях жесткого селекционного отбора она становится даже преимуществом, поскольку быстрая мутация помогает вирусу избежать иммунологической атаки со стороны организма-хозяина.)
Рис. 23.2 Фаг лямбда. Головка фага образована хромосомой, содержащий около 50 000 пар оснований ДНК. Хромосома окружена белковой оболочкой
После проникновения в клетку хозяина судьба различных типов генетического материала вирусов складывается по-разному. Двуцепочечная ДНК вируса транскрибируется РНК-полимеразой клетки-хозяина с образованием мРНК. (В этом классе вирусов вирус коровьей оспы необычен тем, что у него есть собственная РНК-полимераза.) Минус (матричная) цепь двухцепочечного генома копируется для образования мРНК, а последняя управляет синтезом вирусспецифических белков. В случае вирусов, содержащих одноцепочечную ДНК-в виде (+)- или (-)-цепи - в ходе репликации с использованием ферментов клетки-хозяина образуется двухцепочечная ДНК, с которой транскрибируется мРНК (определение цепей см. ниже).
У клеток нет аппарата для репликации вирусной РНК. Вирусы, обладающие двуцепочечной РНК, имеют в составе вирусных частиц молекулы РНК-зависимой РНК-полимеразы. В клетке хозяина этот фермент транскрибирует мРНК с матрицы вирусной РНК. мРНК транслируется аппаратом клетки хозяина с образованием вирусспецифических белков, необходимых для репликации вируса. Геномы вирусов с одноцепочечной РНК существуют в двух формах. Вспомним (см. с. 263), что в клетке одна из двух цепей ДНК называется смысловой (нематричной) цепью, последовательность оснований которой идентична (за исключением замены Т на и) мРНК транскрибируемой с другой, несмысловой (матричной) цепи. У различных вирусов, содержащих одноцепочечную РНК, цепь РНК может быть эквивалентна как смысловой, так и несмысловой цепи. Они называются «плюс» (+)- или «минус» (-)-цепи соответственно. Иными словами, РНК вируса, содержащего (+)-цепь РНК, является матричной (информационной) РНК, в то время как у вируса с (-)-цепью - нет. Если (+)-РНК попадает в клетку, то ее белоксинтезирующий аппарат может немедленно транслировать РНК, производя вирусные белки, в том числе ферменты, необходимые для репродукции вирусов, - ведь это мРНК. Такой вирус нуждается только в РНК, кодирующей все белки, необходимые для репродукции после инфицирования. Сложнее обстоит дело с вирусом, содержащим (-)-цепь РНК: это не мРНК, клетка не может ни транслировать ее, ни реплицировать. Для копирования (-)-РНК в (+)-РНК (мРНК) требуется дополнительный РНК-реплицирующий фермент, имеющийся у вируса.
Другой класс вирусов, содержащих (+)-цепь РНК - ретровирусы, среди которых наибольший интерес представляет вирус иммунодефицита человека (ВИЧ), вызывающий синдром приобретенного иммунодефицита (СПИД). Его вирион несет фермент, превращающий одноцепочечную РНК в двуцепочечную ДНК, которая может встраиваться в хромосому клетки-хозяина.
Как вирусы высвобождаются из клеток?
Некоторые вирусы, например, вирус полиомиелита, высвобождаются в ходе простого лизиса клетки. В случае бактериофага λ прочная клеточная стенка бактерий могла бы препятствовать высвобождению новых фаговых частиц. Однако один из фаговых генов кодирует фермент лизоцим, который разрушает клеточную стенку, вызывая лизис клетки. Этот ген транскрибируется только на поздней стадии заражения, так что клетка не разрушается до тех пор, пока не образуются новые фаговые частицы. Несмотря на то, что бактериофаг λ - всего лишь небольшой «кусочек» ДНК длиной в 48 502 нуклеотида с 63 генами, последние являются объектом сложной системы контроля.
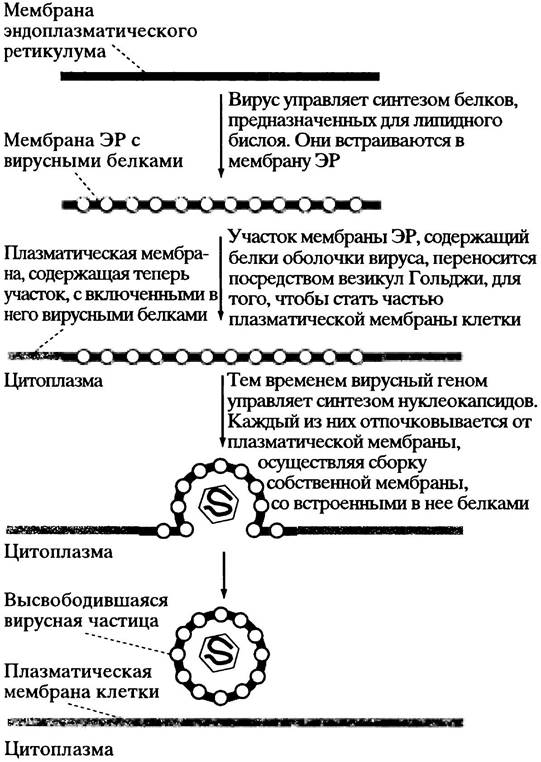
Механизм высвобождения животных вирусов, которые окружены бислойной липидной мембраной, более сложен. Вирус и в этом случае использует инфицированную им клетку. Напомним, что в обычной клетке новая клеточная мембрана, содержащая необходимое количество белков, образуется в шероховатом эндоплазматическом ретикулуме (см. с. 301). Белки гликозилируются и при помощи пузырьков аппарата Гольджи транспортируются к клеточной мембране; пузырьки сливаются с ней, образуя новую клеточную мембрану, содержащую нужные мембранные белки.
Некоторые вирусы, окруженные липидной оболочкой, адаптируют этот процесс для своих собственных целей. мРНК белков оболочки кодирует лидерную
и якорную последовательности (см. с. 303), поэтому положение белков в шероховатом ЭР, откуда они доставляются, такое же, как было описано выше для клеточной мембраны. Там мембранные белки вируса накапливаются. Новый нуклеокапсид вируса (геном + белки оболочки капсида) отпочковывается от мембраны, собирая свою липидную оболочку с включенными в нее мембранными белками. Вирусы гриппа и СПИДа используют именно этот метод формирования частиц (рис. 23.3).
Рис. 23.3. Высвобождение вирусных частиц из клетки путем отпочкования от клеточной поверхности
Механизмы репликации некоторых вирусов
Вирусы успешно преодолевают трудности, связанные с различными путями репликации. Их обобщение заняло бы слишком много места, поэтому мы познакомимся
лишь с несколькими вирусами, размножение которых иллюстрирует основные способы репликации. Кроме того, эти вирусы представляют самостоятельный интерес.
Вирус коровьей оспы
Вирус, вызывающий оспу у коров, использовался для создания вакцины против оспы. Он является одним из самых крупных и наиболее сложных вирусов, геном которого представлен двуцепочечной ДНК. Последняя транскрибируется в мРНК, обеспечивающую синтез рибосомами клетки-хозяина белковых компонентов, необходимых для образования новых вирионов (включая ферменты репликации ДНК вируса).
Геном большинства вирусов, представленный двуцепочечной ДНК, находит свой путь в ядро, где РНК-полимераза хозяина транскрибирует вирусные гены в мРНК. Вирус коровьей оспы необычен тем, что полная репликация происходит в цитоплазме, где нет РНК-полимеразы хозяина. Поэтому вирус должен приносить в своих частицах молекулы собственной РНК-полимеразы, обеспечивая тем самым образование мРНК и синтез всех необходимых белков, включая РНК-полимеразу.
Полиовирус
Это «голый» вирион, содержащий лишь оболочку из покровного белка. Он связывается со специфическим рецептором, найденным только в эпителиальных клетках человека и других приматов. Поскольку его одноцепочечная (+)-РНК является матричной (информационной), она транслируется при попадании в цитоплазму. При этом образуется РНК-репликаза, которая синтезирует РНК, используя РНК вируса в качестве матрицы. Репликаза копирует исходные (+)-цепи в (-)-цепи, последние же служат матрицами для синтеза большего числа (+)-цепей. Среди РНК-синтезирующих ферментов РНК-репликаза полиовируса уникальна тем, что не может сама по себе инициировать синтез цепей РНК. В этом случае праймером является не олигонуклеотид, а белок, к которому фермент добавляет первый нуклеотид и затем удлиняет цепь.
При трансляции мРНК образуется большой «полипротеин», который затем расщепляется на отдельные белки. Цель образования полипротеина не совсем понятна: ведь в ходе трансляции образуется равное число молекул покровного белка и репликазы, хотя для образования вирусных частиц требуется гораздо больше молекул покровного белка, чем нужно репликазы для репликации.
Вирус гриппа
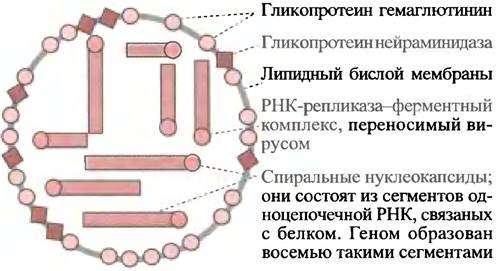
Этот вирус обладает (-)-цепью РНК. Его геном разделен на восемь сегментов, каждый из которых заключен в спиральный нуклеокапсид, окруженный липидной мембраной, куда встроены молекулы двух различных гликопротеинов (рис. 23.4). Одним из них является поверхностный белок гемагглютинин. Это название белок получил из-за того, что при смешивании с красными кровяными клетками он вызывает их агглютинацию. Углеводный компонент на поверхности эритроцитов, присоединенный к молекулам трансмембранного белка - гликофорина, оканчивается нейраминовой (сиаловой) кислотой (см. с. 56). При смешивании с красными кровяными клетками in vitro гемагглютинин присоединяется к нейраминовой кислоте и сшивает клетки в агрегаты. Вирус находит вход в клетку-хозяина, присоединяясь к ее рецептору (который также несет концевой остаток нейраминовой кислоты), а затем проникает в нее посредством эндоцитоза.
Рис. 23.4. Схематическая структура вируса гриппа. Слой матриксного белка внешней мембраны не показан
На поверхности вириона находится 700 молекул гемагглютинина. Кроме того, есть еще один поверхностный белок - фермент нейраминидаза, который гидролизует концевые группы нейраминовых кислот гликопротеинов. Функциональное значении этого фермента до конца не выяснено. На первый взгляд кажется странным наличие у вируса поверхностного фермента для разрушения клеточных рецепторов, от которых зависит его проникновение в клетку. Возможно, данный фермент разжижает муцин, содержащий сиаловую кислоту (см. с. 56). Это облегчает доступ к клеточной поверхности для инфицирования и выход новых вирусных частиц. Разжижение муцинов может также способствовать более эффективному распространению вируса при чихании. Наконец нельзя исключить, что вновь образовавшиеся вирионы фиксированы на клетке-хозяине рецепторами нейраминовой кислоты. Нейраминидаза противодействует этому, разрушая рецепторы и высвобождая вирусы. Есть данные о важности этого фермента для эффективного размножения вируса в ходе инфекции.
Как уже отмечалось, геном вируса в виде спирального нуклеокапсида сосредоточен в 8 отдельных сегментах (-)-РНК (см. рис. 23.4). Поскольку (-)-цепь РНК не является матричной, для ее репликации необходима РНК-репликаза.
Вирус несет в своих нуклеокапсидах молекулы РНК-репликазы, которая копирует (-)-цепи в (+)-цепи РНК (эквивалент мРНК), а в ходе трансляции образуются все необходимые вирусные белки, включая большое число молекул РНК-репликазы.
Действие иммунной системы направлено главным образом против гемагглютинина вируса гриппа. Он нейтрализуется таким образом, что переболевший этой болезнью человек становится невосприимчивым к повторной инфекции идентичным штаммом вируса. Впрочем, в результате мутаций (ведь это РНК-вирус) аминокислотный состав вирусного гемагглютинина постоянно меняется, и защитные свойства иммунитета постепенно снижаются. Это явление известно, как антигенная изменчивость. Замена отдельных аминокислот не сопровождается большими эпидемиями, потому что участки связывания антигена на поверхности белка сохраняются при постепенных изменениях в структуре. Происходит только уменьшение их числа, так что у населения наступает лишь частичная потеря иммунитета, и многие инфекции протекают достаточно мягко. Однако, если у вируса присутствует совершенно новый гемагглютинин, то в силу антигенной изменчивости может возникнуть пандемия, поскольку остаточная иммунная защита против нее отсутствует. Такая ситуация возможна в ходе инфицирования клетки двумя различными штаммами вируса. Из-за разделенного генома при сборке новых вирусных нуклеокапсидов способна происходить пересортировка РНК. Пандемия 1918 года, которая как полагают, произошла в результате такой пересортировки между штаммами вируса человека и птиц, унесла 20 млн жизней.
Новые подходы к лечению гриппа связывают с воздействием на структуру белка. С помощью метода рентгеноструктурного анализа была установлена точная структура центра связывания нейраминовой кислоты кристаллической нейраминидазой вируса гриппа. Это позволило получить синтетический аналог нейраминовой кислоты, который с высоким сродством присоединяется к ферменту, блокируя его действие. В настоящее время проводятся клинические испытания этого субстратного аналога в качестве лекарственного средства против вируса гриппа. Данное соединение не блокирует участок гемагглютинина, ответственный за связывание с рецептором клетки-хозяина, поэтому инфицирование клетки вирусом гриппа все-таки происходит. Торможение активности нейраминидазы, по-видимому, предупреждает дальнейшее распространение инфекции, так как для высвобождения новых вирусов из клетки необходим активный фермент.
Ретровирусы
Как уже отмечалось, есть четвертый класс одноцепочечных РНК-вирусов, вызывающих в настоящее время большой интерес. Это ретровирусы, к которым принадлежит и вирус СПИДа. Они относятся к числу вирусов, содержащих (+)-цепь РНК. Однако при инфицировании клетки ретровирусы не следуют по пути полиовируса. Частица ретровируса несет несколько молекул особого фермента. Его находка сначала вызвала недоверие, а завершилась присуждением Нобелевской премии первооткрывателям - Говарду Темину и Дэвиду Балтимору. Этот фермент называется обратной транскриптазой. До его обнаружения, конечно, знали, что ДНК может управлять синтезом РНК, но, чтобы наоборот?!
Обратная транскриптаза - удивительный полифункциональный фермент. Когда ретровирус инфицирует клетку, обратная транскриптаза вируса копирует (+)-цепь РНК в ДНК. Как и во всех случаях репликации, для синтеза ДНК необходим праймер. У ретровирусов эту функцию выполняет тРНК, попадающая в вирион из клетки-хозяина и взаимодействуюшая с вирусной ДНК по принципу комплементарности. Образовавшийся гибрид РНК/ДНК после гидролиза РНК превращается в одноцепочечную ДНК. Эту РНКазную реакцию также катализирует обратная транскриптаза. Затем одноцепочечная ДНК копируется тем же ферментом с образованием двуцепочечной ДНК. Вирусный геном теперь находится в форме нормального дуплекса ДНК (так называемой провирусной ДНК) и встраивается в хромосому клетки-хозяина (рис. 23.5). В этом процессе важную роль играет еще один вирусный фермент - интеграза, которая и интегрирует провирусную ДНК в хромосому хозяина. У двуцепочечной ДНК вирусного генома (провирусной ДНК) на каждом конце есть последовательность оснований, называемая длинным концевым повтором (англ. long terminal repeats; LTR) (рис. 23.6), которая участвуют в образовании «стыков» с клеточной ДНК. В результате двуцепочечная ДНК вируса представляет собой, в сущности, дополнительный набор генов клетки, который реплицируется вместе с ДНК хозяина при делении. Для образования новых ретровирусных частиц провирусные гены (гены вируса в хромосомах хозяина) транскрибируются в (+)-РНК транскрипты. Одни из них становятся геномом нового «потомства» ретровирусов, а другие подвергаются процессингу в мРНК и используются для трансляции белков, необходимых для сборки вирусных частиц.
Рис. 23.5. Репликация гипотетического ретровируса
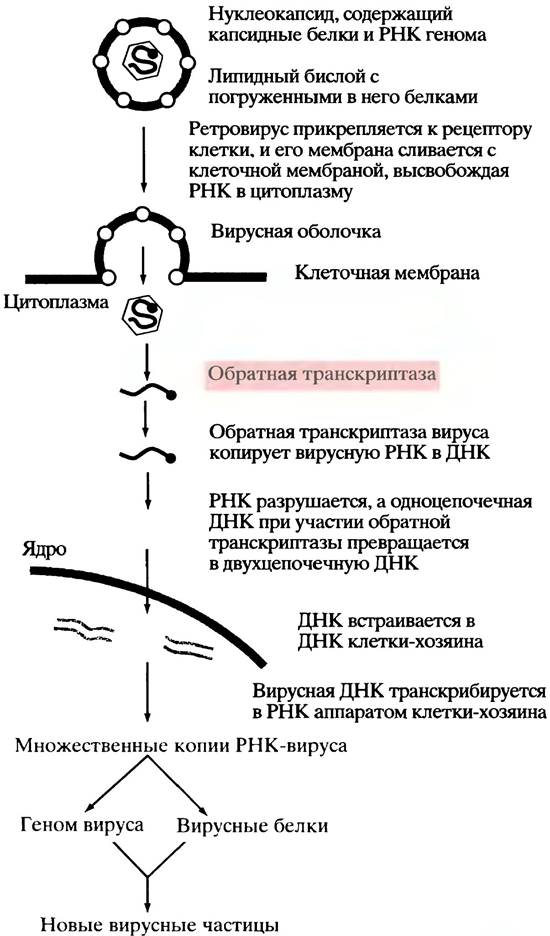
Рис. 23.6. Провирусный геном онкогенного ретровируса, встроенный в геном клетки хозяина. LTR - длинный концевой повтор (long terminal repeat). Онкоген может кодировать аномальный регуляторный белок или способствовать образованию чрезмерных количеств такого белка

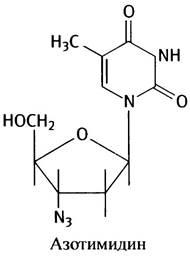
Препарат AZT - азотимидин, структура которого приведена ниже, используется для лечения СПИДа: он ингибирует обратную транскриптазу. Для этого AZT должен превратиться в трифосфат, являющийся аналогом dTTP. AZT-трифосфат ингибирует обратную транскриптазу, а также обрывает элонгацию цепи ДНК из-за отсутствия 3'-ОН группы. ДНК-полимераза тормозится в гораздо меньшей степени.
Ретровирусы могут быть использованы в генотерапии для доставки к клеткам больного, у которого присутствует дефектный ген, «хорошего» гена, способного исправить этот дефект. Принцип заключается в нарушении репродуктивной способности ретровируса путем делеции гена и замещения участка его РНК фрагментом в виде ДНК, который эквивалентен гену, предназначенному для интеграции в хромосому хозяина. Недостаток метода заключается в беспорядочном течении интеграции, а это таит в себе потенциальную опасность. В настоящее время развиваются методы сайт-направленного встраивания генов.
Онкогенные ретровирусы
Интеграция в хромосому генетического материала онкогенного ретровируса (в форме своей ДНК, см. рис. 23.6) может привести к образованию опухоли. Первым среди описанных онкогенных вирусов был вирус саркомы Рауса, вызывающий опухоли мышечной ткани цыплят. Развитие опухоли обуславливал один ген ретровируса - онкоген.
С тех пор у млекопитающих было открыто 18 или 20 онкогенов. Ранее мы говорили о гибридизации ДНК. Согласно этому методу, небольшой фрагмент ДНК, ставший одноцепочечным под действием нагревания, безошибочно найдет среди тысяч оснований комплементарный ему фрагмент и соединится с ним при помощи
водородных связей. Разработаны методы определения гибридизационных комплексов (см. с. 233). Удивительно, что в каждом случае ретровирусный онкоген, вызывающий опухоль, имеет своего «двойника» в нормальных клетках. Это относится только к экзонам нормального гена, поскольку из-за сплайсинга форма вирусной РНК гена не имеет интронов. В ходе эволюции вирусный онкоген, по-видимому, произошел от своего клеточного двойника. Единственным различием между ними может быть расхождение всего в одном основании. Вирусный ген обозначают приставкой «V», а соответствующий клеточный ген - приставкой «с» (англ. cellular). Генам дают любопытные сокращения (см. объяснение названий на с. 356): например, с-mус и v-myc, c-ras и v-ras и т. д. Клеточный ген называется протоонкогеном. Оказалось, что протоонкогены кодируют белки, участвующие в важных регуляторных клеточных механизмах (см. главу 26), нарушения которых могут привести к неконтролируемому делению клеток. Некоторые из них кодируют аномальные факторы транскрипции (см. с. 355). Эволюционно ретровирусные онкогены могли произойти от ретровирусов, случайно «подобравших» молекулу мРНК, транскрибированную с регуляторного гена клетки. Онкогенная вирусная форма такого регуляторного гена могла возникнуть в ходе мутации нормального клеточного двойника на стадии «подбора» или после него. При повторном встраивании этого гена (при ретровирусной инфекции) в хромосому клетки-хозяина, с помощью уже описанного механизма, присутствие онкогена приведет либо к синтезу аномального регуляторного белка, либо к синтезу чрезмерного количества такого белка с последующим нарушением клеточной регуляции (подробнее см. главу 26).
Бактериофаг лямбда
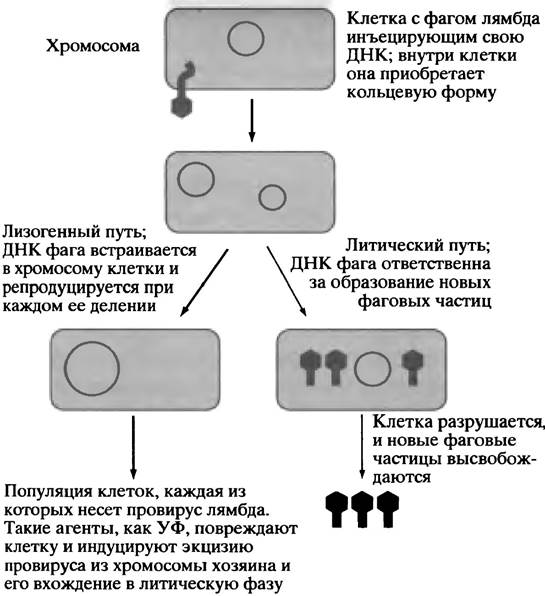
Этот бактериальный вирус интенсивно изучается и используется в молекулярной биологии и при клонировании генов (см. главу 24 и рис. 23.2). Фаг λ содержит двуцепочечную ДНК, и его жизненный цикл характеризуется рядом особенностей. При попадании в клетку у вирусной ДНК есть два пути «на выбор». Она может немедленно реплицироваться и образовать новые вирусные частицы, высвобождаемые из клетки при участии кодируемого фагом фермента лизоцима, который разрушает клеточную стенку, приводя к лизису клетки. Это - вирулентный, или литический путь (рис. 23.7). Альтернативным является лизогенный путь, при котором геном фага интегрируется в хромосому Е. coli, где он может оставаться инертным неопределенно долго, реплицируясь вместе с ДНК клетки-хозяина. Таким образом, большая популяция нормальных в других отношениях клеток Е. coli может нести ДНК фага. Клетка, содержащая в своей хромосоме ДНК лямбда, называется лизогенной клеткой, а встроенная ДНК фага - профагом. Если ДНК клеток Е. coli повреждается ультрафиолетом, химическими реагентами или ионизирующей радиацией, происходит активация так называемых SOS-функций, предназначенных для устранения нарушений. В лизогенной клетке подобные повреждения приводият к выщеплению (зксцизии) профага из ДНК по сложному механизму, который мы не будем рассматривать. Отщепившийся профаг вступает в литический цикл репликации. Бактериофаг лямбда представляет нам красивый пример процесса самосборки. Если в пробирке белковые компоненты вируса смешать с молекулами вирусной ДНК, произойдет полная сборка функционально активного вируса с упакованной в головке ДНК. Фаг лямбда - мощный инструмент клонирования генов.
Рис. 23.7. Инъекция ДНК бакатериофага λ в бактериальную клетку. Литический и лизогенный пути репликации
Что такое вироиды?
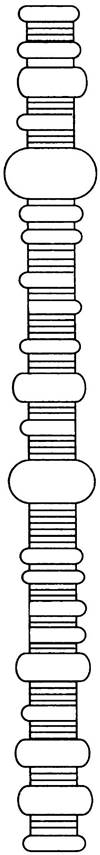
Вироиды - самые маленькие из всех известных инфекционных частиц, которые меньше и проще, чем вирусы. Они представляют собой голые молекулы РНК,
не покрытые ни белком, ни какойлибо иной оболочкой (рис. 23.8). Для инфицирования вироидами растительных клеток необходимо механическое повреждение последних (в условиях эксперимента инфицирование растений вироидной РНК проводят путем втирания ее в листья с помощью абразивного материала). Действие вироидной инфекции может проявляться по-разному, в виде некоторого ухудшения состояния растения. Но может также привести его к гибели. Так происходит, например, у пальмовых деревьев. До сих пор неизвестно, каким образом вироиды вызываю! болезни. Остается загадкой и способ репликация вироидной РНК. Удивительно и то, что у вироидов не найдены гены, кодирующие белки. Для того, чтобы определить ген, кодирующий белок, надо найти открытую рамку считывания, т. е. последовательность триплетов, кодирующих длинный участок аминокислотной последовательности. Хотя у вироидов и были найдены последовательности, ответственные за инициацию трансляции, последующие рамки считывания столь коротки (за счет стоп-кодонов), что образование белка исключено.
Рис. 23.8. Структура вироида кокосового ореха каданг-каданг. Петли представляют собой неспаренные области, а поперечные линии - спаренные основания. Это наименьший из всех известных вироидов (246 нуклеотидов). Пальмы погибают через 5-10 лет после инфицирования. Любезно предоставлена профессором R. Symons, Department of Plant Science, Waite Institute, University of Adelaide
Вопросы к главе 23
1. Объясните, каким образом вирус может получить доступ внутрь клетки зукариот.
2. Чем должен отличаться вирус (но не ретровирус), содержащий одноцепочечную (+)-РНК, от вируса, содержащего одноцепочечную (-)-РНК?
3. Почему вирус коровьей оспы в своем вирионе несет собственную ДНК-зависимую РНК-полимеразу. хотя у клетки-хозяина есть свой фермент?
4. Ретровирус это вирус, содержащий (+)-цень РНК. Чем он отличается от неретровируса, содержащею одноценочечную (-)-РНК?
5. Объясните, как вирус, обладающий липидной мембраной, приобретает ее со веем набором интегральных белков.
6. Эпидемии гриппа регулярно охватывают земной шар. Большинство из них протекает достаточно мягко, но случаются, как в 1918-м, зпидемии с больным числом летальных исходов. Почему?
7. Почему вирус гриппа вызывает агглютинацию зритроцитов, если вирусы и зритроциты смешать вместе?
8. Поверхность вируса гриппа обладает нейраминидазной активностью. Чем необычен этот факт? Какова функция нейраминидазной активности?
9. Опишите «выбор», который бактериофаг λ должен сделать при инфицировании клетки Е. coli.
10. А. Что такое вироид? Б. Известно, что вироиды инфицируют растения и размножаются там; следовательно, они должны иметь гены для образования белка. Так ли это?