БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 27. КРАСНАЯ КРОВЯНАЯ КЛЕТКА И ФУНКЦИИ ГЕМОГЛОБИНА
Самой важной молекулой в доставке кислорода от легких к тканям является гемоглобин, который представляет собой не просто белок, пассивно связывающийся с кислородом, а сложную молекулярную машину, в задачу которой входит захват максимального количества кислорода в легких, доставка его к периферическим тканям, отбор оттуда СО2, и транспортировка его в легкие.
Гемоглобин - это белок глобин, простетической группой которого является гем. В этой главе мы обсудим несколько аспектов, связанных с транспортом газов и начнем с синтеза гема и его регуляции. После этого мы рассмотрим регуляцию синтеза глобина и, наконец, обсудим физиологическую роль гемоглобина в организме.
Красные кровяные клетки
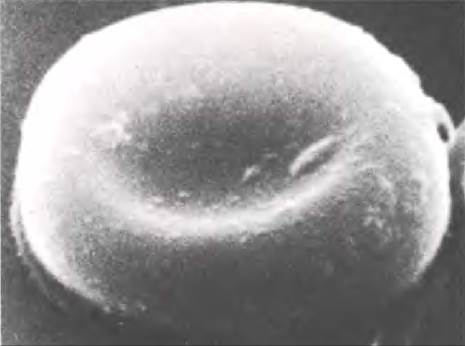
В организме человека образуется 160 млн красных кровяных клеток, или эритроцитов, в минуту. Они циркулируют в крови в течение 110 дней и затем разрушаются. Зрелые эритроциты млекопитающих не имеют ядра и представляют собой сплющенный, двояковогнутый диск (рис. 27.1). Такая форма клетки, поддерживаемая цитоскелетом, обеспечивает большую поверхность по сравнению с клетками сферической формы. Это, наряду с меньшим диффузионным расстоянием, усиливает газообмен между клеткой и внеклеточной средой. Общая поверхность всех эритроцитов составляет около 4000 м2.
Рис. 27.1. Сканирующая электронная микрофотография эритроцита
У эмбриона эритроциты образуются в печени и селезенке. У взрослых же этот процесс происходит в костном мозге плоских костей, в которых кроветворные стволовые клетки непрерывно размножаются и продуцируют предшественников всех типов кровяных клеток, как это показано на рис 25.1 (стволовая клетка постоянно осуществляет самовоспроизводство, а ее потомство способно к дифференцировке). Отдельные клетки дифференцируются в тот или иной специализированный тип кровяных клеток (эритроциты, различные лейкоциты, тромбоциты). Образование разных типов клеток крови - регулируемый процесс; обнаружены различные регуляторные белки, способные вызывать размножение специфических клеток-предшественников. Белок эритропоэтин, вырабатываемый в мозговом слое почек, стимулирует образование эритроцитов. Поскольку скорость образования эритропоэтина обратно пропорциональна парциальному давлению кислорода в ткани, регуляция уровня красных кровяных клеток происходит автоматически: при недостатке кислорода вырабатывается больше гормона, а, следовательно, и больше красных кровяных клеток.
На ранних стадиях эритроциты содержат ядро, однако позднее у млекопитающих оно исчезает и образуется незрелая красная клетка ретикулоцит, которая поступает в кровоток. Ретикулоциты содержат мРНК, и синтез белка в них происходит до тех пор, пока клетка в процессе созревания не превращается в эритроцит. При окрашивании клетки рибосомы и мРНК выглядят как темный пигментированный ретикулум. Отсюда и произошло название этих клеток - ретикулоциты. В зрелой клетке нет митохондрий, и для выработки энергии она использует гликолиз с образованием лактата. В зрелом эритроците активен пентозофосфатный путь, в ходе которого происходит восстановление NАDРН.
Гем и его синтез
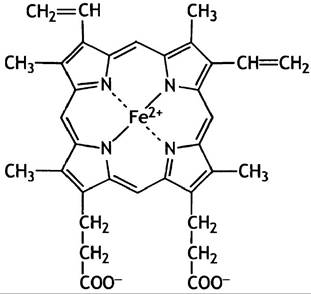
Полная структура гема (рис. 27.3.), которую помнят далеко не все биохимики, представляет собой комплекс двухвалентного железа с протопорфирином (рис. 27.2).
Рис. 27. 2. Изображение контура молекулы гема
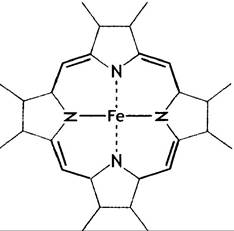
Рис. 27. 3. Структура гема. Эта форма найдена в гемоглобине; другие гемы, различающиеся своими боковыми цепями, обнаружены в цитохромах. На одной стороне молекулы находятся 2 нуклеофильных остатка пропионовой кислоты (СН2-СН2-СОО-), другие боковые цепи гидрофобны. В миоглобине гем расположен в углублении молекулы, причем его гидрофильная часть обращена к поверхности, а гидрофобные группы - внутрь молекулы белка
Последний образован 4 пиррольными кольцами; 4 замещенных пиррола связаны метиленовыми (=СН-) мостиками, так что создается система сопряженных двойных связей(т. е. при движении по кругу одинарные и двойные связи в молекуле чередуются). Это придает порфирину и гему темнокрасный цвет.
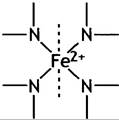
В геме 4 пиррольных атома N связаны с Fе2+ (рис. 27.4), оставляя 2 из 6 связей Fе2+ свободными и доступными для других лигандов.
Рис. 27. 4. Связывание Fе2+ в геме. Атом железа в геме может связаться с 6 лигандами: 4 связи заняты атомами пиррольного азота, а 2 другие расположены над и под плоскостью листа соответственно
Синтез гема
На долю эритроцитов приходится наибольшее количество гема, содержащегося в организме человека. Поэтому рассмотрение вопроса о его синтезе в этой главе вполне уместно, хотя гем простетических групп цитохромов и других белков синтезируется и в других клетках.
Синтез гема представляется нелегкой задачей, для решения которой животным необходимо, как ни удивительно, только два исходных реагента: глицин и сукцинил-СоА. С последним вы встречались при рассмотрении цикла лимонной кислоты (см. с. 120). Эти вещества необходимы для синтеза аминолевулиновой кислоты (англ. aminolevulinic acid; ALA), реакцию образования которой катализирует фермент аминолевулинатсинтаза(ALA-синтаза) (рис. 27.5).
Рис. 27. 5. Первая стадия синтеза гема, катализируемая 5-аминолевулинатсинтазой (АLА-синтазой). Структуры приведены в неионизированной форме
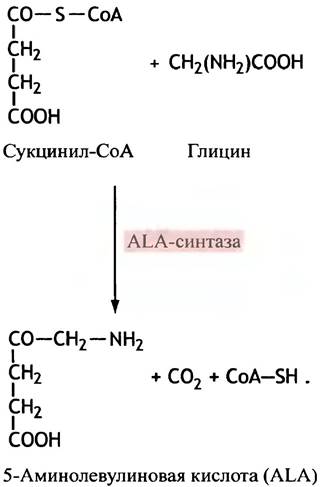
5-Аминолевулиновая кислота — единственный предшественник синтеза порфирина. Две ее молекулы, использующиеся для образования пиррола - порфобилиногена (ПБГ),подвергаются дегидратации под действием АLА-дегидратазы (рис. 27.6). Остальные стадии биосинтеза гема включают в себя соединение 4 молекул ПБГ в единую структуру, модификацию групп боковых цепей и образование хелатных комплексов с двухвалентным атомом железа. Промежуточными тетрапирролами на стадиях между образованием ПБГ и формированием гема являются бесцветные уро- и копропорфириногены (содержащие метиленовые мостики) и красный протопорфирин (содержащий метеновые мостики). Путь синтеза гема представлен на рис. 27.7. Метаболический путь синтеза гема имеет любопытные особенности.
Рис. 27.6. Синтез порфобилиногена (ПБГ) - стадия дегидратации, катализируемая АLА-дегидратазой. Представлены деионизированные структуры. Порфобилиноген является монопирролом; гемоглобин - тетрапиррол
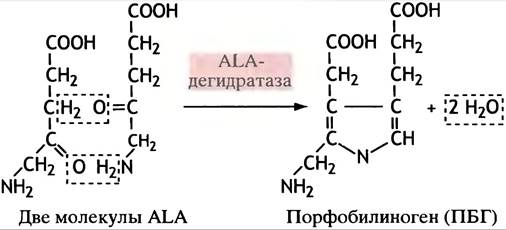
Рис. 27.7. Биосинтез гема
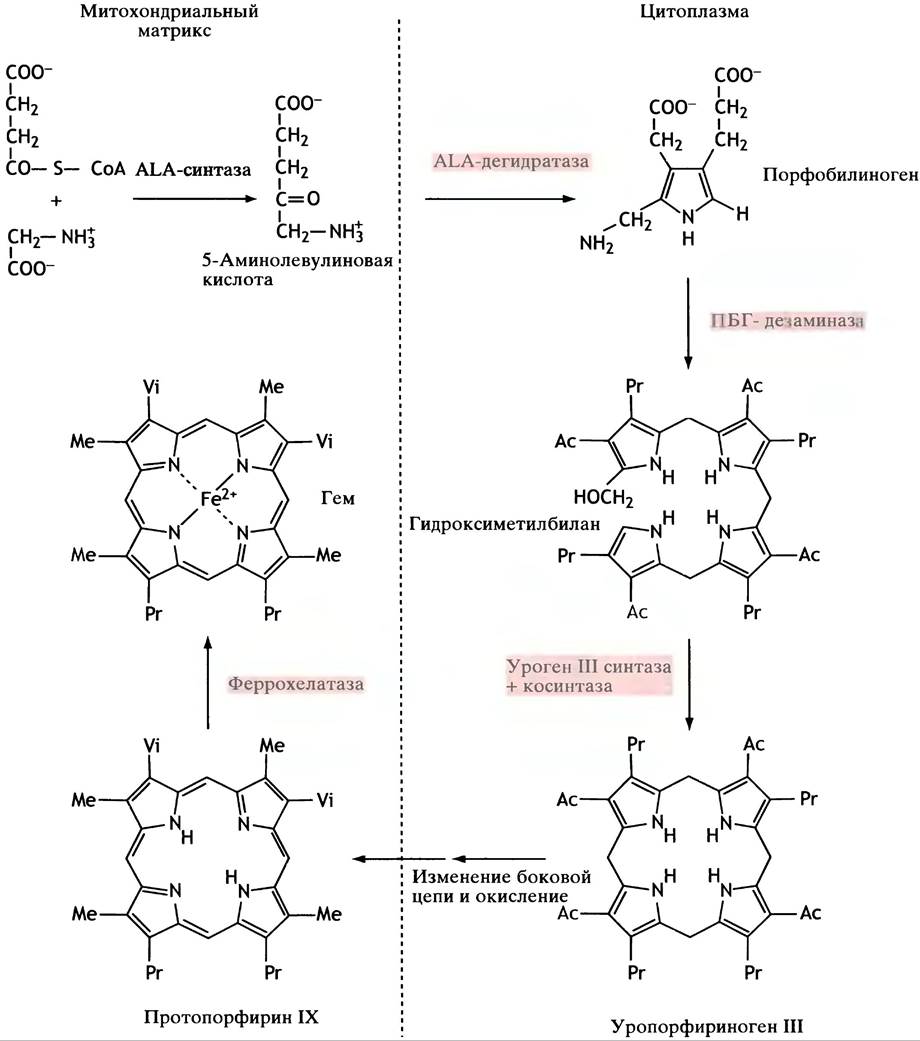
Первая реакция - синтез ALA - происходит внутри митохондрий, после чего ALA поступает в цитоплазму. Однако конечные три стадии снова протекают в митохондриях. Почему так происходит, пока неясно.
Регуляция биосинтеза гема и доставка железа в эритроцит
Регуляция биосинтеза гема представляет особый интерес, поскольку она непосредственно связана с поступлением и хранением железа в клетке.
Происходит это так.
✵ Активность ALA-синтазы лимитирует весь процесс синтеза гема.
✵ Синтез ALA-синтазы, а, следовательно, и ее уровень регулируется количеством железа.
✵ Уровень железа зависит от количества белка-рецептора трансферрина.
✵ Уровень железа по механизму обратной связи регулирует синтез трансферрина.
При биосинтезе гема скорость-лимитирующей стадией является синтез ALA. Образование самого фермента ALA-синтазы регулируется в красных кровяных клетках на уровне трансляции. На 5-нетранслируемом конце (т. е. на участке инициации трансляции) мРНК фермента имеет шпилечную петлю, названную железо-чувствительным элементом (IRE; англ. iron-responsive element). При низком уровне железа IRE-связывающий белок присоединяется к IRE и предотвращает трансляцию (рис. 27.8). При высоком уровне железа белок высвобождается в результате его взаимодействия с железосерным кластером (небольшим комплексом, состоящим из железа, цистеина
и неорганической серы), после чего начинается трансляция: таким образом достигается соответствие между скоростью синтеза гема и запасом железа.
Рис. 27.8. Регуляция синтеза гема изменением концентрации железа в эритроцитах. Регуляторный механизм, по-видимому, зависит от ALA-синтазы, имеющей короткий полупериод жизни: как только прекращается синтез фермента, тут же останавливается и синтез гема. Фермент, как известно, в лизатах ретикулоцитов в условиях in vitro, а также, по-видимому, и в самих эритроцитах, нестабилен. Вопрос о том, как контролируется уровень железа в клетке, рассматривается отдельно. IRE - железо-чувствительный элемент, представляющий собой шпилечную петлю мРНК. Когда IRE-связываюший белок прикрепляется к IRE, он, вероятно, стерически препятствует присоединению белков инициации трансляции. Связывание железа с IRE-связывающим белком снижает его сродство к IRE
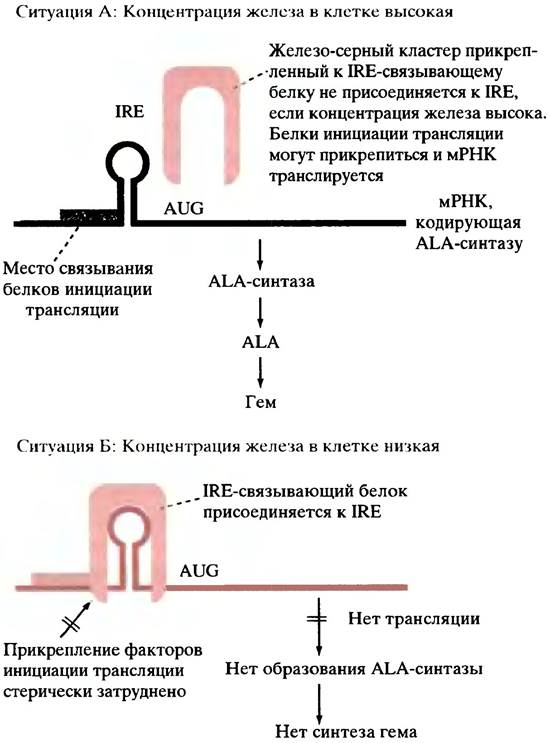
Синтез гема начинается задолго до образования ретикулоцита в проэритробласте, содержащем ядро, так что трансляция мРНК происходит в этих клетках и продолжается на стадии ретикулоцита.
Возникает вопрос: каким образом регулируется уровень железа в клетке? Железо транспортируется в плазме крови в виде комплекса с белком трансферрином, который образуется в печени. Этот комплекс захватывается клетками в ходе рецептор-опосредованного эндоцитоза. В неэритроидных клетках захват определяется уровнем белка-рецептора трансферрина, синтез которого регулируется уровнем железа в клетке. Железо осуществляет контроль за стабильностью мРНК белка-рецептора трансферрина, которая содержит на 3'-конце молекулы железо-чувствительный элемент. При низком уровне железа в клетке IRЕ-связывающий белок присоединяется к мРНК белка-рецептора, защищая ее от деградации. В тех случаях, когда уровень железа в клетке высок, IRЕ-связывающий белок отсоединяется, что приводит к снижению стабильности мРНК белка-рецептора трансферрина. Таким образом, железо вызывает даунрегуляцию, или снижение числа рецепторов трансферрина, которые, в свою очередь, снижают потребление железа клетками. При низком уровне железа все происходит в обратном порядке. Пока не установлено, применим ли этот механизм к эритроидным клеткам, однако известно, что в эритроцитах есть рецепторы трансферрина, число которых увеличивается в процессе созревания клетки.
Запасы железа в эритроцитах находятся в виде ферритина - комплекса белка апоферритина и неорганического железа. Печень также является важным местом хранения железа. Интересно, что синтез апоферритина регулируется, в сущности, по такому же механизму, как и синтез фермента АLА-синтазы: железо вызывает присоединение IRЕ-связывающего белка к мРНК апоферритина, способствуя синтезу белка.
Все клетки человека синтезируют гем тем же путем, что и клетки крови (исключая незначительные отличия). Гем нужен для цитохромов в цепи транспорта электронов (см. с. 123), а также и для других ферментов. Эритроциты более всего нуждаются в заполнении зрелой клетки гем-содержащим белком - гемоглобином. Вслед за красными кровяными клетками по количеству гема идет печень, благодаря высокому содержанию в ней цитохрома Р450 (см. с. 210). Регуляция АLА-синтазы в разных клетках имеет определенные отличия. В печени гем дестабилизирует мРНК ALA-синтазы, а также тормозит транспорт молекул фермента к «месту назначения» - в митохондрии. мРНК фермента не имеет железо-чувствительного элемента, который существует в эритроидных клетках. Избыточная продукция ALA-синтазы и высокий уровень ALA в крови при острой перемежающейся порфирии у пациентов коррелирует с появлением свойственных этому заболеванию неврологических симптомов (их молекулярная основа пока неизвестна). У таких больных частично блокирован путь биосинтеза гема. Хлорофилл также является тетрапирролом, однако интересно, что ALA у растений синтезируется в ходе другой реакции.
Но вернемся к красным кровяным клеткам.
Распад гема
Эритроциты разрушаются главным образом ретикулоэндотелиальными клетками селезенки, лимфатических узлов, костного мозга и печени. Удаление сиаловых кислот из гликопротеинов эритроцитарной мембраны служит сигналом старения эритроцитов. Лишенные сиаловых кислот углеводные компоненты связываются с рецепторами этих клеток, что приводит к эндоцитозу старых эритроцитов.
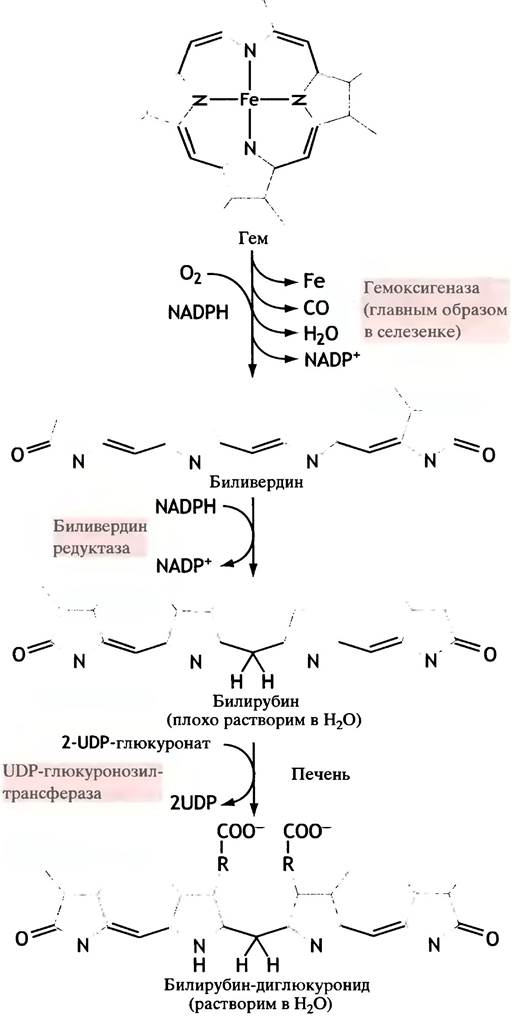
Фермент гемоксигеназа раскрывает тетрапиррольное кольцо, высвобождая железо для повторного использования и образуя линейный тетрапиррол - биливердин (рис. 27.9). Биливердин восстанавливается в билирубин. Последний не растворим в воде. Связываясь с сывороточным альбумином, он переносится кровью в печень, где после присоединения двух остатков глюкуроновой кислоты становится гораздо более полярным, а затем экскретируется с желчью в кишечник. Модификация и частичная реабсорбция некоторых составных компонентов желчи придает желтый цвет моче (предполагается, что билирубин функционирует в качестве антиоксиданта, см. с. 213).
Рис. 27.9. Реакция, катализируемая гемоксигеназой, и последующее восстановление биливердина. Двойные связи в структурах колец не показаны. В результате реакции одна метиленовая группа превращается в окись углерода, и таким образом раскрывается структура кольца. Биливердин восстанавливается в билирубин, связывается с 2 молекулами глюкуроновой кислоты и выводится из организма. Существует, однако, некоторая неясность в стехиометрии гем- оксигеназной реакции; полагают, что в реакции участвуют 3 молекулы O2. По аналогии с цитохромом Р450 можно предположить, что для превращения 3 атомов кислорода в Н2O требуются 3 молекулы NАDРН
Как регулируется синтез глобина
Гемоглобин состоит из гема, связанного с белком глобином. Два компонента - глобин и гем - должны образовываться примерно в одинаковых количествах, для чего и существует координирующая регуляторная связь. В опытах с лизатами ретикулоцитов было показано, что в отсутствие гема протеинкиназа фосфорилирует один из факторов (еIF2) инициации синтеза белка. Он обладает способностью останавливать инициацию трансляции в красных кровяных клетках и таким образом предотвращать синтез глобина. В присутствии гема киназа инактивируется, а фосфатаза нормализует активность фактора инициации. Таким образом, синтез глобина происходит лишь в присутствии гема. Этот механизм специфичен для эритроидных клеток.
Транспорт газов в кровь
Растворимости кислорода в обычных растворах недостаточно, чтобы обеспечить им ткани организма. Необходимы переносчики кислорода в крови. Аналогичным образом СO2 не может транспортироваться с достаточной скоростью от тканей к легким в простом растворе.
Каково химическое обоснование роли гемопротеинового комплекса как переносчика кислорода?
Неорганический ион Fе2+, но не Fе3+, может связываться с кислородом. Однако ионы Fе2+ спонтанно окисляются в Fе3+, так что неорганическое железо само по себе не является хорошим переносчиком кислорода. Fе2+ в составе гема может также связывать кислород, но и оно быстро окисляется до Fе3+, образуя гематин. Поэтому свободный гем также не является хорошим переносчиком кислорода. Для окисления гема необходимо, чтобы 2 его молекулы взаимодействовали с 1 молекулой кислорода. Связывание гема, расположенного в углублении белка, предотвращает такое взаимодействие, поэтому ионы Fе2+ в составе гема гемоглобина гораздо более устойчивы к окислению, чем свободный гем. Важно прояснить, почему гем в цитохромах при транспорте электронов (см. с. 123) находится поочередно в состояниях Fе 2+ и Fе3+, а гем в гемоглобине функционирует только в состоянии Ре2+, на которое взаимодействие с кислородом не влияет. Дело в том, что атом железа в гемоглобине связан с 4 атомами азота пиррольных колец, а пятая и шестая координационные связи расположены непосредственно над и под плоскостью структуры гема; одна из этих связей соединена с остатком гистидина, а другая доступна для связывания с кислородом.
Структура миоглобина и его роль в связывании кислорода
Миоглобин является красным пигментом мышц. Предварительное знакомство с его структурой поможет понять более сложную организацию гемоглобина.
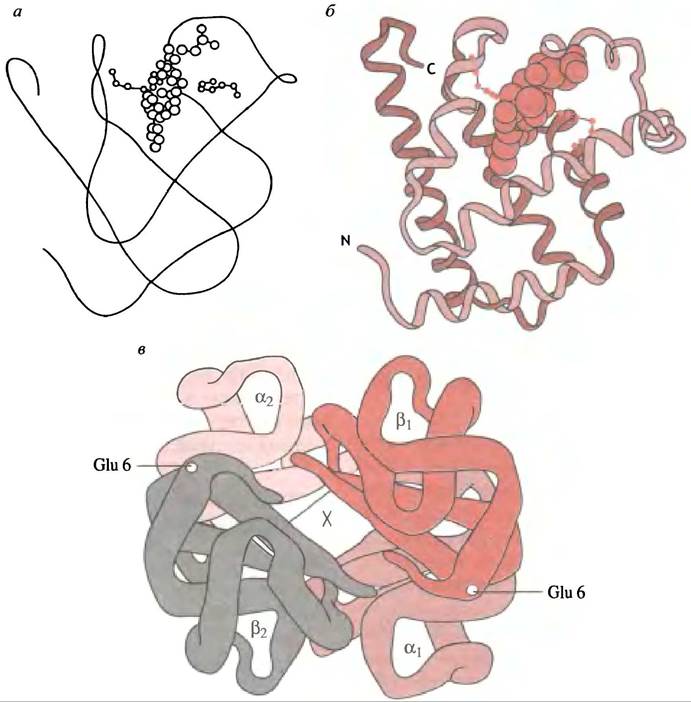
Миоглобин просто снабжает мышечную клетку кислородом. Он захватывает кислород из крови и переносит его внутрь клетки, где тот используется митохондриями для выработки энергии. Миоглобин - сложный белок, состоящий из одной полипептидной цепи и связанной с ней молекулой гема. Белок имеет сферическую форму и содержит ряд α-спиралей (рис. 27.10), а молекула гема расположена в углублении между двумя из них.
Рис. 27.10. Модели молекул миоглобина и гемоглобина. а - Простая компьютерная модель, демонстрирующая укладку (фолдинг) полипептидной цепи и положение гема в молекуле миоглобина; б - более сложная модель миоглобина; в - модель, показывающая расположение субъединиц в молекуле гемоглобина. В углублении в центре молекулы встраивается 2,3-дифосфоглицерат в дезоксигенированном состоянии (помечено X). При серповидной клеточной анемии два остатка глутаминовой кислоты в положении 6 в β-цепях заменены на валины, создавая гидрофобные участки на молекуле
Насыщение миоглобина кислородом при увеличении парциального давления последнего характеризуется гиперболической кривой (рис. 27.11) такого же типа, как в случае кривой зависимости активности фермента от концентрации субстрата, описанной ранее для «классического» фермента (см. с. 157). Миоглобин обладает высоким сродством к кислороду и потому без труда забирает его из оксигемоглобина крови (см. рис 27. 11, демонстрирующий относительное сродство к кислороду двух переносчиков). В мышцах, где концентрация кислорода падает в процессе транспорта электронов и образования Н2O, миоглобин отдает связанный кислород. Таким образом, он функционирует как очень простой переносчик кислорода.
Миоглобин стал первым белком, для которого была определена трехмерная структура, и это достижение считается поворотным пунктом в биохимии.
Структура гемоглобина
Гемоглобин состоит из 4 белковых субъединиц (см. рис. 27.10), каждая из которых напоминает свернутую полипептидную структуру миоглобина и содержит гем, способный связывать кислород. Молекула гемоглобина взрослого человека состоит из 2 идентичных α- и 2 идентичных β-субъединиц.
Связывание кислорода с гемоглобином
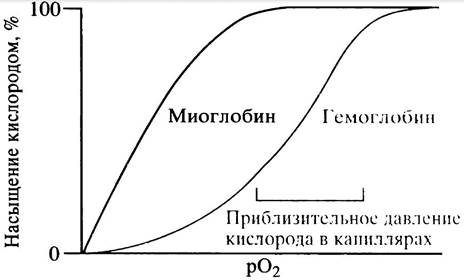
Молекула гемоглобина связывает 4 молекулы кислорода, по одной на каждую субъединицу. Насыщение гемоглобина кислородом описывается не гиперболической кривой, как в случае миоглобина, а сигмоидной, причем эта кривая сдвинута вправо по отношению к кривой, характерной для миоглобина (см. рис. 27.11). Для достижения 50% насыщения гемоглобина кислородом необходима более высокая концентрация последнего, чем в случае миоглобина, что указывает на более высокое сродство миоглобина к кислороду. Гемоглобину необходимо забрать как можно больше кислорода из легких и отдать его капиллярам в тканях. Наибольшая крутизна сигмоидной кривой (свидетельствующая о наибольшей отдаче кислорода) наблюдается при давлении O2, соответствующем его давлению в капиллярах (см. рис. 27.11). Насыщение гемоглобина кислородом происходит при более высоком давлении кислорода в легких.
Рис. 27.11. Кривая насыщения гемоглобина кислородом. Более высокое сродство к кислороду у миоглобина, по сравнению с гемоглобином, означает, что миоглобин в мышцах легче забирает кислород из крови
Как появляется сигмоидная кривая насыщения кислородом
Вы познакомились с кинетикой, описываемой сигмоидной кривой, при обсуждении регуляции метаболизма (глава 12). Там упоминалось, что аллостерические ферменты, как правило, являются мультисубъединичными белками, которые подвергаются конформационному изменению при связывании с молекулой субстрата. Это приводит к изменению сродства фермента к последующим молекулам субстрата. То же самое применимо и к связыванию кислорода с гемоглобином.
Несмотря на то, что молекулы гема в гемоглобине достаточно удалены друг от друга, первоначальное связывание кислорода с одной субъединицей ускоряет связывание молекул кислорода с остальными субъединицами. Это явление известно, как гомотропный положительный кооперативный эффект (гомотропный потому, что участвует только кислород). Именно это обусловливает сигмоидный характер кривой. Эффект заключается в том, что первоначальное сродство дезоксигемоглобина к кислороду в 200 раз ниже, чем сродство на заключительном этапе связывания. Насыщение кислородом (оксигенация), соответствующее конечному отрезку кривой, ограничено числом участков его связывания.
Механизм аллостерического изменения молекулы гемоглобина
Как уже упоминалось, присоединение одной молекулы кислорода к молекуле гемоглобина облегчает связывание кислорода остальными субъединицами молекулы
гемоглобина. В соответствии с согласованной моделью (см. с. 159), гемоглобин существует в двух конформационных состояниях: «напряженном», или Т-состоянии (англ. tense) с низким сродством к кислороду, и «расслабленном», или R-состоянии (англ, relax) с высоким сродством к кислороду. Оба состояния находятся в свободном равновесии. В отсутствие кислорода преобладает Т-состояние. При связывании кислорода увеличивается вероятность того, что все четыре субъединицы молекулы гемоглобина будут находиться в R-состоянии (высокого сродства); при этом равновесие Т <-> R сдвигается вправо.
![]()
Поскольку исследование насыщения гемоглобина кислородом проводится на большом числе молекул, то возможно, чем больше кислорода связывается, тем большее число молекул гемоглобина находится в R-cocтoянии, а, следовательно, увеличивается и сродство к кислороду в растворе. Подобная ситуация характерна для аллостерических ферментов (см. с. 159-160). С использованием метода рентгеноструктурного анализа была определена конформация тетрамерной структуры гемоглобина в оксигенированном и дезоксигенированном состояниях. Как уже упоминалось ранее, гемоглобин является тетрамером и состоит из 2 идентичных α- и 2 идентичных β-субъединиц. В тетрамере их обозначают как α1, α2, β1 и β2. По данным рентгеноструктурного анализа, контакты между α- и β-субъединицами слегка различаются между собой.
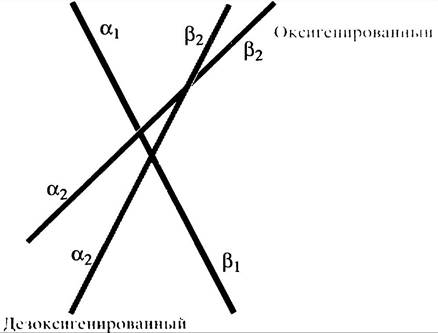
Чтобы составить более ясное представление о гемоглобине, целесообразно рассматривать его структуру в виде двух гетеродимеров, образованных α- и β-субъединицами: α1β1и v2β2. Именно взаимодействие между двумя гетеродимерами в тетрамере приводит к перегруппировке Т <-> R. Относительное перемещение димеров при переходе из Т- в R-cocтoяниe обусловленно связыванием кислорода (рис. 27.12).
Рис. 27.12. Схематическое изображение относительного расположения субъединиц в дезоксигенированной и оксигенированной молекулах гемоглобина, оси которых представлены прямыми линиями. Пары субъединиц α1, β1 и α2, β2 должны рассматриваться как единичный димер субъединиц. При окислении эти димеры вращаются с наклоном около 15° относительно друг друга. Черная и серая линии показывают относительное расположение димеров в Т-состоянии. В оксигенированном (R) состоянии красная линия показывает вращение (χ2/β2 димера по отношению к (χ/β1 димеру, который изображается фиксированной линией. Перемещение изменяет контакты α1β2/α2β1между димерами
Что вызывает это аллостерическое изменение в целой молекуле гемоглобина при связывании его с одной или несколькими молекулами кислорода? Изменение инициируется небольшим перемещением атома железа при связывании кислорода с гемом, что и обусловливает переход Т <-> R. Хотя гем, как уже упоминалось, является плоской молекулой, в дезоксигенированном состоянии атом железа располагается над плоскостью молекулы, поскольку размер атома слишком велик, чтобы встроиться в тетрапиррольную структуру. В дезоксигенированном гемоглобине тетрапиррольная структура не совсем плоская (рис. 27.13).
Рис. 27.13. Структурные изменения в геме молекулы гемоглобина при оксигенации (схематическое изображение). а - Молекула гема в дезоксигемоглобине с тетрапиррольной структурой, вытянутой в слегка колоколообразную форму; б - присоединение гема в оксигемоглобине
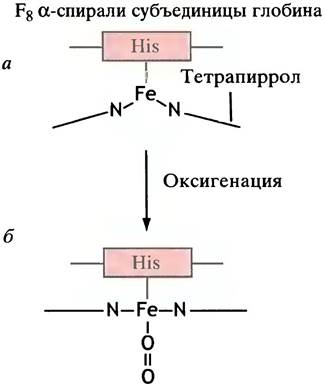
Атом Fе2+ связывается с остатком гистидина одной из α-спиралей, входящих в состав субъединицы. Эту α-спираль обозначают как F, а гистидиновую группу - F8 (рис. 27.13, а). Благодаря электронным изменениям, происходящим при связывании кислорода, атом железа в геме существенно уменьшается в диаметре и входит в плоскость тетрапиррола, что делает всю молекулу более плоской. При этом перестраивается и сама молекула белка (см. рис. 27.13).
Этот незначительный сдвиг атома железа приводит к большим структурным изменениям где-нибудь в другом месте молекулы белка за счет «рычагоподобного» эффекта, влияющего на структуру полипептидной цепи. Это «где-нибудь» является точкой, в которой α-субъединица одного димера взаимодействует с β-субъединицей другого (на границе α1β2/α2β1). При таком взаимодействии образуется ряд слабых связей между аминокислотными остатками двух субъединиц. В Т-состоянии мы имеем один набор, в R-состоянии - другой. Эти связи удерживают димеры вместе. Таким образом, инициированное атомом железа перемещение приводит к замене одного набора связей между димерами на другой, что вызывает относительную ротацию димеров (см. рис. 27.12).
Следует отметить, что существование структур, соответствующих Т- и R- состояниям гемоглобина полностью доказано методами рентгеноструктурного анализа кристаллов гемоглобина и оксигемоглобина соответственно.
Однако получить кристаллы частично окисленного гемоглобина невозможно, и потому структура (или структуры) последнего неизвестны. Поэтому промежуточные стадии (если они есть вообще), при которых происходят взаимопревращения Т- и R-форм, не установлены.
Важная роль 2,3-дифосфоглицерата (ДФГ) в функции гемоглобина
Вы уже знакомы с промежуточным продуктом гликолиза 1,3-дифосфоглицератом (см. рис. 8.6), однако до сих пор мы еще не говорили о том, что в клетке также синтезируется 2,3-фосфоглицерат (ДФГ).
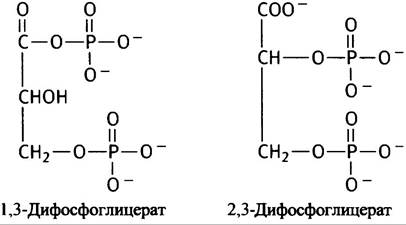
ДФГ играет важную физиологическую роль в транспорте кислорода, снижая сродство к нему гемоглобина и, таким образом, повышая отдачу кислорода тканям. ДФГ сдвигает кривую диссоциации оксигемоглобина вправо. Вдоль всей тетрамерной молекулы гемоглобина есть углубление (см. рис. 27.10). Боковые группы положительно заряженных аминокислот проецируются внутрь этого углубления. Молекула ДФГ, несущая при pH крови 4 отрицательных заряда, по своей величине и конфигурации соответствует размеру углубления и образует ионные связи с положительно заряженными участками белка. При этом удерживать гемоглобин в дезоксигенированном состоянии помогает перекрестное сшивание β-субъединиц. В дезоксигенированном (Т) состоянии гемоглобин может вместить молекулу ДФГ. Однако при оксигенации в R-состоянии, в результате конформационных изменений в белке, углубление становится меньше и не может вместить молекулу ДФГ. Способность ДФГ прочно связываться и стабилизировать дезоксигенированное состояние благоприятствует освобождению кислорода в капиллярах. В результате имеет место следующий процесс.
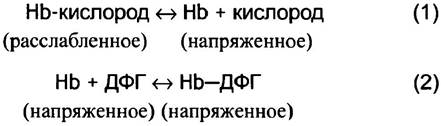
Реакция (2) с ДФГ способствует сдвигу равновесия реакции (1) в сторону высвобождения кислорода.
Если кровь израсходовала весь запас ДФГ, гемоглобин остается фактически насыщенным кислородом даже при более низкой, чем в капиллярах ткани, концентрации: вследствие этого он неспособен достаточно эффективно отдавать кислород тканям.
Влияние ДФГ на связывание кислорода с гемоглобином показано на рис 27. 14.
Рис. 27.14. Кривые насыщения гемоглобина кислородом, иллюстрирующие эффект 2,3-дифосфоглицерата (ДФГ)
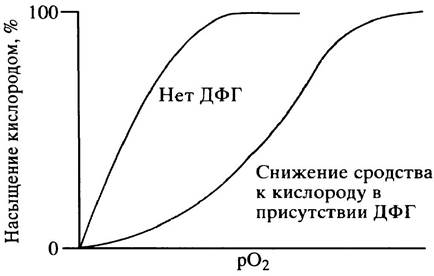
Чем выше концентрация ДФГ, тем более выражено преобладание дезоксигенированной формы гемоглобина. Создается регуляторная система: при низком давлении кислорода в тканях в красных кровяных клетках синтезируется большее количество ДФГ (посредством регуляторного механизма, способствующего увеличению отдачи кислорода, детали которого мы не рассматриваем). При акклиматизации к условиям высокогорья содержание ДФГ в красных кровяных клетках увеличивается. Следует заметить, что, хотя ДФГ и вызывает большую отдачу кислорода тканям, сниженное сродство гемоглобина к кислороду практически не влияет на степень оксигенации гемоглобина в легких. Нормальная молярная концентрация ДФГ в крови примерно эквивалентна концентрации тетрамерного гемоглобина.
В регуляторной системе ДФГ есть еще одна тонкость, которая показывает, как небольшие изменения в белках могут вызвать значительные физиологические эффекты. При снабжении плода кислородом необходимо, чтобы гемоглобин плода забирал кислород из оксигемоглобина матери через плаценту. Для этого гемоглобин плода должен иметь более высокое сродство к кислороду, чем материнский переносчик. Это достигается замещением β-субъединиц гемоглобина взрослого человека y-субъединицами плода, в каждой из которых отсутствует один из положительных зарядов β-субъединицы. Отсутствуют как раз те заряды, которые у гемоглобина взрослого человека находятся в углублении, куда встраивается ДФГ. Имея на 2 ионные группировки меньше, гемоглобин плода связывает ДФГ менее прочно. Поэтому ДФГ менее эффективно снижает сродство гемоглобина к кислороду, что обеспечивает гемоглобину плода более высокое сродство к нему по сравнению с материнским гемоглобином, который легко отдает свой кислород.
Влияние pH на связывание кислорода с гемоглобином
Гемоглобин в дезоксигенированном состоянии имеет более высокое сродство к протонам, чем оксигемоппобин. Другими словами, R-форма является более сильной кислотой, чем Т-форма (дезоксигенированная); в результате при связывании с кислородом происходит диссоциация протонов от молекулы гемоглобина. Этот феномен известен как эффект Бора:
Нb + 4O2 <-> Нb(O2)4 + (Н+)n (1)
где n - величина порядка 2; число зависит от целого комплекса параметров.
Протоны высвобождаются, например, из остатков гистидина в белке. Причиной высвобождения являются конформационные изменения, возникающие при переходе из состояния Т- в R-состояние влияющие на ионизацию (рKа) таких групп (о диссоциации гистидина см. с. 40).
Роль изменений pH в транспорте кислорода и СO2
Эффект Бора, описанный выше, имеет важное физиологическое значение. Образующийся в тканях СO2 должен транспортироваться в легкие. Он поступает в эритроциты, где фермент карбоангидраза превращает его в Н2СО3, который диссоциируется на бикарбонат-ион и протон:
СO2 + Н2O <-> Н2СO3 + НСО3- (2)
Последний сдвигает равновесие в уравнении (1) влево, заставляя НbO2 отдавать свой кислород - эффект, соответствующий физиологическим потребностями.
НСО3- пассивно продвигается через анионный канал (см. с. 63) по градиенту концентраций в сыворотку. Продвижение НСО3- не сопровождается перемещением Н+, поскольку нет канала, позволяющего ему пройти через мембрану эритроцита. Для сохранения электрического баланса (равновесия) при выходе НСО3- из клетки, Сl- перемещается внутрь ее через тот же анионный канал. Такое двойное перемещение известно, как хлоридный сдвиг (рис. 27. 15).
Рис. 27.15. Транспорт СO2 в крови. а - Реакции в капиллярах тканей; б - реакции в легких. На рисунке не показан транспорт СO2 в виде карбаминовых групп гемоглобина
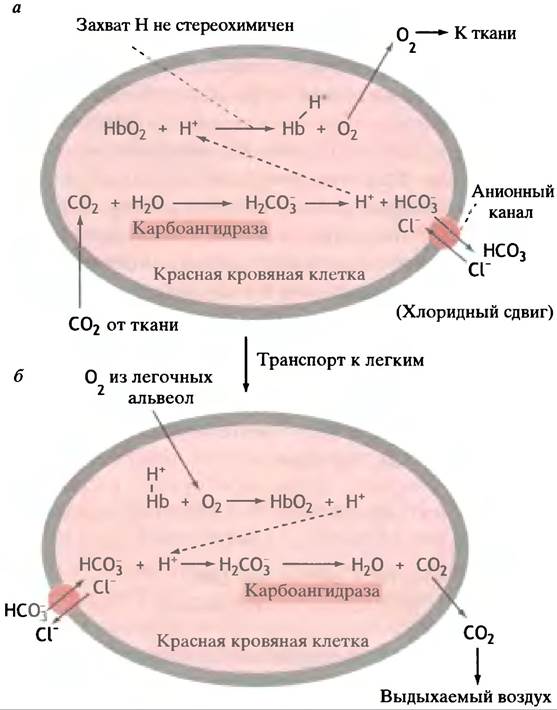
Растворенный НСО3- движется вместе с венозной кровью обратно в легкие. Здесь изменения концентрации протонов также помогают достичь желаемых физиологических результатов. Высвобождение протона из гемоглобина при оксигенации приводит к двум основным результатам. Происходит образование НСO3 из НСO3 за счет простого равновесного процесса:
НСО3- + Н+ <-> НСO3
Это позволяет карбоангидразе образовать СO2. Следует отметить, что субстратом карбоангидразы является НСО3 (но не НСO3):
НСO3 <-> Н2O + СO2
Разрушение НСО3- в красной кровяной клетке обусловливает вхождение в нее НСO3- из сыворотки и выход Сl- по градиенту концентраций, так что в легких происходит обратный хлоридный сдвиг, приводящий к выведению СO2 с выдыхаемым воздухом.
Небольшие количества СO2 переносятся с кровью в растворенном виде, однако большая часть (около 75%) транспортируются в виде НСО3-. Около 10-15% СO2 переносит гемоглобин. СO2 спонтанно взаимодействует с незаряженными NН2-группами глобина с образованием карбаминовых групп:
RNН2 + СO2 <-> RNНСООН <-> RNНСОO- + Н+
В этой реакции участвуют остатки лизина и аргинина, боковые аминогруппы которых имеют высокие значения рКа и потому остаются преимущественно в незаряженном состоянии. Доступные RNН2-группы - это в основном концевые аминогруппы (боковые группы лизина и аргинина имеют слишком высокую рКа, чтобы быть незаряженными).
Поддержание pH в крови
Из всего вышеизложенного ясно, что значительные изменения в концентрации иона водорода в крови связаны с транспортом СO2 и кислорода. При образовании кислоты в тканях значение pH в красных кровяных клетках должно снижаться. Буферные свойства НСО3-, фосфатов и самого гемоглобина играют существенную роль в поддержании физиологического значения pH. Эффект Бора, описанный выше, также играет роль буфера. При высвобождении кислорода гемоглобин принимает протоны (см. уравнение 1), что составляет примерно половину ионов Н+, генерированных за счет СO2 в тканях, и это поддерживает pH в красных кровяных клетках на уровне физиологических значений.
Серповидноклеточная анемия
Это заболевание обычно приводится в учебниках для иллюстрации того, как замена в белке одной аминокислоты на другую вызывает серьезные последствия. В норме в β-субъединицах тетрамерной структуры гемоглобина аминокислотой в шестом положении является глутаминовая кислота, боковая группа которой заряжена отрицательно и характеризуется высокой гидрофильностью (см. рис. 27.10, в). В гемоглобине больных серповидноклеточной анемией глутаминовдя кислота заменена гидрофобным остатком валина. Кодонами в мРНК для глутаминовой кислоты являются триплеты GAA и GAG. Замена в результате мутации центрального основания А на U - это все, что требуется для замены аминокислоты, поскольку триплеты GUА и GUG являются кодонами валина. Обусловленное валином появление аномального гидрофобного участка на субъединице глобина становится причиной того, что дезоксигенированная молекула гемоглобина связывается с гидрофобным карманом на другой молекуле, приводя к образованию длинной переплетенной жесткой структуры. Оксигенированный гемоглобин, благодаря другой конформационной структуре, препятствует этому. Длинная дезоксигемоглобиновая структура нарушает нормальную форму эритроцитов, превращая ее из двояковогнутого диска в серповидную, которая способна блокировать капилляры. Такие эритроциты преждевременно разрушаются, способствуя развитию анемии. Если поражены обе гомологичные хромосомы, заболевание может оказаться смертельным, особенно при низком давлении кислорода в условиях высокогорья, где дезоксигенация гемоглобина необычайно высока. Заболевание широко распространено в географических зонах, где наиболее часто встречается злокачественная форма малярии. Высокий показатель заболеваемости можно объяснить положительной селекцией генома носителей аномальных генов. Серповидная красная кровяная клетка «неудобна» для развития малярийного плазмодия. Поскольку при малярийной интоксикации смертность среди здоровых людей существенно выше, чем среди страдающих гетерозиготной серповидно-клеточной анемией, можно заключить, что последняя повышает выживаемость людей, заболевших малярией.
Вопросы к главе 27
1. Опишите первые две стадии биосинтеза гема у животных.
2. Каково медицинское значение регуляции синтеза АLА-синтазы в печени?
3. Объясните, каким образом уровень железа регулирует активность АLА-синтазы красных кровяных клеток.
4. Сравните кривые диссоциации кислорода у миоглобина и гемоглобина.
5. Каков возможный механизм связывания кислорода с гемоглобином, описываемый сигмоидной кривой?
6. Связывание молекулы кислорода с гемоглобином вызывает конформационные изменения в белке. Опишите механизм этих изменений.
7. Объясните, как гемоглобин плода может связываться с кислородом, получаемым от материнского переносчика.
8. Объясните значение хлоридного сдвига в красных кровяных клетках.