БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 28. МЫШЕЧНОЕ СОКРАЩЕНИЕ
Мышцы - высоко специализированные органы, в которых приспособления для механического движения развиты наиболее сильно. В этой главе мы рассмотрим молекулярные основы мышечного сокращения, а в следующей - двигательные системы немышечных клеток.
Напоминание о конформационных перестройках в белках
Мышечное сокращение осуществляется благодаря согласованным перемещениям белковых молекул, возникающим в результате изменения их конформации. Эти конформационные изменения обусловлены взаимодействием белковых молекул с различными лигандами.
Для того чтобы «молекулярный двигатель» осуществлял движение при помощи конформационных изменений белка, необходима параллельная противодействующая структура: если зафиксировать молекулу- двигатель, то будет перемещаться молекула-партнер, и наоборот. Прежде чем говорить о механизме мышечного сокращения, отметим, что зафиксированным «двигателем» является миозин, а противодействующей движущейся структурой - актиновое волокно (филамент).
Типы мышечных клеток и их энергообеспечение
Существуют два основных типа мышечных клеток - гладкие и поперечнополосатые. Первые обнаружены в кишечнике и кровеносных сосудах; они сокращаются непроизвольно и находятся под контролем вегетативной нервной системы. Гладкие мышцы сокращаются медленно, но могут поддерживать сокращение в течение длительного времени. Свое название они получили потому, что при микроскопическом исследовании у них не обнаружено поперечной исчерченности (в отличие от другого типа мышц). Поперечнополосатые мышцы сокращаются быстро и являются основой скелетной мускулатуры, произвольные сокращения которой регулируются двигательными нервами. Сердечной мышце также свойственна исчерченность, однако, в отличие от скелетных мышц, она сокращается непроизвольно, и структура мышечных клеток миокарда имеет свои отличительные особенности.
В произвольной поперечнополосатой скелетной мускулатуре различают два основных типа волокон - быстро и медленно переключающиеся. Белые поперечнополосатые мышцы животных состоят из быстро переключающихся волокон с недостаточным кровоснабжением: АТР в них образуется в ходе гликолиза. Эти мышцы осуществляют мгновенные реакции спасения (бегство или борьбу), но из-за низкого выхода АТР при гликолизе и накопления молочной кислоты в них довольно скоро развивается утомление.
Медленно переключающиеся красные волокна способны на более продолжительное сокращение. Они обильно снабжаются кровью и характеризуются высоким содержанием митохондрий и связанного с миоглобином кислорода. АТР в них образуется в процессе окислительного фосфорилирования, которое более эффективно, чем гликолиз, в случае образования АТР. Но в критических ситуациях для доставки необходимых количеств кислорода красным волокнам требуется время и учащение частоты сердечных сокращений. Поэтому ответ красных мышц (по сравнению с белыми) происходит медленнее, зато они могут долго функционировать без признаков утомления. У человека произвольные поперечнополосатые мышцы содержат оба типа волокон, их соотношение зависит от конкретной роли данной мышцы в организме. Мышцы спины должны выдерживать напряжение, необходимое для поддержания позы, в течение долгого времени, поэтому они содержат главным образом медленно переключающиеся волокна. Глазные мышцы, участвующие в движении глазного яблока, - хороший пример быстро переключающихся волокон.
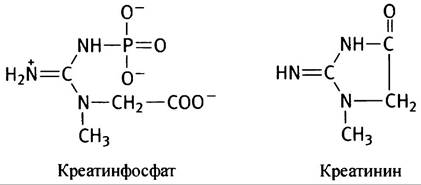
Во всех типах мышц запаса АТР, от которого в значительной степени зависит сокращение, хватает только на очень короткий период интенсивного сокращения. И здесь важную роль играет резервное макроэргическое соединение креатинфосфат, свободная энергия гидролиза которого (∆G°′) составляет -43,0 кДж • моль-1 (ср. с -30,5 кДж • моль-1 для гидролиза АТР до ADP и Рi). Когда в процессе сокращения АТР превращается в ADP и Рi, в ходе креатинкиназной реакции происходит регенерация АТР за счет использования фосфатных групп молекул креатинфосфата.
При сокращении:
АТР + Н2O —> ADP + Рi.
При регенерации ATP:
ADP + креатин-Ⓡ —> ATP + креатин.
При расслаблении мышц АТР ресинтезируется в процессе окислительного метаболизма, а регенерация креатин- фосфата происходит в ходе той же креатинкиназной реакции, которая в присутствии высокого уровня АТР и низкого ADP легко обратима.
Как уже отмечалось, креатинфосфат (см. ниже) - макроэргическое соединение, фосфатная группа которого может обратимо передаваться на ADP с образованием АТР. Из-за высокой реакционной способности фосфатной группы возможно спонтанное (некаталитическое) образование креатинина. Это соединение не несет никаких функций и ежедневно выделяется с мочой в количестве, пропорциональном мышечной массе.
Структура скелетной поперечнополосатой мышцы
Мышца состоит из длинных многоядерных клеток - мышечных волокон (рис. 28.1).
Рис. 28.1. Строение поперечнополосатого мышечного волокна
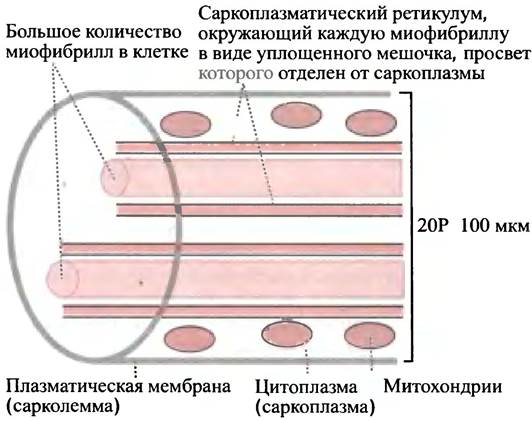
Их мембрана - сарколемма - соединена через нервно-мышечные синапсы с нервными окончаниями, которые передают сигнал, запускающий сокращение. Мембрана клетки окружает цитоплазму, множественные ядра и многочисленные митохондрии. Цитоплазма заполнена большим количеством идущих по всей длине клетки сократительных нитей - миофибрилл, каждая из которых окружена мембранными мешочками саркоплазматического ретикулума.
Структура миофибриллы
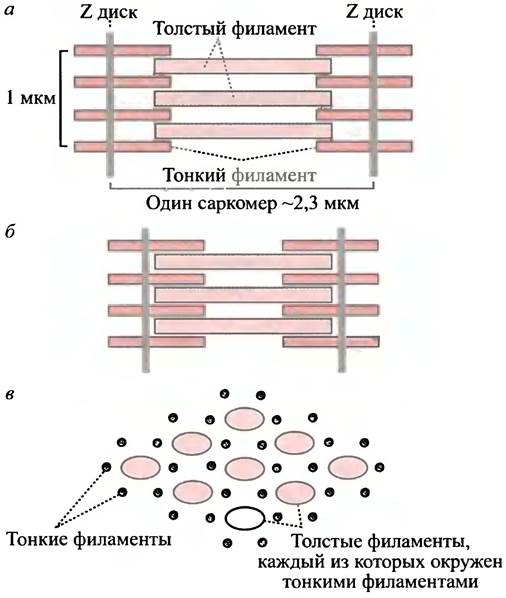
Миофибрилла - сократительная нить, проходящая по всей длине мышечной клетки. Она разделена на сегменты, называемые саркомерами (см. рис. 28.2), которые ограничены Z-дисками (от нем. Zwischen - находящийся между). При сокращении Z-диски сближаются, а каждый саркомер — и, следовательно, вся миофибрилла - укорачивается. Это укорачивает все мышечное волокно, обусловливая тем самым сокращение мышцы.
Рис. 28.2. Строение толстых и тонких филаментов в саркомере. а - Фаза расслабления. Поперечная исчерченность среза миофибриллы при электронной микроскопии обусловлена проходящими пучками белка; б - фаза сокращения; в - поперечное сечение. На рисунке представлено только несколько волокон, хотя в действительности каждый саркомер содержит большое количество миофибрилл
Как сокращается саркомер?
Z-диски - прочные белковые диски, расположенные на каждом конце саркомера. К ним присоединены тонкие филаменты, направленные к центру саркомера. Они образованы белком актином и прочно соединены одним из своих концов с Z-диском. Тонкие филаменты инертны и служат «храповым механизмом», к которому прикладывается сила, стягивающая Z-диски друг к другу. В мышцах позвоночных тонкие филаменты имеют гексагональную упаковку и прикреплены к двум дискам, а каждый саркомер несет несколько таких упорядоченных структур. Внутри каждой гексагональной «клетки», образованной шестью тонкими филаментами, расположен толстый филамент. Он обладает пальцеобразными выступами, которые совершают фактическую работу сокращения. При помощи «храпового механизма» они сдвигают тонкие волокна к центру, стягивая Z-диски (см. рис. 28.2).
Такова общая картина мышечного сокращения. Чтобы понять, как оно происходит, мы должны рассмотреть участвующие в нем молекулярные структуры.
Структура и действие толстых и тонких филаментов
Тонкие филаменты
Мономерный глобулярный белок актин называется G-актином («G» означает глобулярный) (рис. 28.3). В структуре его молекулы различают два домена, соединенных узким перешейком, придающим молекуле полярность. При определенных условиях в клетке молекулы G-актина легко полимеризуются и образуют двуспиральную структуру F-актина, в котором все молекулы ориентированы в одном направлении - от головки к хвосту, (см. рис. 28.3)
Рис. 28.3. Схема строения актинов. а — G-актин глобулярный; б - F-актин фибриллярный, образующийся при полимеризации G-актина
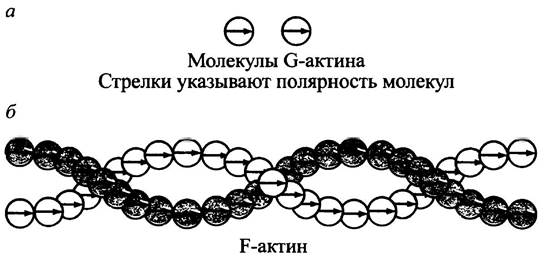
Тонкие филаменты образованы двунитевыми структурами, их концы обозначают знаками (+) и (-).
Толстые филаменты
Рассмотрим теперь белок миозин, каждая молекула которого имеет стержень, образованный двумя закрученными относительно друг друга α-спиралями, называемыми также тяжелыми цепями миозина (рис. 28.4, а). Структура каждой из спиралей такова, что регулярно расположенные остатки гидрофобных аминокислот участвуют в гидрофобном взаимодействии с другой α-спиралью, образуя жесткую палочкообразную структуру. Каждая цепь оканчивается глобулярной головкой, к которой присоединены две небольших полипептидных цепи, называемые легкими цепями миозина.
Толстый филамент состоит из нескольких тысяч молекул миозина, организованных биполярно, как показано на рис. 28.4, б. Толстые филаменты занимают центральное положение относительно окружающих их тонких филаментов при помощи других белков, входящих в состав саркомера. Один из них - титин, названный так из-за огромной (англ. titanic) молекулярной массы. Такое центральное положение обеспечивает оптимальное расстояние, позволяющее головкам миозина контактировать с акгиновыми филаментами.
Рис. 28.4. Организация толстого филамента. а - Строение молекулы миозина, состоящей из двух тяжелых цепей, каждая из которых заканчивается миозиновой головкой. К ним присоединены две различных легких цепи; б - толстый филамент, образованный из молекул миозина, соединенных биполярным способом
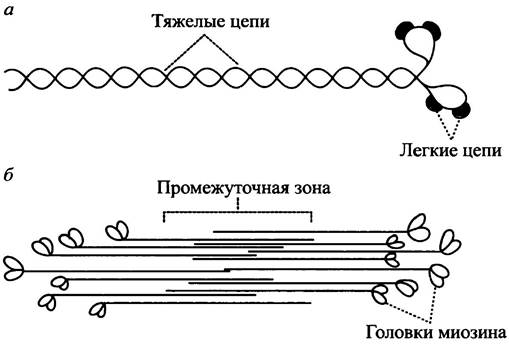
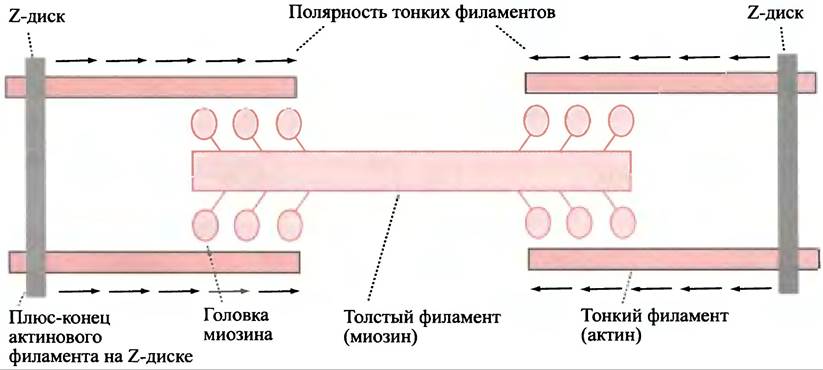
Тонкие филаменты заякорены на Z-дисках своими (+)-концами так, что головки миозина на обоих концах толстого филамента одинаково ориентированы по отношению к «полюсам» тонких филаментов (рис. 28.5).
Рис. 28.5. Организация толстых и тонких филаментов в саркомере. Стрелки указывают полярность филаментов актина. При сокращении головки миозина движутся вдоль актиновых филаментов по направлению к их (+)-концам: при этом два Z-диска подтягиваются друг к другу
Как головка миозина преобразует энергию гидролиза АТР в механическую работу актиновых филаментов?
Головка миозина обладает АТРазной активностью, и в ходе гидролиза АТР до ADP и Рi в ней происходят конформационные изменения. Без соответствующего разъяснения это наверняка вызовет замешательство. Ведь до сих пор мы рассматривали случаи, когда расщепление АТР использовалось для совершения работы, и было бы естественно предположить, что сокращение мышцы происходит за счет гидролиза АТР до ADP и РРi. В ATP-зависимых процессах, которые были рассмотрены ранее, шел непрямой гидролиз АТР: сначала фосфорильная группа или АМР переносилась к реагирующей молекуле, с последующим высвобождением либо РРi, либо АМР, т. е. использовались сопряженные реакции. При мышечном сокращении механическая работа осуществляется под действием прямого гидролиза АТР (без ковалентных интермедиатов). Однако фактически «силовой удар» при сокращении происходит не при гидролизе АТР, как этого можно было ожидать, а после отделения ADP от белка. Именно когда ADP покидает белок, происходит основное выделение свободной энергии, так что «силовой удар» при мышечном сокращении приходится не на гидролиз АТР, а на освобождение ADP от головки миозина. В то же время в ходе превращения комплекса белок-АТР в комплекс белок-ADP плюс Рi, изменение свободной энергии невелико. В растворе же превращение свободного АТР в свободные ADP и Рi.
характеризуется большим отрицательным значением ∆G°′, так что общая энергетическая концепция гидролиза АТР как движущей силы остается неизменной.
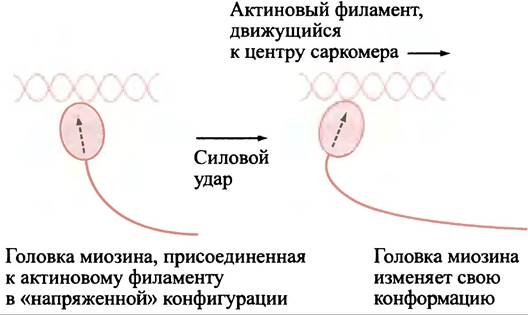
Головка миозина может находиться в напряженной конформации (готовой к совершению усилия) и расслабленной конформации (после совершенного усилия). Головка присоединяется к актиновому филаменту в напряженной конформации и затем наносит «силовой удар» на актин (рис. 28.6), после чего принимает расслабленную конформацию.
Рис 28.6. Сокращение скелетной мышцы (упрощенное изображение)
Теперь мы более подробно рассмотрим этапы этого цикла, начинающегося в точке, когда головка миозина только что осуществила «силовой удар». Головка присоединена к актину в расслабленной конформации. Потом события развиваются как показано на рис. 28.7.
Рис. 28.7. Сокращение скелетной мышцы (упрощенное изображение). Номера соответствуют этапам, указанным в тексте. Головка миозина только что осуществила «силовой удар» по тонкому филаменту актина. Обратите внимание на то, что «силовой удар» связан с высвобождением ADP с головки миозина
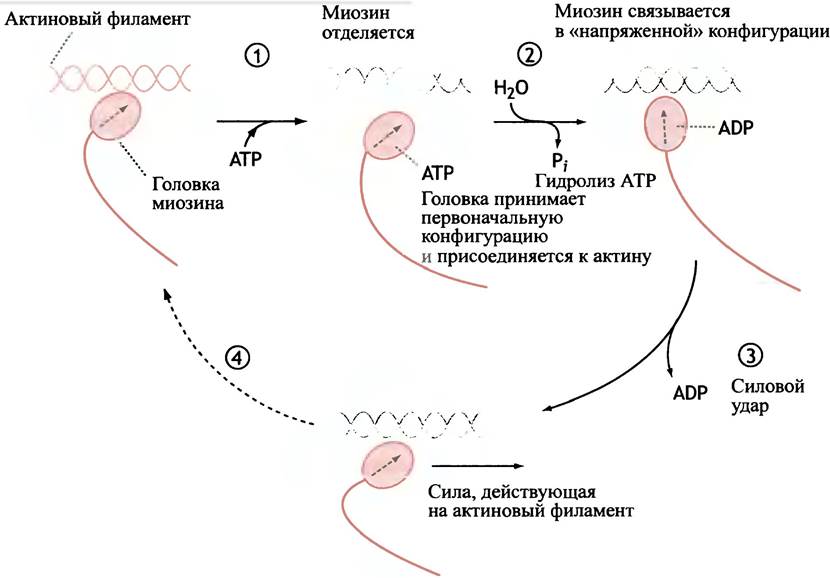
1. АТР присоединяется к головке миозина и вызывает ее отделение от актина.
2. АТР гидролизуется до ADP и Pi; после освобождения Рi. Головка миозина переходит в напряженную конформацию и присоединяется к актину.
3. Головка миозина наносит «силовой удар», связанный с высвобождением ADP. Это вызывает конформационные изменения головки, которая поворачивается в шарнирной области.
4. Головка миозина в расслабленной конформации связана с актином до тех пор, пока ее не высвободит поступающая молекула АТР, которая и обеспечивает возврат в первоначальное состояние.
В мышечном сокращении участвует большое число молекул миозина. Если АТР недоступен, все головки миозина «сшиты» поперечными связями с актином (поскольку не происходит первого этапа цикла). Это приводит к образованию жесткой структуры мышц (состояние трупного окоченения), которое начинается при истощении запасов АТР. Способность головки миозина осуществить весь рассмотренный процесс была продемонстрирована in vitro в экспериментах с шариками латекса, покрытыми изолированными головками миозина, которые буквально «ходили» по иммобилизованным волокнам актина в присутствии АТР и Са2+.
Как регулируется сокращение произвольных поперечнополосатых мышц?
Сокращение скелетных мышц инициируется нервным импульсом, вызывающим высвобождение ионов Са2+ из саркоплазматического ретикулума в миофибриллы. Ионы Са2+быстро удаляются из миофибриллы (см. ниже), в результате чего сокращение прекращается. До тех пор, пока под действием продолжающегося нервного импульса не высвободится большое количество ионов Са2+, сокращение не произойдет.
Как Са2+ вызывает сокращение?
Основным белком тонких филаментов является актин, но с ними связаны и другие белковые молекулы. Одна из них - тропомиозин - состоит из двух субъединиц. Это довольно небольшая, вытянутая молекула, которая расположена в бороздке, образуемой двумя актиновыми нитями тонкого филамента. На 1 молекулу тропомиозина приходится примерно 7 молекул актина. Молекулы двух белков последовательно накладываются друг на друга, формируя непрерывную нить. Тонкий филамент имеет две бороздки, и молекулы тропомиозина располагаются в каждой из них (рис. 28.8).
Рис. 28.8. Взаиморасположение молекул актина и тропомиозина. Каждая молекула тропомиозина связывает 7 мономеров актина, формируя протяженную нить в бороздках актинового филамента. К одному из концов каждой молекулы тропомиозина присоединен тропониновый комплекс
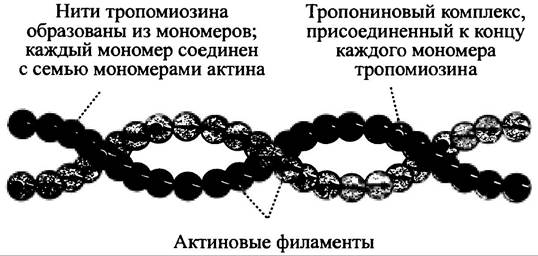
К одному из концов молекулы тропомиозина присоединен тропонин - комплекс, состоящий из трех глобулярных белков. Тропонин-тропомиозиновый комплекс чувствителен к ионам Са2+, которые вызывают небольшое перемещение нити тропомиозина относительно тонкого филамента, что позволяет головке миозина присоединиться к актиновому волокну. Тропомиозин, как считалось, блокирует присоединение миозина к актину, в то же время другие наблюдения свидетельствуют о том, что Са2+ не влияет на связывание миозина с тонким филаментом. Известно, впрочем, что пока миозин-актиновый силовой цикл не включается, нет ионов Са2+.
Не вдаваясь в подробности, необходимо отметить, что ионы Са2+ связываются с тропонином, вызывая конформационные изменения в молекуле тропомиозина, который каким-то образом активирует миозин-актиновый силовой цикл, приводящий к гидролизу АТР и мышечному сокращению. Удаление ионов Са2+ обращает вспять всю последовательность событий и прекращает сокращение: это приводит нас к механизму регуляции выхода и удаления ионов Са2+.
Транспорт ионов Са2+ в мышце
Каждая миофибрилла мышечной клетки окружена мембранным мешочком саркоплазматического ретикулума, Са2+-АТРаза которого перекачивает ионы Са2+ из цитозоля, окружающего миофибриллу, в просвет ретикулума (ATP-зависимым способом против градиента концентрации). Этот механизм поддерживает низкую концентрацию Са2+ в миофибрилле и предотвращает мышечное сокращение. В регуляции содержания Са2+ участвует также белок мембраны саркоплазматического ретикулума, функционирующий в качестве канала для пассивного транспорта ионов Са2+. Обычно он закрыт, но при поступлении к мышечной клетке нервного импульса открывается и впускает ионы Са2+ из просвета ретикулума в миофибриллу, вызывая сокращение.
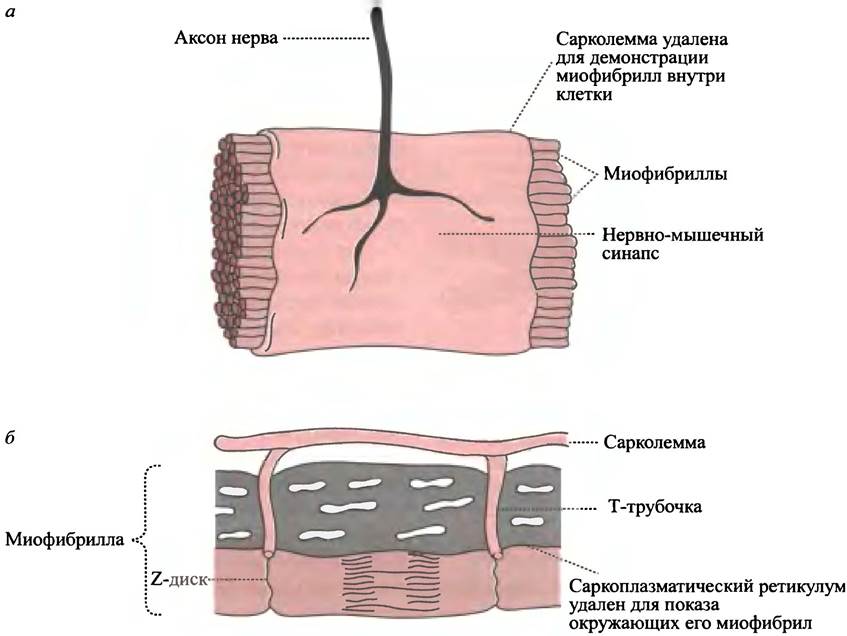
Для длительного мышечного сокращения все саркомеры миофибриллы и все миофибриллы в мышце должны отвечать на импульс двигательного нерва одновременно, иначе сокращение окажется нескоординированным и малоэффективным. Нервный импульс вызывает освобождение ацетилхолина в нервно-мышечном синапсе, а это, в свою очередь, вызывает локальную деполяризацию плазматической мембраны, быстро распространяющуюся по всей мембране (см. с. 358). В процессе деполяризации происходит открытие потенциал-зависимых Са2+-каналов саркоплазматического ретикулума и выход иона к миофибрилле. Для обеспечения быстрой доставки сигнала ко всему саркоплазматическому ретикулуму клетки плазматическая мембрана имеет впячивания (инвагинации) в виде поперечных (Т) трубочек. Последние проникают в миофибриллу в области Z-диска и вступают в прямой контакт с мембраной саркоплазматического ретикулума, позволяя таким образом электрическому сигналу практически мгновенно достигать всех сократительных единиц, управляемых этим нервным импульсом (рис. 28.9).
Рис. 28.9. Нервно-мышечный синапс. а - Плазматическая мембрана (сарколемма) мышечного волокна, образующая нервно-мышечный синапс; б - схема поперечных (Т) трубочек, которые передают сигнал о деполяризации плазматической мембраны к саркоплазматическому ретикулуму (СР). Считается, что деполяризация плазматической мембраны непосредственно передается на Са2+-каналы СР, вызывая тем самым быстрое высвобождение из канала Са2+
Чем гладкая мышца отличается по структуре и регуляции от поперечнополосатой?
Гладкие мышцы обнаружены в стенках кровеносных сосудов, в кишечнике, мочеполовой и других системах. Их длинные веретенообразные клетки имеют одно ядро и объединяются, образуя мышцы, чья форма соответствует выполняемым функциям (например, кольцевидная в кровеносных сосудах или сетевидная в мочевом пузыре).
Основные принципы сокращения те же, что и в поперечнополосатой мышце, где молекулы миозина осуществляют силовое воздействие на актиновый филамент, используя в качестве источника энергии гидролиз АТР и аналогичный «силовой цикл». Однако сократительные компоненты в гладких мышцах не так высоко
организованы. Нет миофибрилл и повторяющихся сар- комеров, поэтому при микроскопии отсутствует поперечная исчерченность. Вместо саркомерной структуры волокна актина проходят по всей длине клетки (маленькой по сравнению с клеткой поперечнополосатой мышцы) и одним концом прикреплены к клеточной мембране.
Регуляция сокращения гладкой мышцы
Хотя ионы Са2+ и отвечают за инициацию сокращения, его регуляторный механизм не такой, как в поперечнополосатой мышце. Саркоплазматический ретикулум отсутствует. Гладкая мышца сокращается гораздо медленнее (в 50 раз), чем поперечнополосатая (около 5 секунд). От гладкой мышцы не требуется почти мгновенного сокращения всех структур, как в случае поперечнополосатой: сокращение отдельных клеток распространяется в более медленном темпе. Нервный импульс вегетативной нервной системы открывает Са2+-канал в мембране гладкомышечных клеток и вызывает вход ионов Са2+ внутрь клетки из внеклеточной среды. Специальные соединения между клетками позволяют нервному сигналу распространяться от клетки к клетке по всей мышце.
Как Са2+ регулирует сокращение гладкой мышцы?
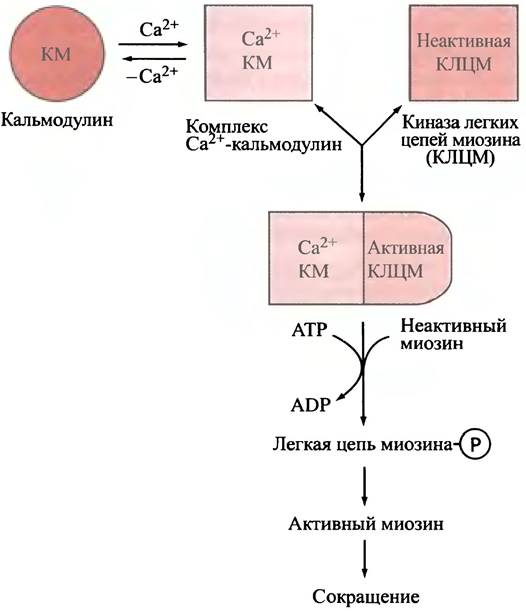
Как уже говорилось, в головке каждой молекулы миозина расположены два небольших полипептида - легкие цепи миозина. В гладкой мышце одна из этих легких цепей (p-легкая цепь) ингибирует связывание головки миозина с актиновым филаментом и таким образом предотвращает сокращение. Са2+ активирует киназу легких цепей миозина, которая в присутствии АТР фосфорилирует p-легкую цепь и снимает ингибирование, вызывая таким образом сокращение.
Ионы Са2+ активируют киназу опосредственно; они соединяются с белком кальмодулином (см. с. 353), вызывая в нем конформационные изменения, в результате которых комплекс Са2+-кальмодулин присоединяется к неактивной киназе и активирует ее. При понижении уровня ионов Са2+ процесс обращается, а фосфатаза дефосфорилирует легкую цепь миозина, вызывая расслабление мышцы. Общая схема регуляции представлена на рис. 28.10.
Рис. 28.10 Механизм активации сокращения гладкой мышцы ионами Са2+
Помимо нервной регуляции, в регуляции сокращения гладких мышц принимают участие некоторые гормоны, например, норадреналин, вызывающий сокращение определенных мышц кровеносных сосудов.
Вопросы к главе 28
1. Каковы различия между быстро и медленно сокращающимися мышечными волокнами? Каково их биологическое значение?
2. Изобразите строение миофибриллы, саркоплазматического ретикулума и саркомера.
3. Объясните, каким образом головка миозина преобразует энергию гидролиза АТР в механическую энергию.
4. Как регулируется сокращение саркомера произвольной поперечнополосатой мышцы?
5. Как регулируется сокращение гладкой мышцы?