Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Химические основы жизни
Иерархия клеточной структуры
В предыдущих разделах мы рассмотрели основные типы биологически важных соединений небольшой молекулярной массы и построенных из них биополимеров. Хотя мы неоднократно подчеркивали связь между химическим строением этих веществ и их функциями в клетке, полезно еще раз обсудить динамическую природу и компартментализацию этих функций. По мере роста живой клетки в ней должны постоянно синтезироваться все рассмотренные в настоящей главе биополимеры. Обычно питательная среда клетки состоит из сахаров, диоксида углерода, некоторых аминокислот, воды и ряда неорганических ионов, а биополимеры и ряд необходимых для их построения мономеров, как правило, в сколько-нибудь значительных количествах отсутствуют. Таким образом, клетка должна синтезировать все другие необходимые ей аминокислоты, нуклеиновые кислоты, липиды, белки и другие вещества из имеющихся простейших предшественников. Протекающие с поглощением энергии процессы синтеза предшественников и образования биополимеров рассматриваются в гл. 5.
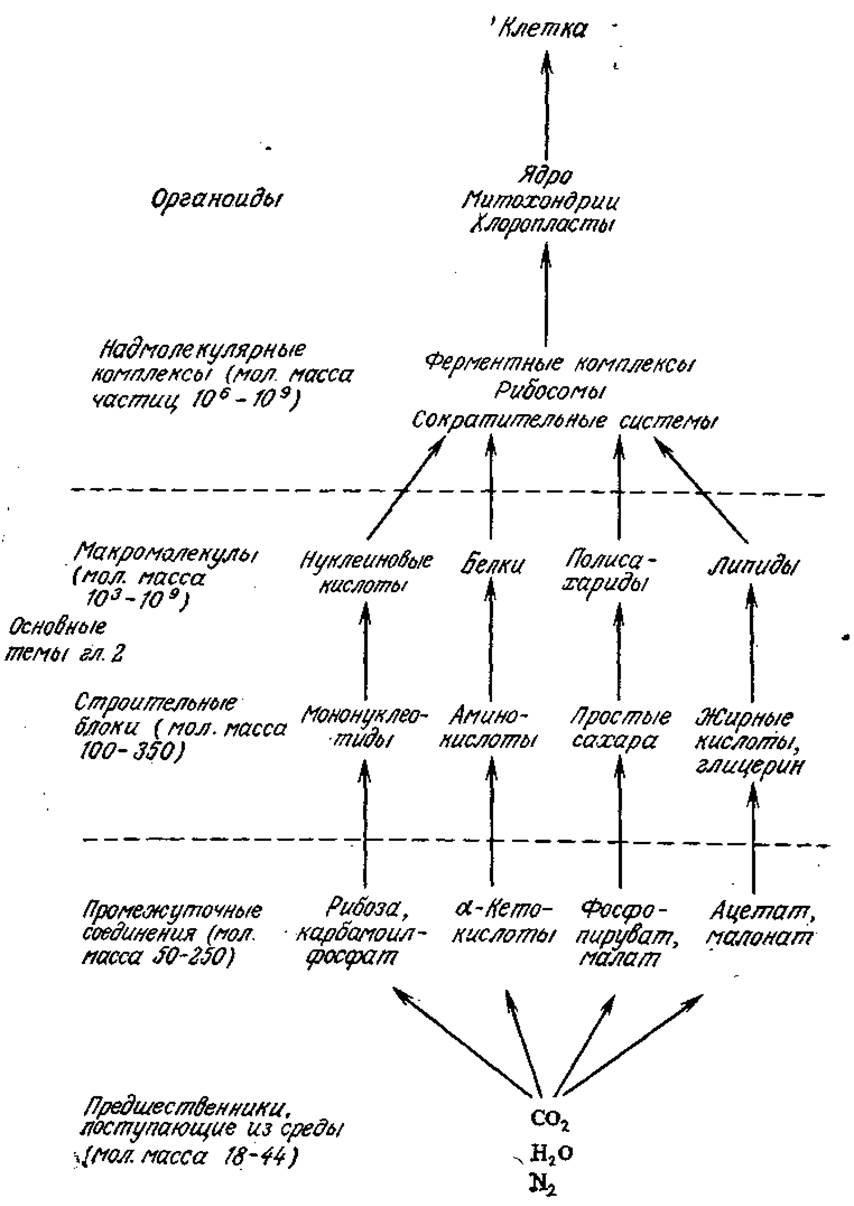
РИС. 2.27. Распределение описанных в настоящей главе биологически важных веществ в порядке усложнения их структуры и повышения степени организации. (Из работы: Ленинджер А., Биохимия. — М.: Мир, 1976, с. 22.)
В клетке существует множество надмолекулярных структур. Как мы уже видели, клеточная мембрана, например, представляет собой сложное сочетание молекул многих типов. Другим примером могут служить рибосомы, являющиеся специфическим комплексом нескольких различных белков и нуклеиновых кислот. Во многих случаях ферменты, катализирующие несколько последовательных химических реакций, объединены в одном ферментном комплексе, в котором, по-видимому, обеспечивается максимальная эффективность использования промежуточных веществ. Последний по сложности уровень организации, непосредственно предшествующий самой клетке, занимают органоиды типа митохондрий и хлоропластов. Различные уровни сложности от простейших веществ до клетки схематически изображены па рис. 2.27.
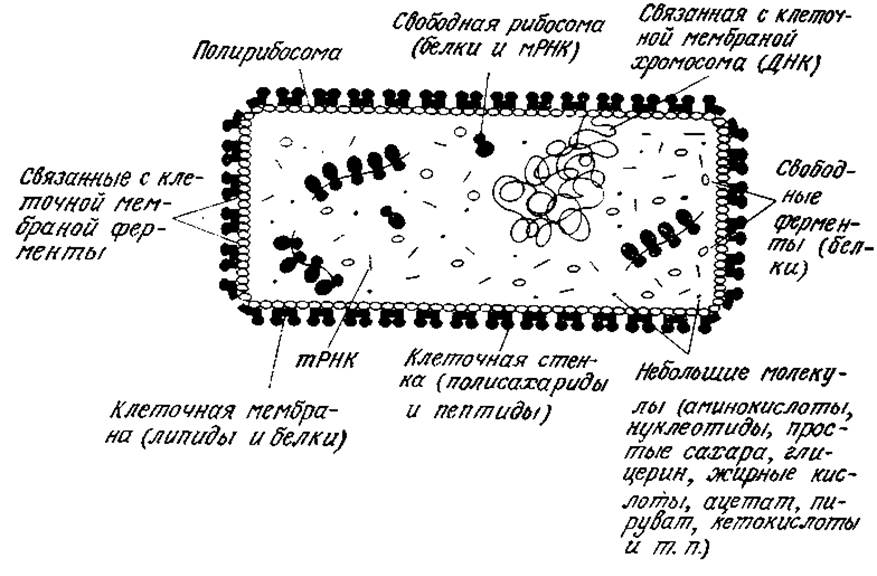
РИС. 2.28. Схема компартментализации описанных в настоящей главе биологически важных молекул в клетке кишечной палочки Е. coli.
Схема локализации различных биологически важных веществ, рассмотренных в этой главе, в клетке микроорганизма- прокариоты приведена на рис. 2.28, а общий химический состав Е. coli суммирован в табл. 2.12. Небольшие молекулы типа аминокислот и простых сахаров, а также) некоторые значительно большие молекулы, например ряд ферментов и тРНК, равномерно распределены по всему объему цитоплазмы. Другие биополимеры локализованы в определенных участках внутри клетки или на ее поверхности, например на клеточной мембране.
Таблица 2.12. Состав быстрорастущей клетки Е. coliа
Компонент |
Содержание, % от общей массы клетки |
Средняя молекулярная масса |
Приблизительное число молекул в клетке |
Число различных типов |
Н2О |
70 |
18 |
4∙1010 |
1 |
Неорганические ионы (Na+, K+, Mg2+, Ca2+, Fe2+, Cl-, PO43- SО42- и т. п.) |
1 |
40 |
2,5∙108 |
20 |
Углеводы и их предшественники |
3 |
150 |
2∙108 |
200 |
Аминокислоты и их предшественники |
0,4 |
120 |
3∙107 |
100 |
Нуклеотиды и их предшественники |
0,4 |
300 |
1,2∙107 |
200 |
Липиды и их предшественники |
2 |
750 |
2,5∙107 |
50 |
Другие небольшие молекулы (гемы, хиноны, продукты распада питательных веществ и т. п.) |
0,2 |
150 |
1,5∙107 |
200 |
Белки |
15 |
40 000 |
106 |
2000—3000 |
Нуклеиновые кислоты: ДНК |
1 |
2,5∙109 |
4 |
1 |
РНК |
6 |
|||
16S рРНК |
500 000 |
3∙104 |
I |
|
23S рРНК |
1 000 000 |
3∙104 |
1 |
|
тРНК |
25 000 |
4∙105 |
40 |
|
мРНК |
1 000 000 |
103 |
1000 |
а Уотсон Дж., Молекулярная биология гена. — М.: Мир, 1978, с. 70.
Связь между различными ионами, питательными веществами, промежуточными соединениями и другими составными частями клетки осуществляется с помощью разветвленной сети химических реакций (гл. 5 и 6). Отдельные реакции этой сети катализируются ферментами, которые обеспечивают их осуществление в мягких условиях, способствующих, как это было показано выше, сохранению нативной формы белков. Ряд реакций, протекающих с поглощением энергии (гл. 5), а также тенденция некоторых молекул к самопроизвольному образованию локализованных в объеме клетки структурных элементов обеспечивают образование мембран, ферментных комплексов и органоидов.
Гл. 3 и 4 посвящены кинетике катализируемых ферментами реакций и практическому использованию последних. Далее в гл. 5—7 мы рассмотрим вопросы энергетики и стехиометрии в клеточных процессах, проблемы генетики и регуляции сети происходящих в клетке реакций, а также математические выражения, характеризующие кинетику роста популяций клеток. После этих вводных глав мы перейдем к основной теме книги — изучению биохимических реакторов.
Упражнения
2.1. Химическое строение, а) Напишите полные или обобщенные химические формулы перечисленных ниже веществ. Объясните (возможную) функциональную роль различных группировок в молекулах этих веществ.
1. Жир, фосфолипид, мицелла, витамин А.
2. D(+)-Глюкоза, пираноза, лактоза, крахмал, амилопектин, целлюлоза.
3. Рибонуклеотид, аденозинмонофосфат (АМР), аденозинтрифосфат (АТР), никотинамидадениндинуклеотид (NAD), дезоксирибонуклеиновая кислота (ДНК).
4. Аминокислота, лизин, трипептид, белок.
5. Глобулярные и фибриллярные белки.
б) Начертите схему уровней строения белков, укажите важнейшие особенности каждого из уровнен (от первичной до четвертичной структуры).
2.2. Спектрофотометрия. Интенсивность поглощения света раствором при определенных длинах волн измеряется с помощью спектрофотометра — прибора, имеющего очень большое значение в аналитической биохимии. Методом спектрофотометрии определяют концентрации растворенных веществ, а по характеру спектров поглощения их можно идентифицировать. Спектрофотометрическое определение концентрации основано на законе Бера — Ламберта:
![]()
где А — поглощение или оптическая плотность; I0 — интенсивность падающего света; I — интенсивность пропускаемого света; аm — молярный коэффициент экстинкции; b — длина пути светового пучка; с — молярная концентрация растворенного вещества.
Обычно длину волны падающего света выбирают равной Кmах, при которой изучаемое растворенное вещество поглощает в наибольшей степени. В табл. 2У2.1 приведены величины λmах ряда биологически важных соединений и соответствующие молярные коэффициенты экстинкции (при длине светового пути b = 1 см и pH 7). Другие необходимые данные можно найти в справочниках; обратите внимание на то, что значения λmах часто лежат в ультрафиолетовой области.
Таблица 2У2.1
Соединение |
λmax, им |
аm∙10-3 л/(см∙моль) |
Триптофан |
218 |
33,5 |
АТР |
259 |
15,4 |
NAD+ |
259 |
18 |
Рибофлавин |
260 |
37 |
NADH |
339 |
6,22 |
FAD |
450 |
11,3 |
а) Раствор АТР в кювете толщиной 1 см пропускает 70% падающего света при 259 нм. Вычислите концентрацию АТР. Какова оптическая плотность 5∙10-5 М раствора АТР?
б) Предположим, что соединения А и В имеют одинаковые молярные коэффициенты экстинкции, приведенные в табл. 2У2.2. Вычислите
Таблица 2У2.2
аm, л/(см∙моль) |
||
Длина волны, нм |
А |
В |
340 |
14 000 |
7100 |
410 |
2900 |
6600 |
концентрации А и В в растворе, содержащем как А, так и В и обладающем оптической плотностью (в кювете толщиной 1 см) 0,35 при 340 нм и 0,220 при 410 нм.
2.3. Молекулярные массы. Для оценки молекулярной массы методами седиментации и диффузии часто пользуются уравнением Сведберга:
![]()
где R — газовая постоянная; Т — абсолютная температура; s — коэффициент седиментации, с; D —коэффициент диффузии, см2/с; v — парциальный удельный объем вещества, см3/г; р — плотность раствора, г/см3.
Проверьте молекулярные массы перечисленных в табл. 2У3.1 веществ (T = 20°С). Примите р = 1,0.
Таблица 2У3.1
Вещество |
s ∙ 1013 |
D ∙ 107 |
V |
M |
Лизоцим |
1,91 |
11,2 |
0,703 |
14 400 |
Фибриноген |
7,9 |
2,02 |
0,706 |
330 000 |
Вирус карликовости кустарниковых |
132 |
1,15 |
0,74 |
10 700 000 |
2.4. Буферная емкость и pH растворов полимеров, а) Вычислите pH 0,2 М растворов серина, гидрохлорида серина, калиевой соли серина.
б) Начертите кривую титрования раствора гидрохлорида серина сильным основанием (КОН); шкалы градуируйте в величинах pH и числе молей КОН, добавленных к 1 молю серина соответственно.
в) Вычислите pH растворов линейных полипептидов, содержащих 5, 20 и 100 остатков серина, соответствующих гидрохлоридов и калиевых солей при их процентной концентрации, равной концентрации 0,2 М раствора гидрохлорида серина. Примите, что константа диссоциации не зависит от степени полимеризации.
г) Вычислите pH раствора моногидрохлорида лизина при его процентной концентрации, равной концентрации 0,2 М раствора гидрохлорида серина. Считайте константы равновесия реакций протонирования а-аминогруппы и аминогруппы боковой цепи равными 8,91∙10-6 и 2,95∙10-11 л/моль соответственно.
д) Вычислите pH 1%-ных (по массе) растворов целлюлозы и крахмала (примите, что молекулярная масса крахмала очень велика, >106). Как в общем случае влияют резервные полимеры на pH клетки?
2.5. Разделение аминокислот, а) Оцените, правильны ли следующие утверждения, обоснуйте ваши ответы:
1. рК простой аминокислоты выражается формулой
![]()
2. В диапазоне между рКCOOH и рКNH2 аминокислоты нейтральны.
б) При разделении аминокислот хроматографическими методами успешно используются хроматографические носители, являющиеся сульфированными производными полистирола. Основные группы аминокислот взаимодействуют с отрицательно заряженными сульфогруппами, а гидрофобные участки аминокислот взаимодействуют с ароматическими группировками полимера. Оцените, в каком (приблизительно) порядке будут элюироваться аминокислоты при pH 3, 7 и 10 из колонки, содержащей:
1. Только сульфогруппы на инертном носителе.
2. Только полистирол.
3. Сульфированный полистирол с доступными в одинаковой степени сульфогруппами и фенильными кольцами.
в) Какие взаимодействия, гидрофильные или гидрофобные, будут играть определяющую роль в процессе разделения смеси полипептидов и смеси белков на хроматографических носителях, перечисленных в предыдущем упражнении?
2.6. Физическая химия макромолекул, а) Используя свои знания, специальную литературу по химии и другие источники, опишите общие химические процессы и (или) физические конформационные изменения, сопровождающие поджаривание яичницы, приготовление теста, свертывание молока, застывание желе, выдувание мыльного пузыря, кристаллизацию белка, дубление кожи, взбивание яичных белков.
б) Важными параметрами заменителей пищевых продуктов из микробных и других источников, например белков одноклеточных организмов, заменителей мяса растительного происхождения, являются степень их текстурирования и реологические свойства (текучесть при приложении усилия). Опишите в общих чертах, как бы вы организовали лабораторию испытаний проб синтетической пищи. (Какую подготовку вы бы предусмотрели для персонала лаборатории? Какие методы проверки вы бы организовали?)
2.7. Уравнение материального баланса; стехиометрия. Из химических элементов для роста клеток необходимы в первую очередь углерод, кислород, водород и азот. Предположим, что источниками углерода и азота являются СН2O и NH4+ соответственно:
![]()
а) Опишите ограничения, налагаемые на коэффициенты а, ß и т. д. в силу сохранения элементного состава. Какая дополнительная информация необходима для определения всех коэффициентов при заданном «составе» клетки?
б) Выполните такое же задание для фотосинтезирующей системы:
![]()
в) Подробно опишите ряд экспериментов, с помощью которых вы могла бы определить элементный состав клетки (коэффициенты a, b, с, d).
2.8. Стехиометрия; аэробные и анаэробные микроорганизмы. Для облегчения расчетов потребности в питательных веществах, скоростей аэрации и теплопередачи (гл. 5, 8) можно приписать клетке кажущуюся молекулярную формулу и на этой основе записать общее стехиометрическое уравнение клеточного роста.
а) Вычислите формулу клетки дрожжей, которые растут на питательной среде, содержащей сахар, если экспериментально для этого процесса определен следующий баланс веществ (примите, что образуется 1 «моль» клеток):
![]()
б) Какую формулу следует приписать клетке, если в приведенной выше реакции образуется 0,30017 «моля» клеток?
в) При анаэробном брожении наряду с клеточной массой обычно образуется множество частично окисленных соединений. Исходя из «молекулярной формулы» клетки, найденной в предыдущем упражнении, вычислите неизвестные коэффициенты для следующих типичных уравнений реакций (здесь коэффициенты указывают количество молей, а не массу):

Скорости процессов, описанных в упражнениях 2.8а и 2.8в, легко регулируются путем изменения скорости аэрации, что позволяет получать дрожжи и этанол в любом промежуточном соотношении (венский процесс) [Harrison J. В., Adv. Ind. Microbiol., 10, 129 (1971)].
2.9. Клеточные и искусственные липидные двуслойные мембраны. В табл. 2У9.1 приведены сравнительные характеристики природных и искусственных двуслойных липидных мембран.
Таблица 2У9.1а
Природные мембраны |
Искусственные липидные мембраны |
|
Толщина (А) по данным: электронной микроскопии |
40—130 |
60—90 |
реитгеноструктурного анализа |
40—85 |
|
оптических методов |
40—80 |
|
определения электрической емкости |
30—150 |
40—130 |
Сопротивление, Ом/см2 |
102—105 |
103—109 |
Напряжение пробоя, В |
100 |
100—550 |
Электрическая емкость, мкФ/см2 |
0,5—1,3 |
0,4—1,3 |
а Tien H. Т., Bilayer Lipid Membranes: An Experimental Model for Biological Membranes, in Chemistry of Biosurfaces, Hair M. L. (ed.), vol. 1, p. 239, Marcel Dekker, New York, 1971.
а) Почему два типа мембран имеют примерно одинаковую толщину? (Постарайтесь дать подробный и обоснованный ответ.)
б) Выполнению каких функций клетки (вероятно) способствуют высокое сопротивление и высокая электрическая емкость мембран?
в) Сравните напряжение пробоя порядка 1 В/Å с отношением потенциала ионизации любого углеводорода, содержащего 10 или более атомов углерода, к длине его молекулы. Обсудите полученные результаты.
2.10. Модель согласованных переходных состояний для связывания кислорода гемоглобином. Согласно модели согласованных переходных состояний. неактивная форма белка Т0 находится в равновесии с активной формой R0:
![]()
В свою очередь активная форма, в случае гемоглобина построенная из четырех субъединиц, может связывать одну молекулу субстрата S каждой субъединицей:
![]()
Обозначим константу диссоциации комплекса гемоглобина с субстратом, образующимся в каждой из приведенных выше стадий, символом KDS:
![]()
и вычислим для различных s/KDS и L отношения
![]()
Постройте график зависимости у от s/KDs при L = 9000. Найдите в биохимической литературе график зависимости количества связанного гемоглобином O2 от парциального давления O2 и сравните с вашим графиком. В найденной литературе прочтите о других кооперативных явлениях в биохимии.
2.11. Ферменты, построенные из нескольких субъединиц; вероятность ошибки. На первый взгляд может показаться, что ферменты, состоящие из нескольких субъединиц, например аллостерические ферменты, имеют более сложное строение, чем одноцепочечные белки. Тем не менее относительная вероятность ошибки при биосинтезе таких белков может оказаться меньшей.
а) Рассмотрим синтез двух белков, каждый из которых построен из 850 аминокислотных остатков. Пусть первый белок состоит из одной полипептидной цепи, а второй — из трех субъединиц с 200, 300 и 350 остатками. Оцените относительное количество первого и второго белка с одной или более ошибками, если вероятность ошибки одинакова для любого остатка и составляет 5∙10-9 на остаток и если наличие двух ошибок в любой цепи предотвращает ее дальнейший синтез или включение в активную структуру.
б) Как ни убедительны расчеты, приведенные в упражнении 2.11а, известно, что у ряда ферментов отщепление небольшой части аминокислотной последовательности не сопровождается потерей активности н что одну и ту же функцию может выполнять довольно большое количество белков с различными первичными структурами (см., например, различные структуры цитохромов с в монографии: Ленинджер А., Основы биохимии, т. 1. — М.: Мир, 1985). Какие другие функции могут выполнять в клетке эти на первый взгляд несущественные аминокислотные последовательности и остатки? (Вспомните внутреннюю структуру клетки.)
2.12. Обмен веществ. Для изучения энергетического и массового балансов клеточных процессов необходимо знать, в какой последовательности осуществляются химические превращения и в каких участках клетки происходит каждое из них. (Детальнее различные пути метаболизма мы изучим в последующих главах.) На основе данных, приведенных на рис. 2.27 и 2.28, начертите схему образования основных биополимеров и высших структурных элементов клетки; стрелками укажите последовательность процессов и изменение мест их осуществления; считайте, что все структурные элементы клетки образуются из простых предшественников, например O2, Н2O, NН4+ и глюкозы. В необходимых случаях укажите наличие (или отсутствие) пространственных ограничений для данных промежуточных продуктов метаболизма.
2.13. Соответствие биологически важных соединений. В этой главе были рассмотрены мономерные соединения и биополимеры, играющие важнейшую роль в жизнедеятельности микроорганизмов. Прочтите книгу [12], в которой с точки зрения истории развития планеты обсуждается вопрос, почему именно эти соединения возникли в процессе эволюции. Перечислите основные доводы Блюма в пользу пригодности воды, глюкозы и АТР для выполнения их биологической роли.
2.14. Реакция Грама. Из всех цветных реакций в бактериологии чаще всего используется реакция Грама. Перепишите из какого-либо руководства по микробиологии стандартную методику реакции Грама. Обсудите основные пункты методики и механизм реакции Грама.
2.15. Внутриклеточные концентрации. Рассчитайте молярные концентрации ДНК, различных РНК, аминокислот и их предшественников, липидов и их предшественников в клетке Е. coli. Определите общую молярную концентрацию веществ в Е. coli и обсудите возможность применения термодинамических законов для разбавленных (идеальных) растворов к цитоплазме Е. coli.
2.16. Строение ферментов. В состав активного центра фермента карбоксипептидазы, содержащего 307 аминокислотных остатков, входят аргинин (145), тирозин (248) и глутаминовая кислота (270) (числа обозначают порядковый номер аминокислотного остатка, начиная с N-конца цепи). Принимая, что молекула фермента имеет структуру а-спирали, рассчитайте расстояния между тремя указанными остатками. Какие необходимые для осуществления каталитического эффекта структурные изменения происходят в нативной молекуле карбоксипептидазы, если они приводят к сближению этих трех остатков до расстояний порядка десятых долей нанометра?
2.17. Термодинамика складывания полипептидных цепей белков. Рассмотрим гипотетический белок, находящийся в водной среде. Предположим, что часть молекулы этого белка имеет определенную вторичную структуру, а другая часть содержит Ser, Thr, Asn и два неполярных остатка. Определите ∆G (ккал/моль белка) н оцените, произойдет ли складывание второй части белка в следующих условиях:
а) Все полярные группы в последовательности образуют водородные связи.
б) Все полярные группы, за исключением расположенных в боковых цепях, образуют внутримолекулярные водородные связи.
в) Ни одна из полярных групп в последовательности не участвует в образовании внутримолекулярных водородных связей.
Примите, что перемещение гидрофобного остатка из водной среды с нейтральным pH в неполярную внутреннюю область белка сопровождается ∆G≈-4 ккал/моль (в расчете на остаток) и что для образования водородной связи между двумя любыми несвязанными полярными группами ∆G≈-5 ккал/моль (в расчете на одну полярную группу). Учтите, что не участвующие во внутримолекулярных водородных связях остатки могут образовывать водородные связи с водой.
Таблица 2У18.1
Агент |
Необходимый R1 |
Необходимый R2 |
Трипсин |
Lys, Arg |
Любой |
Химотрипсин |
Phe, Trp, Tyr |
Любой |
Пепсин |
Любой |
Phe, Trp, Tyr, Leu, Asp, Glu |
Бромциан |
Met |
Любой |
2.18. Определение аминокислотной последовательности белков. При частичном гидролизе полипептидных цепей белков образуются фрагменты, аминокислотная последовательность которых может дать необходимую информацию о первичной структуре всего белка. В табл. 2У18.1 перечислен ряд агентов, специфично гидролизующих определенные пептидные связи:
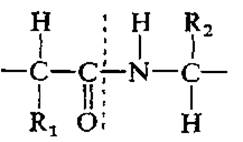
Другим важным инструментом определения аминокислотной последовательности является реакция Сэнджера, в которой 2,4-динитрофторбензол реагирует с N-концевой аминокислотой с образованием соответствующего динитрофенильного (DNP) производного.
Таблица 2У18.2
Обработка |
Результат |
Частичный кислотный гидролиз |
Пептидные фрагменты с последовательностями Gly-Ile-Val-Glu-Glu, Glu-Glu-Cys, Glu-Asp-Tyr, Ser-Val-Cys, Ser-Leu-Tyr, Glu-Cys-Cys, Glu-Leu-Glu, Cys-Asp, Leu-Tyr-Glu, Cys-Cys-Ala, Tyr-Cys |
Пепсин |
При гидролизе одного из пептических пептидов образовывались фрагменты Ser-Val-Cys, Ser-Leu |
Реакция Сэнджера |
DNP-глицин |
Определение С-концевой аминокислоты |
Аспарагиновая кислота |
В табл. 2У18.2 приведен ряд экспериментальных результатов, полученных в ходе изучения цепи А бычьего инсулина. Определите ее первичную структуру. При полном кислотном гидролизе белковой цепи образуются Gly, Ala, 2 Val, 2 Leu, Ile, 4 Cys, 2Asp, 4 Glu, 2 Ser и 2 Tyr.
Литература
1. Страйер Л., Биохимия, т. 1—3. — М.: Мир, 1984. Углубленный, написанный очень понятным языком учебник, освещающий основные биохимические концепции в свете последних достижений молекулярной биологии.
2. Yudkin М., Offord R., A Guidebook to Biochemistry, Cambridge University Press, London, 1971. Хороший вводный курс, в котором даются основы биохимии с привлечением минимального количества деталей.
3. Лёви А., Сикевиц Ф., Структура и функция клетки. — М.: Мир, 1971, Третья часть этой книги представляет собой великолепное короткое введение в биохимию; его особенно сильной стороной является большое внимание, уделяемое экспериментальной проверке биологических теорий и моделей.
4. Lehninger A. L., Biochemistry, 2d ed., Worth Publishers, New York, 1975; есть перевод первого издания: Ленинджер А., Биохимия. — М.: Мир, 1976. Великолепное пособие для углубленного изучения биохимии. Постоянное обращение к примерам из области физиологии клетки и человека помогает читателю лучше понять, запомнить и усвоить материал.
5. Ленинджер А., Основы биохимии, т. 1—3. — М.: Мир; 1985. Это не так давно вышедшее издание предназначено для студентов; написанное в том же стиле, что и предыдущая книга, оно в то же время отличается более подробным изложением современных проблем и перспектив развития молекулярной биологии.
6. Mahler Н. R., Cordes Е. Н., Biological Chemistry, Harper and Row, Publishers, Inc., New York, 1971. Здесь более детально, чем в книгах Ленинджера, рассмотрены химические и математические аспекты биохимии, а в разделах, посвященных экспериментальным методам биохимии и микробиологии, вопросы моделирования и транспорта веществ изложены глубже и подробнее, чем в большинстве других книг.
7. Уотсон Дж. Молекулярная биология гена. — М.: Мир, 1978. Хотя в основном эта хорошо написанная и уже ставшая классической книга посвящена молекулярной биологии, в ее начальных главах кратко изложены и основы биохимии. Здесь убедительно показана важность слабых взаимодействий и молекулярной динамики для структуры и функции биохимически важных соединений.
8. Wood W. В., Wilson J. Н., Benbow R. M., Hood L. E., Biochemistry: A Problems Approach, 2d ed., Benjamin/Cummings Publishing Co., Menlo Park, California, 1981. Краткое изложение основ биохимии, дополненное упражнениями (и ответами на них).
9. Dowben R. М., General Physiology: A Molecular Approach, Harper and Row, Publishers, Inc., New York, 1969. Эта интересно и увлекательно написанная книга посвящена физиологии клетки, рассматриваемой с точки зрения основ физической химии.
10. Dickerson R. W., Geis The Structure and Action of Proteins, Harper and Row, Publishers, Inc., New York, 1969. Написанная совместно биологом и популяризатором науки, эта монография своеобразно рассматривает различные функции белков, особенно связь между строением и функцией. Ее полезно прочесть наряду с одной из перечисленных выше книг.
11. Уотсон Дж. Д., Двойная спираль. — М.: Мир, 1969. История открытия структуры ДНК, поворотного пункта в развитии биологии. Здесь достаточно откровенно показан также сам процесс рождения открытий в современной науке.
12. Blum Н. F., Time’s Arrow and Evolution, 3d ed., Princeton University Press, Princeton, N.J., 1968. Изучение биологического соответствия элементов и соединений с точки зрения эволюции.
13. Fukui, Ishida, Microbial Production of Amino Acids, Kodansha Ltd., Tokyo, and John Wiley and Sons, Inc., New York, 1972. Интересный обзор различных способов выделения промежуточных продуктов метаболизма, в данном случае аминокислот.