Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Химические основы жизни
Биохимические соединения смешанного строения
Антитела и другие гликопротеины
Белки, содержащие ковалентно связанные остатки моносахаридов или коротких олигосахаридных цепей, называют гликопротеинами. Гликопротеины самых различных типов обнаружены в эукариотах и окружающей их среде. К числу гликопротеинов относится ряд ферментов, например глюкозооксидаза, продуцируемая Aspergillus niger. Упоминавшийся выше коллаген — биологический опорный элемент — также представляет собой гликозилированный белок. Гликопротеинами являются и некоторые интерфероны, мощные противовирусные агенты. По сути дела, большая часть белков эукариот, контактирующих с окружением клетки или выделяемых ею в среду, представляет собой гликопротеины. Некоторые гликопротеины уже стали или, по всей вероятности, скоро станут ценными промышленными продуктами. Биосинтез гликопротеинов и их участие в транспорте веществ мы рассмотрим в гл. 5 и 6.
К гликопротеинам относятся и антитела — важнейшее оружие иммунологической защиты позвоночных (рис. 2.26). С помощью обсуждаемых в гл. 6 методов слияния клеток можно получать в значительных количествах гомогенные антитела в организмах животных или в биологических реакторах, что позволит в будущем широко применять антитела для диагностических целей, введения лекарственных препаратов и разделения биологически важных веществ. По этой причине нам кажется целесообразным вкратце обсудить здесь происхождение, строение и функции антител.
В состав иммунной системы позвоночных входят В-клетки, принадлежащие к одному из двух типов обнаруженных в организме лимфоцитов; в присутствии чужеродного вещества, вируса или клетки (антигена) В-клетки дифференцируются и образуют плазматические клетки, которые выделяют антитела. Последние специфично связывают антигены (и близкие по строению вещества); образующийся комплекс антиген-антитело осаждается и выводится из организма.
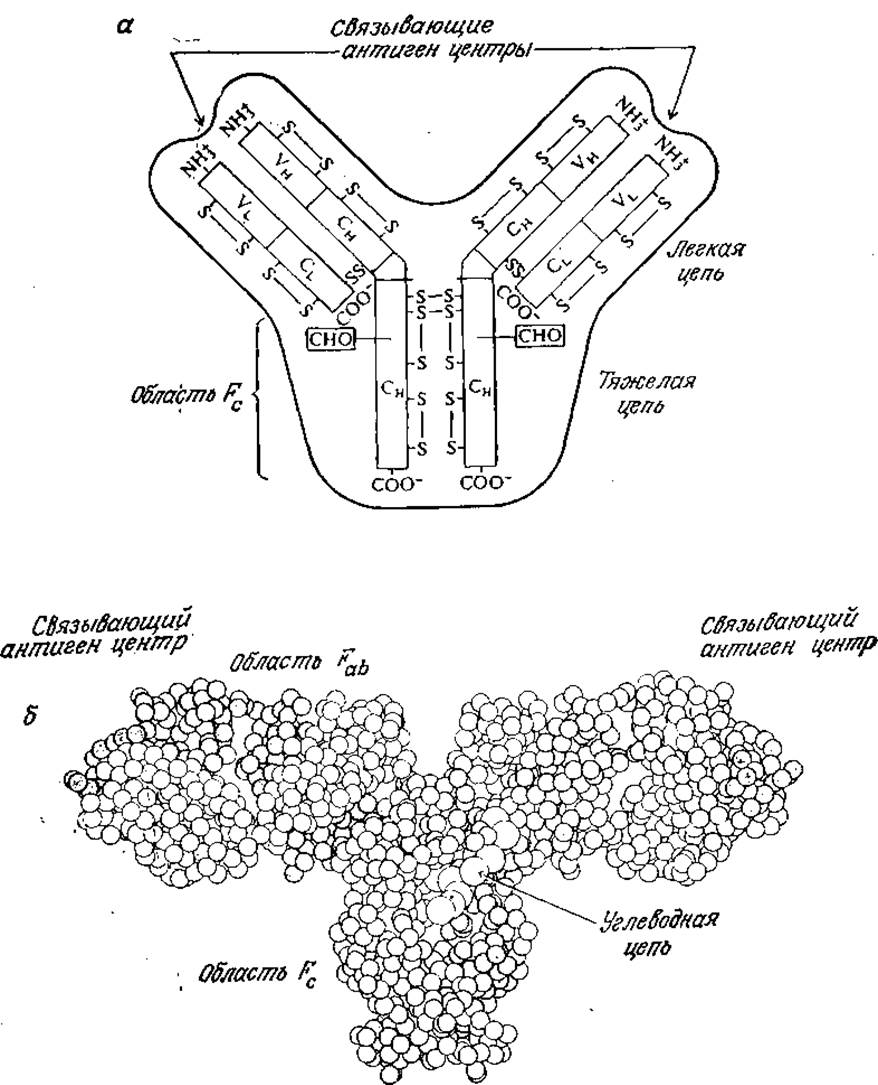
РИС. 2.26. а — схематичное изображение структуры иммуноглобулина. Символами С и V обозначены постоянные и вариабельные части цепей соответственно, а индексами Н и L — тяжелые и легкие цепи соответственно. Показаны дисульфидные связи, а также место присоединения углеводного остатка (СНО) к тяжелым цепям. Область ствола (Fc) и центр, связывающий антиген, расположены на карбоксильном и аминном концах тяжелых цепей соответственно. Специфичность связывания антигена и сродство к нему определяются вариабельными частями как тяжелых, так и легких цепей; б — молекулярная структура антитела IgG, иммуноглобулина G. [Воспроизведено с разрешения из работы; Silverton Е. W., Navia М. A., Davies D. R., Proc. Natl. Acad. Sсi., 74, 5142 (1977).]
Антитела представляют собой особый класс белков, называемых иммуноглобулинами; свойственные иммуноглобулинам общие детали структуры изображены на рис. 2.26. Молекула иммуноглобулина состоит из двух идентичных, более длинных «тяжелых» цепей, связанных друг с другом дисульфидными связями, а нековалентными связями с двумя другими, также идентичными, но более короткими «легкими» цепями. В наиболее широко распространенном классе иммуноглобулинов, обозначаемом IgG, легкие и тяжелые цепи имеют молекулярные массы 23 000 и 53 000 соответственно. C-Концевые участки как легких, так и тяжелых цепей, практически не отличающиеся по структуре в иммуноглобулинах одного типа, называют постоянными участками. Область Fc, представляющая собой ствол молекулы антитела, построена из С-концевых последовательностей постоянных участков тяжелых цепей.
Дифференциация антител в пределах одного типа осуществляется прежде всего в N-концевых участках цепей, называемых вариабельными. Связывающий антиген активный центр антитела (паратоп) формируется из вариабельных участкоз легких и тяжелых цепей. Как и в случае каталитической активности ферментов, связывающие антиген центры в различных антителах могут существенно различаться по своей специфичности и сродству к антигенам.