Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Другие факторы, влияющие на ферментативную активность
Влияние pH на кинетику ферментативных реакций в растворах
На рис. 2.15 приведены структурные формулы различных аминокислот, из которых построены все белки. Аминокислоты обладают основными, нейтральными и кислотными группировками, поэтому интактный фермент при любом заданном pH может содержать как положительно, так и отрицательно заряженные группы. Заряженные группировки часто входят в состав активных центров ферментов, так как в основе целого ряда механизмов ферментативного катализа лежит катализ кислотного или основного типа. Необходимым условием для осуществления кислотного или основного катализа может быть наличие определенного заряда на ионизируемых группах активного центра. Отсюда следует, что каталитически активная форма фермента существует только в одном строго определенном состоянии ионизации и в зависимости от pH в нее может превращаться большая или меньшая часть всего имеющегося в смеси фермента. На рис. 3.23 показано влияние pH на активность некоторых ферментов; нетрудно видеть, что по мере повышения pH каталитическая активность фермента достигает максимума (при оптимальном pH) и затем снижается.
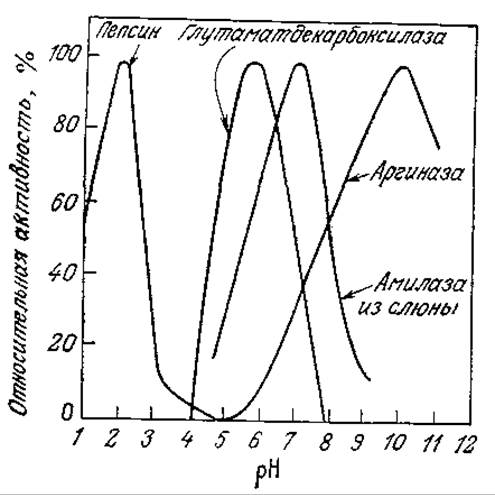
РИС. 3.23. Зависимости активности ферментов от pH и диапазона максимальной активности фермента от его природы. (Воспроизведено с разрешения из работы: Fruton J. S., Simmonds S., General Biochemistry, p. 260, John Wiley and Sons, Inc., New York, 1953.)
Полезное математическое выражение, связывающее активность фермента с pH, можно получить с помощью следующей простой модели ионизации активного центра:
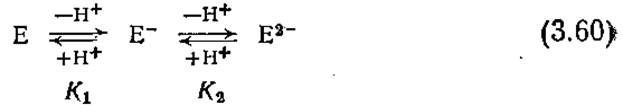
В этих кислотно-основных реакциях Е- обозначает активную форму фермента, а Е и Е2- — неактивные формы, образующиеся соответственно при протонировании и депротонировании активного центра Е-. Константы равновесия указанных реакций обозначены символами K1 и К2. Мы не будем здесь рассматривать другие состояния ионизации фермента, поскольку предполагается, что депротонирование Е- уже полностью инактивирует фермент.
Записав условия равновесия для двух ступеней ионизации в виде
![]()
где h+ = [Н+], мы можем определить относительное количество фермента, находящегося в активной форме. Если обозначить общую концентрацию фермента через е0, так что
е0 = е + е- + е2- (3.62)
то активная фракция фермента у- равна е-/е0 и определяется уравнением
![]()
Уравнение (3.63) представляет собой одну из pH-функций Михаэлиса. Две другие, у и у2-, определяют относительные количества фермента, находящегося в кислой и основной формах соответственно.
Зависимость функции у- от pH выражается кривой такого же типа, какие приведены на рис. 3.23 для экспериментально найденных зависимостей ферментативной активности от pH. Функция у- имеет один максимум при следующем pH:
![]()
где pKi =-1 gKi. Функция у- убывает равномерно и симметрично по мере удаления pH от оптимального значения.
Реакции протонирования и депротонирования представляют собой очень быстрые процессы по сравнению со скоростями большинства других реакций в растворах. Поэтому можно принять, что фракция фермента, находящегося в активном состоянии, равна у- и в том случае, когда этот фермент выполняет функцию катализатора. Отсюда следует, что выражение для максимальной скорости реакции можно получить, взяв вместо общей концентрации фермента е0 общую концентрацию его активной формы е0у-:
![]()
Располагая данными по ферментативной активности при различных pH, с помощью последнего уравнения можно определить параметры K1и К2. Действительно, pH максимальной активности фермента связан с K1 и К2 уравнением (3.64). Определяемая экспериментальным путем зависимость ферментативной активности от pH устанавливает независимую взаимосвязь между K1и К2, позволяя таким образом определить оба эти параметра.
Согласно расширенному толкованию уравнения Михаэлиса — Ментен для случая простейшей катализируемой ферментом последовательности реакций [уравнение (3.4)], pH может влиять и на константу Михаэлиса, Кm. В то же время если субстрат не может существовать в нескольких ионизированных состояниях, характеризующихся различным сродством к ферменту и если образование фермент-субстратных комплексов с каждой из форм фермента не влияет на K1и К2, то в таком случае можно показать, что Кm не зависит от pH. Экспериментальные данные показывают, что, как правило, Кm очень слабо зависит от pH, поэтому на практике для выражения зависимости скоростей катализируемых ферментами реакций от pH чаще всего пользуются только уравнением (3.65).
Никогда не следует забывать, что все приведенные выше рассуждения могут оказаться несостоятельными, если речь идет о значениях pH, значительно отличающихся от оптимальных. В такой ситуации нарушение сил, стабилизирующих конформацию нативного белка, может привести к его денатурации, и тогда даже после восстановления оптимального (или близкого к оптимальному) pH быстрая реактивация фермента становится маловероятной или вообще невозможной.