Основы биохимической инженерии Часть 1 - Бейли Дж., Оллис Д. 1989
Кинетика катализируемых ферментами реакций
Инактивация ферментов
Денатурация ферментов под действием механических факторов
Механические воздействия могут нарушить сложную геометрию молекул ферментов вплоть до их полной денатурации. К числу таких воздействий относятся и гидравлические силы, возникающие при движении потока жидкости. Эксперименты, позволяющие оценить влияние сдвига на ферментативную активность, проводились путем истечения через капилляр и с помощью вискозиметра с коаксиальными цилиндрами.
Обозначим символами θ и у время воздействия сдвига и его скорость соответственно (в случае истечения через капилляр под y подразумевается усредненная по поперечному сечению капилляра скорость). Изучение индуцированной сдвигом денатурации каталазы и уреазы показало, что потеря активности определяется произведением параметров θу (рис. 3.30, а). Результаты этих экспериментов еще раз свидетельствуют о том, что степень инактивации фермента обусловливается сочетанием интенсивности денатурирующего фактора и времени его действия. В то же время изучение лактатдегидрогеназы показало, что инактивация этого фермента в потоке определяется напряжением сдвига, а не его скоростью.
Приведенные на рис. 3.30, б данные убедительно свидетельствуют о частичной обратимости процесса индуцированной сдвигом инактивации уреазы. Кривая А отражает скорость превращения субстрата (мочевины) в заторможенном растворе уреазы, а кривая Б получена путем определения скорости той же реакции в вискозиметре с коаксиальными цилиндрами при скорости сдвига 1717 с-1. Очевидно, что движение жидкости сопровождается снижением активности фермента. Другие точки на рис. 3.30, б были определены после снятия гидравлического воздействия различной продолжительности. В этих случаях ферментативная активность после снятия сдвигового усилия сразу же начинает возрастать, но прежнего уровня не достигает. Остаточное различие в активности было объяснено частичной необратимой инактивацией.
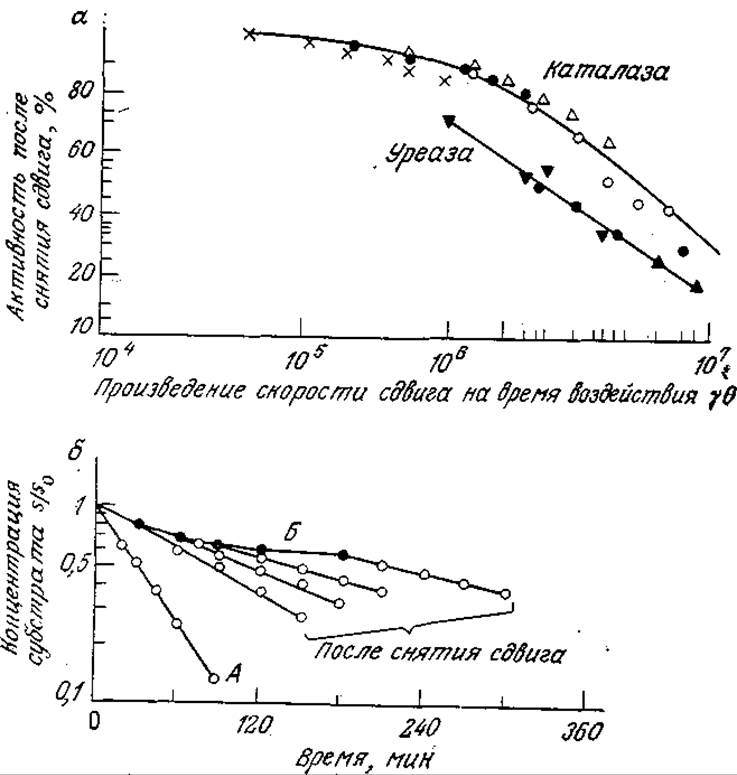
РИС. 3.30. а — инактивация каталазы и уреазы под воздействием сдвига (здесь различными символами обозначены разные скорости сдвига), б — конверсия мочевины раствором уреазы в состоянии покоя (А), под воздействием сдвига (скорость сдвига 1717 см-1) (5) и через разные периоды времени после снятия сдвига (0,4 единицы уреазы в 1 мл раствора, pH 6,75, 23 °С), [Результаты изучения каталазы воспроизведены с разрешения из статьи: Charm S. Е., Wong В. L., Enzyme Inactivation with Shearing, Biotech. Bioeng., 12, 1103 (1970). Данные по изучению уреазы воспроизведены из работы: Tirrell М., Middleman S., Shear Modification of Enzyme Kinetics, Biotech. Bioeng., 17, 299 (1975).]
Характерная для ферментов чувствительность к механическим воздействиям может налагать определенные ограничения на допустимую величину гидравлического усилия в ферментных реакторах, в которых для повышения скорости массопередачи субстрата используется перемешивание, или в системах ультрафильтрации растворов ферментов, когда повышение пропускной способности мембраны сопровождается увеличением напряжения сдвига и растяжения непосредственно перед мембраной и сразу после нее.
Денатурацию белков и, следовательно, инактивацию ферментов часто вызывает и другое механическое воздействие — поверхностное натяжение. Поскольку поверхностное натяжение на границе раздела между воздухом и чистой водой составляет 80 дин/см, пенообразование обычно вызывает денатурацию белков, адсорбированных на границе раздела фаз. Граница раздела между двумя жидкими фазами характеризуется значительно более низким поверхностным натяжением; считается, например, что плазматическая мембрана клетки имеет поверхностное натяжение порядка 1 дин/см или даже меньше. Очевидно, низкие поверхностные натяжения не инактивируют ферменты, поскольку, как хорошо известно, в таких плазматических мембранах существуют многие активные белки. Пенное фракционирование представляет собой метод разделения, основанный на концентрировании выделяемого вещества на границе раздела фаз поверхностно-активное вещество — воздух; в этих условиях белки не денатурируют, так как поверхностно-активное вещество снижает поверхностное натяжение в системе вода — воздух до величин порядка 1 дин/см.
В технологических процессах и иногда в лабораторных экспериментах на скорость инактивации ферментов одновременно влияют различные механические и химические факторы, например окисление. Сложная природа проявления этих взаимозависимых факторов хорошо освещена в работе Томаса и Даннилла*, в которой, в частности, тщательное изучение влияния сдвига на те же ферменты (см. рис. 3.30) привело к иным результатам и показало, что один только сдвиг вызывает незначительную инактивацию ферментов. Кроме упоминавшихся факторов на инактивацию ферментов могут оказывать влияние расширяющиеся потоки, кавитация, локальный адиабатический нагрев, следы металлов и поверхностная денатурация в полостях. Более подробные сведения о проблеме денатурации читатель может найти в приведенной в конце главы литературе. Нам же достаточно запомнить одно общее правило: если фермент in vitro находится по существу в такой же среде и в таких же условиях, как и in vivo, он будет активен. При изменении любого из параметров, характерных для естественных условий существования фермента, появляется вероятность его инактивации.
* Thomas С. R., Dunnill Р., Action of Shear on Enzymes: Studies with Catalase and Urease, Biotechn. Bioeng., 21, 2279 (1979).
Это правило находит многочисленные применения в биохимической технологии. Так, если нам нужен фермент, активный при экстремальных значениях pH или температуры, то целесообразно прежде всего попытаться найти организм, для которого эти экстремальные условия являются нормальными. Часто такой организм содержит ферменты, способные эффективно функционировать именно в таких необычных условиях. Показательным примером может служить обнаружение продуцируемых микроорганизмами ферментов, обладающих устойчивостью в щелочных средах; эти ферменты успешно применяются в качестве добавок к стиральным порошкам, растворы которых обычно имеют pH 9,0—9,5.