ОСНОВЫ СТРОЕНИЯ И КИНЕТИКИ ФЕРМЕНТОВ В БИОЛОГИЧЕСКИХ СИСТЕМАХ - О. А. Науменко - 2017
1. Общие принципы структурной организации белков ферментов
1.1 Определение энзимологии как науки, история открытия, номенклатура и классификация ферментов
1.1.1 Определение энзимологии как науки
Энзимология - это раздел биохимии, который изучает ферменты. Энзимы - это специализированные белки, которые являются биологическими катализаторами и обладают нативной конформацией.
От обычных функциональных белков ферменты отличает то, что на поверхности белковой глобулы у них имеется активный центр (АЦ). Это участок, образованный из различных аминокислотных остатков, собранных из различных областей полипептидной цепи, где происходит связывание и превращение субстрата. При этом субстратом называется химическое соединение, претерпевающее изменение в ходе каталитического процесса, с образованием продукта реакции.
Кроме активного центра, у некоторых ферментов имеется еще и регуляторный участок - аллостерический центр (АлЦ). В этом участке связываются молекулы, оказывающие влияние на превращение субстрата в химической ферментативной реакции. При этом сами ферменты не претерпевают изменений.
В активном центре фермента располагаются аминокислотные остатки, содержащие функциональные группы (-SH, -СООН, -ОН, -NH2), которые принимают участие в каталитическом процессе. Условно активный центр фермента можно разделить на два участка: сорбционный, отвечающий за связывание субстрата, и каталитический, в котором происходит превращение субстрата. Размер активного центра фермента определяется размером субстрата, реализуя в действии принцип индуцированного соответствия. Геометрия расположения функциональных групп активного центра соответствует природе субстрата, определяя эффективность его связывания и превращение в ходе химической ферментативной реакции.
Константа, характеризующая эффективность превращения субстрата в активном центре фермента, называется каталитической константой (Кк), а константа, определяющая сродство субстрата к ферменту, - константой связывания (Ks). Действие эффекторов (активаторов и ингибиторов) определяют с помощью констант активирования (Ка) и ингибирования (Ki).
Активность фермента зависит от природы фермента, субстрата, их концентраций, межсубъединичных взаимодействий белковых глобул, состава раствора, природы растворителя, ионной силы раствора, pH среды, присутствия ингибиторов и активаторов, температуры, давления, УФ-облучения и других физических факторов. С повышением температуры среды активность ферментов возрастает, однако при температуре выше 50°С наблюдается снижение активности фермента из-за разрушения нативной структуры белковой глобулы. Возрастание температуры сопровождается увеличением подвижности функциональных групп в области активного центра и изменением нативной конформации белка.
Влияние pH на активность фермента может проявляться через ассоциативное поведение ионизирующих групп активного центра и функциональных групп субстрата. На активность фермента может также повлиять поведение групп, расположенных на поверхности белковой глобулы, ионизация которых может приводить к изменению конформации белка фермента.
1.1.2 История формирования энзимологии как науки
Зарождение учения о ферментах относится к первой половине XIX века. Первое научное представление о ферментах было дано еще в 1814 г. Петербургским ученым К.С. Кирхгофом, который показал, что не только проросшие зерна ячменя, но и экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество, извлекаемое из проросшего ячменя и обладающее способностью превращать крахмал в мальтозу, получило название амилазы.
Ю. Либих и Ф. Веллер открыли агент, расщепляющий амигдалин, содержащийся в эфирном масле горького миндаля. Этот агент был назван эмульсином. В последующие годы были описаны другие ферменты, в частности пепсин и трипсин, вызывающие распад (гидролиз) белков в пищеварительном тракте. В 1913 году Михаэлис и Ментен выдвинули теорию механизма работы ферментов.
В 1926 году (считается официальным годом рождения энзимологии как науки) Самнер выделил кристаллическую уреазу и доказал ее белковую природу. С тех пор было обнаружено и выделено более 700 ферментов, но в живых организмах их существует гораздо больше. В 1929 году другой биохимик - Д. Нортроп сообщил о выделении им кристаллического препарата пепсина, а затем трипсина и других ферментов. В 1946 году Нортроп и Самнер были удостоены Нобелевской премии за открытие белков ферментов.
В 1969 году Меррифильд (Нью Йорк) синтезировал искусственно рибонуклеазу и доказал, что все ферменты являются белками.
1.1.3 Направления исследований в области энзимологии
Перечислим основные современные направления исследований в энзимологии:
1) исследования более тонких деталей молекулярного механизма и принципов действия ферментов в соответствии с законами классической органической химии и квантовой механики, а также совершенствование теории ферментативного катализа;
2) изучение ферментов на более высоких уровнях (надмолекулярном и клеточном) структурной организации живых систем, причем не столько отдельных ферментов, сколько ферментных комплексов в сложных системах;
3) исследование механизмов регуляции активности и синтеза ферментов и вклада химической модификации в действие ферментов;
4) развитие исследований в области создания искусственных низкомолекулярных ферментов - абзимов (синтетические аналоги ферментов), наделенных аналогично нативным ферментам высокой специфичностью действия и каталитической активностью, но лишенных побочных антигенных свойств;
5) исследования в области инженерной энзимологии (белковая инженерия), создание «гибридных» катализаторов, сочетающих свойства ферментов, антител и рецепторов, а также создание биотехнологических реакторов с участием индивидуальных ферментов или полиферментных комплексов, обеспечивающих получение и производство наиболее ценных материалов и средств для народного хозяйства и медицины;
6) исследования в области медицинской энзимологии, основной целью которых является выяснение молекулярных основ наследственных и соматических болезней человека, в основе развития, которых, лежат дефекты синтеза ферментов или нарушения регуляции активности ферментов в организме человека.
1.1.4 Номенклатура и классификация ферментов
Современные классификация и номенклатура ферментов были разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 году в Москве.
Существуют три основных принципа классификации ферментов:
1) по химической природе фермента;
2) по химической природе субстрата;
3) по типу катализируемой реакции.
Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых выделяют несколько подклассов, подподклассов и каждый фермент имеет свой порядковый номер:
1) оксидоредуктазы;
2) трансферазы;
3) гидролизы;
4) лиазы;
5) изомеразы;
6) лигазы (синтетазы).
1.1.4.1 Оксидоредуктазы.
К классу оксидоредуктаз относят ферменты, катализирующие окислительно - восстановительные реакции с участием двух субстратов, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД+ оксидоредуктаза для фермента лактатдегидрогеназы (ЛДГ).
Различают следующие основные подклассы оксидоредуктаз:
- аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород;
- анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород;
- цитохромы, катализирующие перенос только электронов.
К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.
1.1.4.2 Трансферазы.
К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа - трансфераза».
Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например, метил- и формил - трансферазы, ацетилтрансферазы, аминотрансферазы, фосфотрансферазы и др.
1.1.4.3 Гидролизы.
В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат - гидролаза». К ним относятся:
1) эстеразы - ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров;
2) гликозидазы, ускоряющие разрыв гликозидных связей;
3) фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей;
4) амидазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
1.1.4.4 Лиазы.
К классу лиаз относят ферменты, катализирующие разрыв связей С-О, С-С, C-N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат - лиазы». Например, фермент фумарат - гидратаза (систематическое название «L - малат - гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси - лиазы), амидин - лиазы и др.
1.1.4.5 Изомеразы.
К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат - цис - транс - изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза».
К этому же классу относят рацемазы и эпимеразы, действующие на амино - и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т. д.
1.1.4.6 Лигазы (синтетазы).
К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтетаза»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин.
1.1.5 Мономеры и олигомеры
По своей структуре все белки - ферменты делятся на:
1) мономеры (однокомпонентные) простые белки, состоящие из одной глобулы;
2) олигомеры (двухкомпонентные) - состоящие из двух и более субъединиц и содержащие наряду с белковой частью (апофермент) и небелковую часть (кофактор).
1.1.5.1 Мономерные ферменты обладают первичной структурой.
Это строгая последовательность аминокислотных остатков в полипептидной цепи, соединенных пептидными связями.
Вторичная структура мономерного белка фермента это - способ укладки полипептидной цепи в определенную конформацию. Среди конформаций наиболее часто встречаются:
- α - спираль;
- β - складчатый лист;
- статический клубок (неупорядоченная структура);
- петле - и пальцеобразные структуры.
Но основной функциональной активности белка - фермента является третичная структура. Третичная или нативная структура - это трехмерная конформация полипептидной цепи в пространстве или способ укладки вторичной структуры в компактную структуру определённого объема. При сворачивании вторичной структуры в третичную образуются домены.
Домен - это участок в третичной структуре белка, который обладает структурной и функциональной автономией. В молекулах фермента может быть один или несколько доменов, их функции могут быть одинаковыми или разными. Домен одного и того же типа строения может входить в состав разных белков ферментов, это даёт схожесть их биологических и химических функций. К таким схожим доменам относится NAD - связывающий домен дегидрогеназ. Ферменты сконструированы по модульному принципу, где модулем является домен.
1.1.5.2 Структура олигомерных ферментов.
Олигомер - молекула в виде цепочки из небольшого числа одинаковых составных звеньев.
Этим олигомеры отличаются от полимеров, в которых число звеньев теоретически не ограничено. Верхний предел молекулярной массы олигомера зависит от его химических свойств. Свойства олигомеров сильно зависят от изменения количества повторяющихся звеньев в молекуле и природы концевых групп; с момента, когда химические свойства перестают изменяться с увеличением длины цепочки, вещество называется полимером.
Олигомерами также называются белковые комплексы, состоящие из двух и более субъединиц. При этом, комплексы из одинаковых субъединиц называются гомо - олигомерами, а из разных - гетеро - олигомерами.
В биохимии термин олигомер также используется для обозначения коротких фрагментов нуклеиновых кислот (ДНК и РНК). Такие олигомеры, размещенные на стеклянной подложке или нейлоновой мембране, используются в экспериментах с гибридизацией ДНК.
Белковые олигомеры относятся к четвертичной структуре белка и состоят из 2 и более глобул (субъединиц). Субъединицу называют протомером.
Если субъединицы:
1) одинаковые - гомогенный олигомер;
2) разные - гетерогенный олигомер.
Как правило, количество субъединиц чётное. Если субъединицы в составе олигомера разные, то они выполняют разные функции - каталитическую и регуляторную (аллостерическую).
В пределах одного организма могут встречаться изоферменты - это множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по физическим и химическим свойствам, в частности по сродству к субстрату, максимальной скорости катализируемой реакции (активности), электрофоретической подвижности или регуляторным свойствам. В основе номенклатуры и нумерации изоферментов лежит их электрофоретическая активность (подвижность к аноду) в катализе. Наиболее подвижным изоферментам присваивается первый номер. Биологическая роль изоферментов состоит в регуляции обмена веществ и адаптации.
Например, фермент лактатдегидрогеназа существует в виде двух субъединиц: сердечной (Н) и мышечной (М). Молекула фермента в организме может быть представлена пятью изоферментами с конформациями, состоящими из четырех субъединиц: НННН, НННМ, ННММ, НМММ, ММММ.
Контрольные вопросы по изучаемой теме
1. Что изучает энзимология?
2. Дайте характеристику шести основным классам ферментов.
3. Дайте цифровое обозначение фермента алкогольдегидрогеназы. К какому классу и подклассу относится данный фермент?
4. Что такое мономерные и олигомерные ферменты?
5. Что такое гомогенный олигомер?
6. Что такое гетерогенный олигомер?
7. Что такое изоферменты?
8. Что такое домен?
9. Как определить номер изофермента?
10. Что такое третичная конформация белка фермента?
1.2 Надмолекулярная организация ферментов
1.2.1 Виды надмолекулярных форм организации ферментов
Существует 3 вида надмолекулярных форм организации ферментов:
1) мультиферментные комплексы;
2) мультиферментные конъюгаты;
3) мультиферментные ансамбли.
Мультиферментные комплексы - это надмолекулярные образования, которые включают несколько ферментов и коферментов. В мультиферментном комплексе (рисунок 1.1) несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Комплекс образован за счет нековалентных связей. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.
Рисунок 1.1 - Строение мультиферментного комплекса

Примером работы мультиферментов являются реакции окислительного декарбоксилирования α - кетокислот (пирувата и α - кетоглутарата) под влиянием пируватдегидрогеназы и α-кетоглутаратдегидрогеназы.
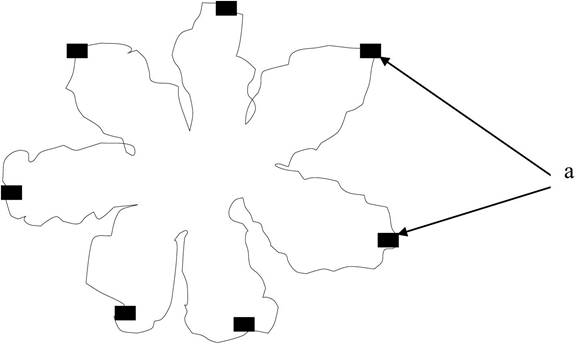
Мулътиферментные конъюгаты - это комплексы, в которых различные ферменты связаны в единую полипептидную цепь. Мультиферментный комплекс, состоящий из ковалентно соединенных ферментов, является более стабильным, чем комплекс, образованный нековалентными связями. Примером этого комплекса может служить комплекс синтеза жирных кислот (СЖК) у бактериальных клеток Е. соli и высших растений (рисунок 1.2).
Рисунок 1.2 - Мультиферментный конъюгат: а - активные центры фермента
Мультиферментные ансамбли (метаболоны) - наиболее высокоорганизованная мультиферментная система, связанная с крупными надмолекулярными структурами, например, рибосомами или мембранами. В составе метаболонов каждый фермент находится в контакте с одним или несколькими ферментами этого метаболического пути. Структура элемента поддерживается за счет опоры (матрикса) клетки или ее органелл. Существуют 2 вида ансамблей:
1) адсорбционные (динамичные);
2) интегральные (белок - фермент встроен в мембрану).
1.2.2 Понятие о простетической группе в составе сложных ферментов
В составе сложных белков есть белковая часть - апофермент и добавочная часть - простетическая группа. Апофермент и простетическая группа представляют собой холофермент.
Добавочная группа в составе сложных ферментов называется кофактором и представляет собой низкомолекулярный компонент небелковой природы, обеспечивающий течение ферментативной реакции.
Различают две группы кофакторов:
1) ионы металлов (а также некоторые неорганические анионы);
2) коферменты, представляющие собой органические вещества.
Примерно треть из всех известных в настоящее время ферментов активируются ионами металлов. В роли кофакторов ферментов могут выступать различные по природе ионы металлов (Zn2+, Mg2+, Fe2+, Fe3+, Ca2+, u2+, Na+, К). К коферментам относят: производные витаминов, нуклеотиды: НАД —> НАДН, АТФ —> АДФ, глутатионы, липоевую кислоту.
Роль кофакторов:
1) изменение третичной структуры белка - фермента;
2) обеспечение комплементарности между ферментом и субстратом в ходе ферментативной реакции;
3) участие в реакции в качестве еще одного субстрата;
4) изменение структуры субстрата (роль активатора).
1.2.3 Роль металлов в качестве кофакторов
Ион металла может участвовать в присоединении субстрата в активном центре фермента, собственно в катализе, в стабилизации оптимальной конформации молекулы фермента и т. д.
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур. Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства
киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+ - АТФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента (рисунок 1.3).
Рисунок 1.3 - Комплекс Mg2+- АТФ
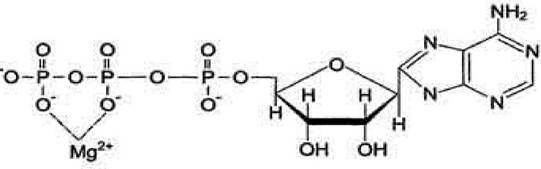
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить, как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла.
Коферменты окислительно - восстановительных ферментов (1 группа) делятся на 2 подгруппы:
1) окислительно - восстановительные коферменты - переносят протоны водорода (НАД, НАДН, липоевая кислота, убихинон);
2) нуклеозидфосфаты - переносят остатки фосфорной кислоты (АТФ, АДФ, АМФ).
1.2.4. Активный центр ферментов
Активный центр - это кластер специфических радикалов аминокислот, определенным образом расположенных в пространстве и определяющих специфичность и каталитическую активность ферментов. Он образуется в третичной структуре белка. Активный центр вступает во взаимодействие либо с субстратом, либо с кофактором.
Аминокислотные остатки, которые входят в состав активного центра, называются каталитическими группами (R - группами).
R группы делятся на: нуклеофильные (минус) и электрофильные (плюс) (таблица 1.1).
Таблица 1.1 - Электрофильные и нуклеофильные группы АЦ фермента
Нуклеофильные группы |
Электрофильные группы |
Имидозольное кольцо гистидина |
Положительный ион имидозолия |
ОН - группа тирозина SH- группа цистеина |
Неионизированные карбоксильные группы |
NH4- группа лизина |
Ионы металлов |
Ионизированная карбоксильная группа аспарагиновой и глутаминовой аминокислот |
Коферменты |
1.2.5 Особенности строения активного центра
На активный центр приходится малая часть объема белковой молекулы. Так, например, если вся белковая молекула состоит из 100 000 аминокислотных остатков, то на активный центр приходится только от 10 до 30 аминокислот.
Активный центр может быть двухкомпонентным и монокомпонентным.
Двухкомпонентный АЦ встречается у сложных белков и включает в себя кофактор или кофермент.
Монокомпонентный АЦ - у простых белков ферментов и представлен только аминокислотами.
Связь фермента и субстрата относительно слабая по своей силе. Специфическое взаимодействие фермента и субстрата определяется расположением атомов в активном центре фермента, при этом часто соответствие активного центра фермента и центров связывания молекулы субстрата представляют, как «ключ и замок». Некоторые активные центры ферментов не являются жесткими структурами, поэтому они становятся комплементарными в процессе образования фермент - субстратного комплекса (теория Кошланда, или «теория гибкого активного центра»). Активный центр фермента при этом меняет свою конфигурацию «настраивается» относительно структуры субстрата - индуктора по принципу индукции соответствия (динамического узнавания). В зависимости от присутствия в АЦ реакционных радикалов, активный центр фермента приобретает свойства:
1) кислоты;
2) основания;
3) кислотно - основные: полифункциональный катализ, если в активном центре нуклеофильные и электрофильные группы.
Методом рентгено - структурного анализа и кристаллографии белковой молекулы установлено, что активный центр локализуется:
1) в стандартном дефекте, «вмятине», расположенной, в архитектуре белковой глобулы. В таком положении субстрат будет окружен и одновременно атакован многими боковыми цепями белка.
2) в месте стыков доменов. Например, у сериновых протеаз активный центр находится на стыке двух доменов. Такое положение способствует формированию особой среды активного центра.
1.2.6 Свойства среды активного центра ферментов
Среда АЦ фермента обладает рядом свойств:
1) микрогетерогенностью, которая обусловлена двумя факторами:
- в образовании активного центра фермента участвует не только полярные R- группы, но и частично аполярные углеводородные боковые группы аминокислотных остатков. Например, для альфа - хемотрипсина установлено, что на поверхность выходит 10 из 23 валинов, 10 из 15 изолейцинов, 6 фенилаланинов;
- в поверхность боковой молекулы прочно встроены молекулы воды - растворителя.
2) низкой диэлектрической проницаемостью (Дэп), по сравнению с водой. Для воды Дэп = 80, в сорбционном центре хемотрипсина Дэп =10;
3) пониженной полярностью (по сравнению с водой). Установлена методом флюоресценции органических соединений в сравнении с водой;
4) локальной высокополярностъю. Рядом с участками с повышенной полярностью в поверхностных областях активного центра регистрируется высокая полярность за счет диполей пептидных связей. Их близкое расположение ведет к образованию участков с высокой напряженностью электрического поля (10 - 100 мВ/см);
5) микровязкостью. В активном центре аминокислоты расположены так плотно, что затруднено поступательное движение молекул и вращательное движение молекул. Все это способствует прекращению диффузии между молекулами белка - фермента и субстрата.
Изучение поверхностного слоя фермента позволяет ответить на вопрос «Почему ферментам удается ускорять скорость реакции?»:
1) в активом центре сосредоточено большое количество функциональных групп, которые одновременно взаимодействуют с субстратом;
2) среда активного центра обладает микрогетерогенностью, где гидрофобные участки чередуются с гидрофильными областями с локальной высокополярностью;
3) поверхностный слой белка - фермента характеризуется микровязкостью и ограничивает диффузию между субстратом и ферментом.
Все свойства активного центра способствуют к многоцентровому взаимодействию между молекулой фермента и субстрата.
Причинами ускорения химической реакции, катализируемой ферментами по сравнению гомогенными каталитическими процессами без участия фермента, являются:
1) сорбционное взаимодействие боковых субстратных групп с молекулой фермента. Субстрат подвергается каталитической атаке не одной, а нескольких R -групп. Сорбционное взаимодействие ускоряет реакцию в 107 раз и более;
2) полифункциональный характер катализа: за счет нуклеофильного, или электрофильного катализа ускорение химической ферментативной реакции идет 103 раз;
3) микрогетерогенность среды АЦ дает самое высокое повышение.
1.2.7 Аллостерический центр
У некоторых белков - ферментов есть аллостерический центр или регуляторный центр - участок молекулы фермента, с которым связываются низкомолекулярные химические соединения - эффекторы (модификаторы), изменяя активность фермента. Эффекторы делятся на:
1) активаторы (ионы металлов);
2) ингибиторы (тяжелые металлы), которые могут быть обратимыми и необратимыми.
1.2.8 Определение активности ферментов
Активность ферментов определяется единицами активности - каталами (Е). 1 катал - это такая единица активности фермента, когда фермент способен катализировать превращение 1 молекулы субстрата за 1 секунду при температуре 25 градусов.
Для ферментативной реакции определяется скорость реакции - кинетический показатель - число полных каталитических циклов, осуществляемых ферментом за единицу времени. (Например, для пепсина 8 циклов за 1 минуту).
Удельная активность фермента - скорость реакции, которая относится к 1 миллиграмму белка - фермента.
Контрольные вопросы по изучаемой теме
1. Какие виды надмолекулярных форм организации ферментов выделяют?
2. Дайте понятие простетической группы в составе сложных ферментов.
3. Какова роль металлов в структуре ферментов?
4. Какое строение имеет активный центр ферментов?
5. Где располагается АЦ?
6. Какие нуклеофильные радикалы входят в состав АЦ фермента?
7. Какие электрофильные радикалы входят в состав АЦ фермента?
8. Что такое аллостерический центр фермента?
9. Что такое 1 катал?
10. Что такое удельная активность фермента?
1.3 Принципы пространственной организации молекулы фермента
1.3.1 Силы стабилизирующие третичную структуру белка - фермента
Третичной структурой белка называется трехмерная пространственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, которые могут располагаться на значительном расстоянии в полипептидной цепи.
В стабилизации третичной структуры белковой молекулы участвуют ковалентные связи (дисульфидные), но основную роль играют нековалентные связи:
1) водородные;
2) электростатические взаимодействия заряженных групп;
3) межмолекулярные Ван - дер - Ваальсовы силы;
4) гидрофобные связи - взаимодействия неполярных радикалов аминокислот. Стабильность третичной структуры зависит от системы нековалентных взаимодействий внутри белковой глобулы. Некоторые белки дополнительно стабилизируются ковалентными - дисульфидными связями между SH- группами цистеина.
1.3.2 Термодинамика сворачивания третичной структуры белка
Процесс сворачивания белка в нативную конформацию осуществляется самопроизвольно при условии снижения энергии Гиббса термодинамической системы (∆G <0), согласно закону Гиббса:
∆G = ∆Н - T∆S, (1.1)
где ∆G - энергия Гиббса; ∆Н - энтальпия системы; Т - температура системы; ∆S - энтропия термодинамической системы.
Для выполнения самопроизвольного процесса сворачивания молекулы белка фермента, энтальпия должна снижаться, а энтропия увеличиваться. Данный процесс обеспечивается разрывом одних связей и формированием новых внутримолекулярных связей в молекуле белка - фермента. Основную термодинамическую роль в процессе сворачивания белка играют водородные и гидрофобные связи. Значительно меньший вклад вносят дисульфидные связи, электростатические взаимодействия и Ван - дер - Ваальсовы силы.
1.3.3 Значение водородной связи
Водородная связь образуется между полярными аминокислотными остатками. Энергия одной водородной связи составляет 3 ккал/моль. За счет большого количества водородных связей, которые образуются в процессе сворачивания белка в третичную конформацию, энтальпия белковой молекулы растет, что является термодинамически невыгодным процессом. Но при сворачивании идет не только образование новых водородных связей, но и разрыв ранее существовавших, что в целом, снижает энтальпию системы и способствует незначительному росту энтропии, что термодинамически выгодно.
При образовании третичной структуры возникает максимальное число водородных связей внутри белковой глобулы, но при формировании всей белковой глобулы снижается энтропия пептидной связи первичной структуры, при этом повышается энтропия растворителя - молекул воды, что лишает стабильности структуру молекулы белка и также способствует процессам сворачивания фермента в нативную конформацию.
Разрыв отдельных водородных связей во вторичной структуре приведет к снижению энтальпии и повышению энтропии, что также способствует процессу сворачивания.
1.3.4 Роль гидрофобных связей
На втором месте по значению в процессе самопроизвольного сворачивания белка и стабилизации его третичной структуры находятся гидрофобные связи. Они образуются между неполярными аминокислотами и водой. Выигрыш в энергии образуется за счет образования пустот в динамичной структуре воды (квазикристаллическая структура или «льдоподобная» вода). Динамичные пустоты образуют поверхность раздела белка и воды. Гидрофобные связи в целом повышают энтропию между молекулой белка и молекулами растворителя - воды. Чем меньше поверхность раздела, тем меньше энтропия белковой молекулы, поэтому в процессе сворачивания белок стремится уменьшить термодинамически невыгодный контакт с водой и формирует гидрофобное ядро в форме шара. В целом гидрофобные связи повышают энтропию системы.
1.3.5 Значение Ван - дер - Ваальсовых связей
Ван - дер - Ваалъсовы связи возникают при сближении неполярных аминокислот, что незначительно снижает энтропию сворачивания белка в третичную конформацию.
1.3.6 Значение электростатических связей
Электростатические связи возникают между карбоксильными остатками (СООН - группами) дикарбоновых аминокислот и аминогруппами диаминокарбоновых кислот. Так, аспарагиновая и глютаминовая кислоты, имеют отрицательный заряд, а гистидин, аргинин и лизин - радикалы с положительным зарядом. В результате разной электроотрицательности происходит обмен электронами и образуются солевые мостики. Электростатические связи незначительно снижают энтропию в процессе сворачивания белка.
1.3.7 Роль дисульфидной связи
Дисульфидная связь возникает между остатками цистеина. Поскольку цистеин редко входит в состав белков, большинство ферментов ее не имеют. На процесс сворачивания дисульфидные связи в целом оказывают отрицательный эффект за счет снижения энтропии (энтропийные потери).
Значение дисульфидных связей:
1) дисульфидная связь облегчает процесс правильного пути сворачивания белка в нативную конформацию, т. к. образуется одной из первых;
2) ковалентная дисульфидная связь повышает энтропию белковой молекулы;
3) дисульфидные связи сохраняются у денатурированных белков;
4) в процессе сворачивания белка дисульфидные связи уменьшают число возможных конформаций молекулы белка - фермента;
5) образование дисульфидных связей не предшествует процессу сворачивания белка в глобулу, а лишь способствуют этому процессу и корректирует его;
6) в процессе сворачивания могут образовываться неправильные дисульфидные связи, которые после формирования белковой глобулы разрушаются.
Таким образом, стабилизация третичной структуры зависит не только от структуры самого белка, но и от структуры растворителя воды. Поэтому изменение структуры воды: нагревание или замораживание дестабилизирует третичную структуру белка и приводит к денатурации - утрате третичной конформации и ферментативных свойств.
Термодинамика сворачивания третичной структуры белка характеризуется тем, что факторы сворачивания и факторы, действующие в противоположном направлении, сбалансированы. Поэтому белковая молекула часто утрачивает стабильность при незначительном изменении параметров системы. Энергия одной водородной связи составляет 3 ккал/моль, а изменение свободной энергии системы в процессе сворачивания белка составляет ∆G =10 ккал/моль.
1.3.8 Физическая форма третичной структуры белка-фермента
В нативной структуре фермента выделяют ядро, состоящее из неполярных аминокислот и гидрофильную оболочку, представленную полярными АКО (рисунок 1.4).
Рисунок 1.4 - Схема строения молекулы белка - фермента
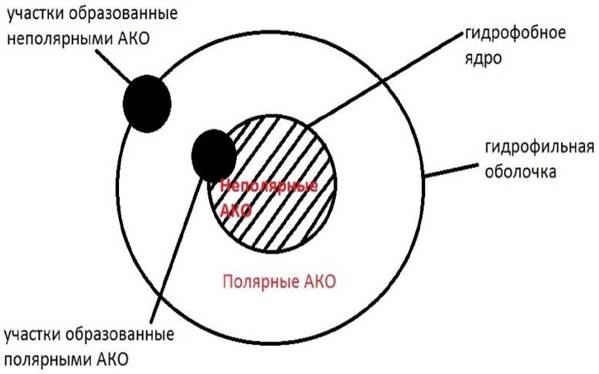
Неполярные аминокислоты в результате сворачивания и образования гидрофобных связей находятся внутри белковой молекулы. Участки из полярных аминокислотных остатков в гидрофобном ядре формируют активный центр фермента, а участки из неполярных аминокислотных остатков на поверхности фермента формируют аллостерический центр.
Участки из неполярных аминокислотных остатков могут формировать элементы четвертичной структуры и надмолекулярные структуры. Полярные остатки могут находится внутри ядра, между ними образуются электростатические, водородные и Ван-дер-Ваальсовы связи.
Контрольные вопросы по изучаемой теме
1. Перечислите силы стабилизирующие третичную структуру белка фермента.
2. Какая энергия обеспечивает самопроизвольное протекание термодинамических процессов сворачивания третичной структуры белка?
3. Какова роль водородной связи в сворачивании третичной структуры белка?
4. Какова роль гидрофобных связей в сворачивании третичной структуры белка?
5 Какова роль Ван-дер-Ваальсовых связей в сворачивании третичной структуры белка?
6. Какова роль электростатических связей в сворачивании третичной структуры белка?
7. Какова роль дисульфидных связей в сворачивании третичной структуры белка?
8. Дайте характеристику физической форме третичной структуры белка - фермента.
1.4 Механизм формирования пространственной структуры белков - ферментов
1.4.1 Парадокс Левенталя
У белковой цепи есть бездна возможных конформаций (каждый аминокислотный остаток имеет около 10 возможных конформаций, то есть цепь из 100 остатков - порядка 10100возможных конформаций). Так что белок должен искать «свою» пространственную структуру среди 10100 возможных вариантов. И так как переход из одной конформации в другую занимает в среднем около 10-13 секунды, то как минимум, перебор всех 10100 структур должен занимать порядка 1080лет, на фоне которых время жизни нашей Вселенной - 1010лет - величина бесконечно малая. Возникает вопрос: как белок «находит» свою единственно возможную структурную конформацию за минуты?
Ученые установили, что нативная конформация белка обладает рядом свойств:
1) нативная пространственная структура белка по всем тестам ведет себя как самая кинетически стабильная во времени;
2) с точки зрения термодинамики нет никаких доказательств, что данная структура наиболее устойчива в термодинамическом плане.
С. Левинталь предположил, что нативная структура белка определяется не стабильностью, не термодинамикой, а кинетикой, т.е. она соответствует не глобальному, а наиболее быстро достижимому минимуму свободной энергии молекулы.
Решение парадокса Левинталя следующее:
1) к формированию третичной структуры белка фермента ведет цепь быстрых превращений не требующих дополнительной энергии, т. е. свободной энергии;
2) пространственную структуру белка определяет его первичная структура (зашифрованная в генетическом коде), т. е. именно генетический код определяет пространственную структуру белка, а не работа внеклеточных структур во время его синтеза;
3) процесс сворачивания белка в нативную конформацию многостадийный и осуществляется по принципу иерархии.
1.4.2 Стадии сворачивания белка, иерархический принцип сворачивания
Согласно современным представлениям, процесс сворачивания белка имеет иерархическую природу и осуществляется строго последовательно в четыре стадии:
1) очень быстрая: формирование элементов вторичной структуры, служащих как бы «затравками» для образования более сложных архитектурных мотивов (за десятую долю микросекунды α-спираль охватывает пептид из 20-30 остатков);
2) очень быстрая: специфическая ассоциация некоторых элементов вторичной структуры с образованием супервторичной структуры: сочетания нескольких α-спиралей, нескольких β-цепей либо смешанные ассоциаты данных элементов;
3) медленная: формирование «расплавленной глобулы» (создание основных элементов третичной структуры - сочетание α-спиралей, β-тяжей, соединяющих петель и образование гидрофобного ядра молекулы, и формирование доменов);
4) формирование нативной структуры белка - ’’затвердевание», формирование оболочки (несколько минут).
1.4.3 Термодинамическая характеристика процесса сворачивания
Процесс сворачивания белка осуществляется самопроизвольно за счет снижения свободной энергии системы: повышения энтропии и понижения энтальпии. Каждая стадия сворачивания белка обеспечивается энергией:
1 стадия: обеспечивается за счет разрыва и образования водородных связей, которые снижают энтальпию. Установлено, что чем больше альфа-спиралей в молекуле белка, тем ниже энтальпия.
2 стадия: за счет гидрофобных взаимодействий АКО, которые повышают энтропию.
3 стадия: за счет гидрофобных связей, обеспечивающих 2/3 всей работы по сворачиванию белка.
4 стадия: «отвердевание» за счет Ван - дер - Ваальсовых, водородных, электростатических связей. Водородные связи обеспечивают точность межатомных взаимодействий.
1.4.4 Внутриклеточная регуляция пространственной структуры белка
В настоящее время установлено два механизма регуляции сворачивания нативной структуры белка:
1) Механизм регуляция скорости сворачивания: на этапе превращения «расплавленной глобулы» в твердый белок. Осуществляется за счет специальных ферментов, которые ускоряют процесс сворачивания. К ним относятся два белка- фермента:
- пептидилпролил-цис/транс-изомераза, которая осуществляет перевод АКО из транс-конформации на рибосомах в цис- конформацию, необходимую для образования пространственной структуры.
протеиндисульфидизомераза, которая катализирует образование и изомеризацию дисульфидных связей в молекуле белка.
2) Механизм защиты частично свернутого белка от неспецифических агрегаций. Осуществляется за счет специальных белков - гистонов. Они увеличивают эффективность сворачивания полипептидной цепи и защищают белок от неспецифических агрегаций. Данные белки называют шаперонами.
Шапероны (chaperon - пожилая дама, сопровождающая молодую девушку на балы и пр., наставник, сопровождающий группу молодежи).
Функции шаперонов:
1) Связываются с развернутой или частично развернутой конформацией полипептидной цепи и не дают ей «запутаться»;
2) Удерживают частично развернутый белок;
3) Способствуют переносу белка в развернутом состоянии через мембранные структуры в различные органеллы клеток;
4) Создают условия для эффективного сворачивания белка.
Виды белков - гистонов. Гистоны относятся по своему классу к белкам «теплового шока». В обычных условиях каждая клетка содержит определенный набор шаперонов. Их синтез возрастает в стрессовых ситуациях (например, при повышении температуры).
Классифицируют шапероны по их молекулярной массе и делят на два семейства:
1) шаперонины - большие белки. Образуют сложные комплексы: hsp 10 и hsp 60;
2) шапероны: hsp 70. Состоят из 1 - 2 полипептидных цепей и удерживают белок, сходящий с рибосомы, в развернутом состоянии, обеспечивают его транспорт внутри цитоплазмы после схождения с рибосомы, передают другому шаперонину для обеспечения дальнейшего сворачивания и транспорт через мембраны митохондрий, ЭПС. У митохондрий обнаружен свой шаперон hsp 50.
Освобождение белка от шаперонов связано со способностью шаперонов связываться с АТФ или АДФ. Отщепление происходит под действием фермента АТФазы.
Контрольные вопросы по изучаемой теме
1. В чем состоит парадокс Левенталя?
2. Назовите стадии сворачивания белка.
3. В чем состоит иерархический принцип сворачивания белка.
4. Решение парадокса Левинталя.
5. Термодинамическая характеристика процесса сворачивания.
6. Какая существует внутриклеточная регуляция пространственной структуры белка?
7. Какие ферменты регулируют процесс сворачивания белка.
8. Что такое шапероны. Какую функцию они выполняют в клетках?
9. Что такое шаперонины. Какова их функция?
1.5 Домены, структурная и функциональная характеристика
1.5.1 Определение доменов
Домен - это участок в третичной структуре белка, обладающий структурной и функциональной автономией. В процессе сворачивания белка в нативную конформацию на третьей стадии формируется гидрофобное ядро, образованное неполярными аминокислотными остатками. По данным рентгено — структурного анализа в структуре ядра определяются мозаичные участки, образованные либо гидрофильными остатками аминокислот, либо гидрофобными с признаками структурной и функциональной автономии. Домены формируются на 3 стадии сворачивания белка.
Процесс происходит в следующей последовательности:
1) независимое сворачивание отдельных доменов;
2) установление контактов между отдельными доменами. Для мономеров, когда между отдельными доменами формируется активный центр фермента. Для олигомеров: домены образуются на стыке субъединиц.
1.5.2 Доказательства доменной стадии сворачивания белка
В 1969 году получено первое доказательство доменной стадии сворачивания белка по данным кристаллографии лизоцима. Установлено, что он имеет несколько компактных глобул.
В 1971 году обособленные структурные образования выделены у белков иммуноглобулинов Каннингхэмом, который предположил, что существует независимый генетический контроль доменной области в структуре белка. Такие области были названы доменами;
В 1972 году Дж. Бирктофт и Д. Блоу выделили два домена у альфа- хемотрипсина, каждый из которых имеет цилиндрическую форму и образован шестицепочечной антипараллельной бета - структурой. Такой же тип строения был определен у других протеолитических ферментов: эластазы, трипсина, аспартатной протеиназы.
Изучение ферментативной активности белков показало, что в ферментативной реакции участвует не вся белковая молекула, а лишь небольшая ее часть (активный центр). Вся остальная часть белковой глобулы служит основанием или каркасом, обеспечивающим правильное положение аминокислотных остатков в активном центре. Поэтому белки с различной первичной структурой могут иметь одинаковые химические функции, но принадлежать к разным структурным классам белков. К ним относятся: двухдоменный белок трипсин, однодоменный белок субтилизин (из альфа- спиралей и бетта - структур);
Д. Уетлауфер объясняет существование доменов спецификой механизма самопроизвольной сборки аминокислотной последовательности в нативную конформацию. Он различает 2 вида доменов: с непрерывной и разрывной полипептидной цепью. Элементом, цементирующим структуру домена, считается ядро (нуклеация) из 8 - 18 остатков. Ядро служит матрицей для укладки полипептидной цепи домена размером в 40 - 150 аминокислотных остатков. Такая организация домена обеспечивает быструю спонтанную сборку всей структуры белка;
Парвис и соавторы установили, что домены сложных олигомерных белков кодируются различными экзонами. Установлено, что в структуре гена ДНК участки, отвечающие за продолжительность паузы в процессе синтеза белка, обеспечивают правильную сборку мультиферментных олигомерных белков.
1.5.3 Свойства доменов
В результате многочисленных исследований установлено, что домены обладают следующими свойствами:
1) нет четкой корреляции между доменной организацией и размером белка. Например, фермент карбоксипептидаза состоит из 307 аминокислот, одного домена и одного активного центра, фермент лизоцим - из 164 аминокислот и двух доменов;
2) структурная автономия домена часто дополняется и функциональной автономией. Например, нуклеотид - связывающий домен дегидрогеназ, ответствен за взаимодействие с одним из субстратов реакции - коферментом NAD или NADH. Аминоконцевые домены (кринглы) ферментов системы свертывания крови обеспечивают связывание с липидами мембран и другими белками. Аминоконцевые домены иммуноглобулинов формируют центр связывания антигена;
3) неполная функциональная автономия: доказано для белка папаина, активный центр располагается во впадине, причем образующие его функциональные группы расположены в разных доменах, активный центр способен катализировать реакции только одного порядка;
4) доменная структура молекулы белка соответствует ранним этапам эволюции пространственной структуры белка от простейших форм жизни до сложных. Установлено, что у вируса ВИЧ - инфекции фермент протеиназа состоит из 99 аминокислот, двух доменов. По структуре данный фермент похож на фермент пепсин;
5) границы доменов соответствуют границам экзонов в молекуле ДНК;
6) домены могут независимо от других частей белковой молекулы поддерживать и формировать пространственную структуру белка;
7) установлены междоменные взаимодействия при сворачивании олигомеров;
8) установлен пространственный обмен доменами в некоторых олигомерных белках и у них процесс формирования третичной структуры идет через стадию обмена доменами.
1.5.4 Мультидоменная организация молекулы фермента
Белки построены по модульному принципу, где модулем являются домены. Белок - фермент представляет собой набор различных доменов, отвечающих за выполнение определенных функций. Например, связывание с мембраной (концевые домены ферментов свертывания крови), либо связывание с субстратом, либо регуляторный домен, который отвечает за активность и неактивность ферментов.
В зависимости от строения домена фермент приобретает следующие свойства:
1) абсолютную специфичность;
2) относительную специфичность. Это будет в том случае, если:
- активный центр формируется на границе доменов;
- активный центр образуется после смыкания доменов.
- активный центр сформирован в одном домене.
Контрольные вопросы по изучаемой теме
1. Дайте определение доменов.
2. Какие существуют доказательства доменной стадии сворачивания белка?
3. Какие вы знаете свойства доменов?
4. В чем состоит мультидоменная организация молекулы белка - фермента?
5. Какие свойства приобретает фермент благодаря одинаковым доменам в его структуре?
6. Какие свойства приобретает фермент если активный центр расположен на стыке доменов?
1.6 Характеристика фермент - субстратного комплекса
Преобразование субстрата происходит внутри соединения - фермент- субстратного комплекса (Е-S). Для понимания того, как работает фермент, необходимо знать структуру фермента, фермент - субстратного комплекса, а также промежуточных соединений и продукта реакции. Время существования фермент - субстратного комплекса ограничено. Для изучения структуры фермент - субстратного комплекса проводят рентгено - структурный анализ комплексов фермент и продукт, фермент и ингибитор и с аналогами субстрата.
1.6.1 Механизм образования фермент - субстратных комплексов в растворителе
При формировании фермент - субстратного комплекса происходит образование новых межмолекулярных связей между ферментом и субстратом. Образуются водородные, ковалентная дисульфидная, гидрофобная и электростатическая связи.
Ковалентная образуется между R-группами цистеина и соответствующими остатками субстрата.
Водородная связь возникает между двумя остатками водорода, расположенными рядом с атомами кислорода. Образование таких связей происходит между субстратом и активным центром фермента лизоцима при гидролизе полисахаридов. Было установлено, что в этом случае АН водородной связи составляет от 4 до 8 ккал/моль.
Гидрофобные связи возникают между неполярными углеводородными фрагментами субстрата и гидрофобными (хотя бы частично) участками активного центра фермента. При этом происходит как бы экстракция R- групп фермента в органический растворитель. Например, при этом активный центр белка - фермента, содержащий участок, контактирующий с водой за счет боковых гидрофобных групп теряет связь с водой, что является энергетически более выгодным. Это способствует
ускорению реакции в 105раз. Данный тип взаимодействия встречается достаточно часто.
Электростатические взаимодействия возникают между заряженными группами субстрата и аминокислотными остатками активного центра фермента. Выигрыш в энергии составляет от 6 до 9 ккал/моль, реакция ускоряется в 104раз. Например, при катализе белков сериновыми протеазами.
При формировании фермент - субстратного комплекса также происходит образование хелатных комплексов. Таким образом, что фермент и субстрат связаны между собой двумя и более числом точек взаимодействия, такие комплексы называются хелатными.
При формировании фермент - субстратного комплекса также происходят конформационные изменения в молекуле фермента. Фермент может «настраиваться» определенным образом в пространстве, поскольку R- группы аминокислотных остатков активного центра в поверхностном слое белковой глобулы зафиксированы не слишком жестко и обладают определенной подвижностью. В результате обеспечивается возможность пространственной настройки сорбционных участков глобулы фермента на соответствующие участки сорбции молекулы субстрата.
Фермент способен принять конформацию, отличную от равновесной, в которой он находится до момента образования комплекса. За счет конформационных изменений уменьшаются энтропийные потери.
На формирование фермент - субстратного комплекса оказывает большой эффект микровязкость среды активного центра фермента. Это дает почти полную потерю подвижности молекул субстрата, т. е. теряется способность к поступательной, вращательной подвижности и к диффузии.
Вывод: таким образом, термодинамически невыгодный процесс формировании фермент - субстратного комплекса в растворителе компенсируется многоточечностью взаимодействия, конформационной подвижностью R- групп активного центра, микровязкостью среды активного центра и образованием различных видов связей между ферментом и субстратом.
1.6.2 Оценка свободной энергии сорбции комплекса фермент - лиганд
Процесс образования комплекса фермент - лиганд с точки зрения термодинамики рассмотрим, как последовательный, состоящий из двух этапов:
1) процесс сближения и ориентации лиганда (субстрата) напротив центра сорбции фермента, который сопровождается затратами энергии (∆G сближения), что является термодинамически невыгодным процессом;
2) образование хелатного комплекса фермент - лиганд в растворителе за счет образования межмолекулярных связей. Энергозатраты на образование комплекса
∆GE • L компенсируются образованием хелатного комплекса между ферментом и субстратом: чем больше точек взаимодействия, тем больше энергия ∆G связывания (термодинамически выгодный процесс):
![]() (1.2), 40
(1.2), 40
∆Gсближения - энергия, затраченная на сближение фермента и субстрата;
∆Gассоциаци - энергия ассоциации, которая снижает энергию активации субстрата в последующей ферментативной реакции преобразования субстрата в продукт.
1.6.3 Причины ускорения реакций ферментами
Каталитические свойства фермента обусловлены сложным механизмом их действия. С точки зрения современной энзимологии, ферментативный катализ обусловлен тремя причинами:
1) сорбция субстрата на ферменте протекает так, чтобы облегчить последующую реакцию превращения субстрата в продукт. Снижение энергии активации субстрата происходит за счет высвобождения энергии ∆GE • L ассоциации;
2) полифункциональный характер химических взаимодействий между ферментом и субстратом. В активном центре фермента могут быть и нуклеофильные и электрофильные группы, которые обеспечивают химический катализ субстрата, как кислотами, так и основаниями;
3) эффектами микросреды активного центра фермента.
Контрольные вопросы по изучаемой теме
1. Какие существуют механизмы образования комплексов в растворителе?
2. Какие межмолекулярные связи образуются между ферментом и субстратом в растворителе?
3. Дайте определение хелатного комплекса?
4. Проведите оценку свободной энергии - сорбции комплекса фермент - лиганд.
5. В чем причины ускорения реакции ферментами?
6. За счет чего происходит снижение энергии активации молекулы субстрата?
1.7 Комплементарность между ферментом и субстратом
1.7.1 Понятие комплементарности
В процессе образования фермент субстратного комплекса, когда каждая R - группа субстрата соединяется с соответствующими центрами связывания фермента, и энергия связывания принимает максимальное значение в этом случае говорят, что фермент и субстрат структурно комплементарны.
Структура субстрата изменяется в ходе химической ферментативной реакции, но недеформированная молекула фермента может быть комплементарна только одной форме субстрата. Ферменту каталитически выгодно быть комплементарным не исходному, а переходному состоянию субстрата, когда его внутренняя энергия принимает максимальное значение. В этом случае увеличение энергии связывания по мере приближения субстрата к структуре переходного состояния уменьшает энергию активации стадии химического превращения субстрата в продукт.
1.7.2 Катализ сериновыми протеазами
Протеазы, содержащие в своем активном центре АКО серин, относятся к группе сериновых протеаз: альфа-хемотрипсин, эластаза, субтилизин.
Ферменты протеазы расщепляют пептидную связь в белковых субстратах. Реакция гидролиза белка идет в присутствии растворителя - воды (рисунок 1.5).
Рисунок 1.5 - Схема гидролиза белка
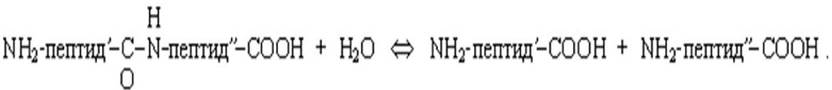
Весь механизм действия фермента сводится к процессу сорбции альфа- ациламидного фрагмента субстрата на карбоксильной группе активного центра фермента (рисунок 1.6).
Рисунок 1.6 - Фрагмент собированной молекулы субстрата
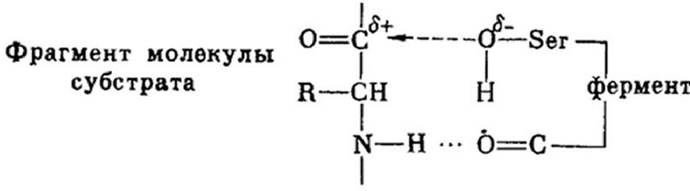
Образование водородных связей между карбоксильными группами фермента и альфа - ациламидным фрагментом молекулы субстрата приводит к образованию двух поляризованных нуклеофильных и электрофильных группировок серина. В результате сорбции образуется переходное состояние молекулы субстрата, что облегчает нуклеофильную атаку фермента, что приводит к ускорению реакции в активном центре фермента.
Образование водородной связи накладывает существенные энтропийные ограничения на молекулу субстрата. Это должно уменьшать суммарный вклад комплексообразования фермент - субстрат в ускорении реакции.
Стабилизация переходного состояния субстрата экспериментально была доказана во многих химических ферментативных реакциях (ХФР) с использованием олигомерных субстратов, которая доказала, что ферментативный процесс идет через промежуточное образование ацил-фермента, когда образуется связь между ОН- группой серина и С- пептидной связью субстрата.
Скорость ХФР закономерно возрастает с увеличением числа водородных связей, образуемых химически инертным фрагментом молекулы субстрата и субстрат связывающей площадки фермента.
В ферментативном катализе роль движущей силы играет свободная энергия сорбции субстрата на ферменте. Термодинамическая предпосылка сближению и
ориентации состоит в том, что замораживание молекулы субстрата идет за счет свободной энергии сорбции.
В варианте с сериновыми протеазами это водородные связи, которые повышают энтропию, что приведет к снижению Ag и процесс идет самопроизвольно.
1.7.3 Модели взаимодействия фермента и субстрата в катализе
В настоящее время существуют три теории образования комплекса фермент - субстрат в ходе ХФР, это:
- механизм «ключ-замок»;
- теория индуцированного соответствия;
- теория напряжения.
1.7.3.1. Механизм «ключ-замок».
В 1894 году Эмиль Фишер для объяснения механизма ХФР предложил модель «ключ-замок». Фермент соединяется с субстратом с образованием короткоживущего фермент-субстратного комплекса. При этом активный центр фермента организован так, что субстрат входит в него как ключ в замок. В ходе образования фермент - субстратного комплекса не изменяется структура ни субстрата, ни активного центра фермента. В этом случае фермент абсолютно специфичен в отношении субстрата.
Недостатки: для многих ферментов «ключ плохо подходит к замку», в этом случае необходимо применить дополнительную силу, чтобы повернуть «ключ».
1.7.3.2. Теория индуцированного соответствия выдвинута Кошландом.
В отсутствие субстрата каталитически активные группы фермента X и X' расположены так, что не могут одновременно взаимодействовать с субстратным фрагментом Y(рисунок 1.7 а).
Рисунок 1.7 - Схематическое изображение конформационных изменений в ферменте, индуцированных субстратом
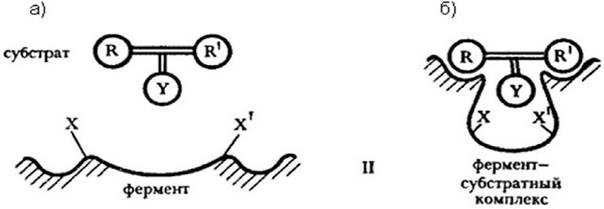
В результате сближения и ориентации происходит конформация активного центра фермента с образованием фермент - субстратного комплекса (рисунок 1.7 б). На образование комплекса тратится часть свободной энергии сорбции, направленной на изменение конформации активного центра фермента.
Например, фермент гексокиназа, а субстрат (S) - АТФ. Гексокиназа переносит фосфатные группы с АТФ на глюкозу. Фосфатная группа может быть перенесена и на воду.
Кошланд выдвинул три постулата механизма индуцированного соответствия:
1) до связывания с субстратом фермент находится в открытой форме. Он может захватить субстрат из воды, но не проводит фосфорилирование;
2) после связывания с субстратом домены поворачиваются, щель закрывается, вода вытесняется, а все компоненты химической ферментативной реакции сходятся вместе. Фермент переходит в закрытую каталитически активную форму, вода вытесняется и поэтому не конкурирует с субстратом за остаток фосфорной кислоты;
3) после каталитического акта фермент открывается, а продукт уходит.
Таким образом, индуцированное соответствие достигается смещением либо крупных блоков, либо целых белковых доменов, а не простой перестройкой боковых групп активного центра. По аналогии мышечного сокращения, в пальцы(домены) сжимаются в кулак.
1.7.3.4 Теория напряжения.
Авторы теории напряжений Ламри и Эйринг и Дженкс. Активный центр устроен так, что в результате деформированная молекула субстрата активируется, т. е. приобретает некоторые свойства важные для образования переходного состояния реакции. Образуется переходное состояние субстрата.
В молекуле субстрата происходит сжатие или растяжение связей, изменяется угол между связями. Такая «напряженная» структура субстрата позволяет снизить энергию активации, необходимую для преобразования молекула субстрата.
Контрольные вопросы по изучаемой теме
1. Дайте определения комплементарности между ферментом и субстратом.
2 Какие ферменты относятся ксериновым протеазам?
3 Структурные и термодинамические предпосылки механизма сближения и ориентации в ферментативном катализе.
4 Какие существуют модели взаимодействия фермента и субстрата в катализе?
5. Что лежит в основе теории «напряжения»?
6. Кто является автором теории «ключ - замок». В чем суть теории?
7. Какие механизмы лежат в катализе сериновыми протеазами?
8. Какие постулаты выдвинул Кошланд механизма индуцированного соответствия?
9. Как меняется конформация фермента в результате сближения и ориентации?
1.8 Полифункциональный характер механизма ферментативного катализа. Сущность кислотно- основного катализа
Реакция, катализируемая ферментами, является не только физической, но и химической. В активном центре фермента сосредоточены R- группы, которые могут быть электрофильными, нуклеофильными, либо обе одновременно. Данные группы в ферментативной реакции могут выступать:
- в качестве кислот;
- в качестве оснований.
Благодаря такому строению активного центра фермента в фермент - субстратном комплексе возможна химическая атака сорбированной молекулы субстрата по двум основным химическим механизмам:
1) общекислотному;
2) общеосновному.
1.8.1 Механизм общекислотного электрофильного катализа
Активный центр фермента выступает в качестве донора протона водорода и действует как кислота. Рассмотрим на примере реакции дегидратации амидной группы в субстратах белковой природы (рисунок 1.8).
Рисунок 1.8 - Реакция дегидратации амидной группы в субстратах белковой природы
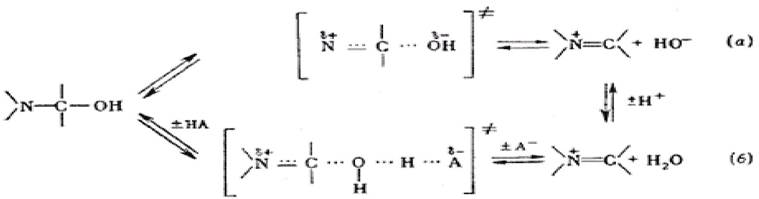
При некаталитическом пути образуется термодинамически неустойчивый продукт. При каталитическом пути участвует активный центр фермента, в котором
имеется свободный протон водорода - H+. Электрофильный АЦ выступает донором протонов водорода. В прямой реакции происходит отщепление от активного центра фермента протона водорода, который соединяется с гидроксильным радикалом ОН с образованием молекулы воды. В обратной реакции нуклеофильный радикал активного центра фермента восстанавливается сопряженным основанием активного центра R2: ОН группа и протон водорода возвращается на свое место в активный центр R1 и фермент восстанавливает свои электрофильные свойства.
1.8.2 Механизм общеосновного нуклеофильного катализа
Примером общеосновного катализа может служить реакция гидролиза - присоединение воды к субстрату ацилимидозолу.
Активный центр фермента выступает акцептором электронов. Реакция может пойти каталитически и некаталитически.
При некаталитическом неферментативном пути образуется кинетически нестабильное соединение ион гидроксония.
Каталитический путь: в активном центре фермента ОН группа может присоединять положительный протон водорода. В прямом направлении активный центр фермента отрывает протон водорода и присоединяет его к себе (действует как основание).
В обратной реакции активный центр восстанавливается сопряженной кислотой другой R-группы фермента и вновь приобретают отрицательные нуклеофильные свойства.
Эффект ускорения химической ферментативной реакции по общеосновному или общекислотному механизму происходит за счет внутримолекулярных связей, снижение энтропийных потерь обеспечивается образованием хелатных комплексов, свойствами среды активного центра, механизмом сближения и ориентации.
1.8.3 Эффективность полифункционального катализа
Скорость химической ферментативной реакции увеличивается в сотни тысяч раз, если катализ носит полифункциональный характер. Этому способствуют три фактора:
1) в активном центре одновременно могут находиться положительная и отрицательная R - группы;
2) в активном центре R - группы в исходном состоянии реакции сближены и сориентированы в большей степени, чем в большинстве неферментативных реакциях;
3) дегидрированная гидрофобная среда активного центра фермента способствует усилению взаимодействия электрофильных и нуклеофильных центров фермента. Поэтому для всех ферментов возможно только 2 механизма образования фермент - субстратного комплекса или 2 механизма полифункционального катализа (рисунок 1.10 а, б):
Рисунок 1.10 - Два механизма полифункционального катализа

Контрольные вопросы по изучаемой теме
1. В чем состоит механизм общекислотного электрофильного катализа.
2. В чем состоит механизм общеосновного и нуклеофильного катализа.
3. Какие существуют механизмы полифункционального катализа?
1.9 Механизмы регуляция работы ферментов
1.9.1 Виды механизмов регуляции. Определение метаболизма. Понятие конститутивных и адаптивных ферментов
Метаболизм представляет собой совокупность всех обменных процессов в организме. Выделяют два основных направления метаболизма в живых системах:
- анаболизм - синтез веществ, требующий затрат энергии;
- катаболизм или энергетический обмен - распад веществ с выделением энергии, в результате которого клетка обеспечивается макроэргами.
Эти процессы в живых системах идут параллельно и одновременно, регуляция метаболизма на всех уровнях организации от клетки до целого организма осуществляется белками ферментами.
В зависимости от регуляции направления метаболизма все ферменты можно разделить на 3 большие группы:
1) анаболические (регулируют процесс синтеза веществ);
2) катаболические (катализируют реакции энергетического обмена);
3) амфоболические (регулируют оба процесса).
Вывод: таким образом, регуляция метаболизма в организме сводится к регуляции деятельности ферментов.
Выделяют два основных механизма регуляции активности ферментов:
1) экстенсивный (медленный), осуществляется за счет регуляции скорости синтеза ферментов и идет медленно, т. к. для синтеза необходимы часы;
2) интенсивный (быстрый) - регуляция активности уже готовых ферментов, присутствующих в клетке.
Первый экстенсивный механизм. Скорость реакции в клетке определяется количеством фермента: чем выше концентрация фермента, тем выше скорость реакции. Увеличение скорости синтеза фермента и регулирует скорость реакции. Уменьшение скорости реакции происходит за счет гидролиза фермента - уменьшения его количества в клетке.
Скорость синтеза белков - ферментов зависит от условий в клетке. Существуют белки - ферменты, которые всегда присутствуют в клетке в определенном количестве - конститутивные белки-ферменты.
Другие проявляются при определенных условиях в ответ на проявление определенного субстрата - адаптивные белки-ферменты.
1.9.2 Классификация механизмов регуляции активности ферментов по интенсивному пути
Второй, более быстрый интенсивный путь активации, направленный на регуляцию активности уже готовых ферментов, представлен следующими механизмами:
1) с ковалентной модификацией:
- необратимая ковалентная модификация - ограниченный протеолиз;
обратимая ковалентная модификация - регуляция ковалентным связыванием - прямое воздействие на активный центр фермента с помощью ингибитора или активатора;
2) без ковалентной модификации - без прямого воздействия на активный центр фермента:
- конформационный (аллостерический) механизм:
- диссоциативный механизм (олигомеризация фермента);
- адсорбционный механизм (за счет связывания ферментов с мембранными структурами клетки).
1.9.3 Понятие активаторов и ингибиторов
На скорость химической реакции влияют различные вещества: активаторы и ингибиторы. Они носят общее название - эффекторы.
Активаторы ферментов - это вещества, увеличивающие скорость ферментативной реакции. Чаще всего в качестве активаторов выступают ионы металлов, такие, как железо, медь, кобальт, магний и др. Следует различать металлы, находящиеся в составе металлоферментов, так называемые кофакторы, и выступающие в качестве активаторов ферментов. Кофакторы могут прочно связываться с белковой частью фермента, что же касается активаторов, то они легко отделяются от апофермента. Кофакторы являются обязательными участниками каталитического акта; в их отсутствие фермент неактивен. Активаторы усиливают каталитическое действие, но их отсутствие не препятствует протеканию ферментативной реакции. Как правило, металл - кофактор взаимодействует с отрицательно заряженными группировками субстрата. Металл с переменной валентностью принимает участие в обмене электронов между субстратом и ферментом.
Металлы - активаторы принимают участие в образовании стабильной переходной конформации фермента, что способствует более быстрому образованию фермент-субстратного комплекса. Например, ионы магния стабилизируют ферменты нуклеинового обмена, а ионы кальция — альфа-амилазу.
Скорость ферментативных реакций может быть частично снижена или полностью заблокирована определенными веществами, так называемыми ингибиторами ферментов. Некоторые ингибиторы ферментов являются для организма животных и человека эффективными лекарственными веществами, другие - смертельными ядами.
По характеру действия ингибиторы разделяют на необратимые и обратимые.
При необратимом ингибировании - фермент полностью теряет свою активность.
Обратимые ингибиторы взаимодействуют с ферментом без образования ковалентной связи. После инкубации с обратимым ингибитором активность фермента восстанавливается при удалении свободного ингибитора путем диализа.
Характерная для соответствующей системы степень ингибирования достигается в общем случае относительно быстро и далее не зависит от времени, что указывает на наличие равновесия при образовании комплекса ингибитора (I) с ферментом (Е): Е + I —> Е I.
Различают три типа обратимого ингибирования ферментов: конкурентное, неконкурентное и бесконкурентное.
Конкурентным называют ингибитор, обратимо взаимодействующий с активным центром фермента. Как правило, конкурентные ингибиторы по строению обычно сходны с субстратом; они конкурируют с ним за связывание с ферментом и могут вытесняться из фермент-ингибиторного комплекса избытком субстрата. Характерная черта конкурентного ингибирования состоит в том, что эффективность ингибирования зависит от соотношения концентраций субстрата и ингибитора (а не от абсолютной концентрации ингибитора). Взаимодействие с конкурентным ингибитором не приводит к денатурации или инактивации фермента, поэтому при замене ингибитора на субстрат скорость ферментативной реакции не снижается.
При взаимодействии фермента с конкурентным ингибитором изменяется значение Км соответствующей ферментативной реакции.
Сходство субстрата и конкурентного ингибитора достаточно для взаимодействия и образования фермент-ингибиторного комплекса, но недостаточно для ферментативной реакции.
Многие лекарственные вещества ингибируют ферменты человека и животных по конкурентному типу.
Неконкурентные ингибиторы взаимодействуют с ферментами не в области активного центра, а на каком-то от него удалении, причем никаким избытком субстрата из комплекса не удаляются, и, как правило, не имеют сходства с субстратом. Эффективность неконкурентного ингибирования определяется концентрацией ингибитора и не зависит от соотношения концентраций ингибитора и субстрата. При взаимодействии ингибитора с ферментом происходит изменение его конформации с последующей частичной дезинтеграцией активного центра. При взаимодействии фермента с неконкурентным ингибитором изменяется Vmax ферментативной реакции. Они могут обратимо связываться как со свободным ферментом, так и с ES-комплексом и не конкурируют с субстратом, т. е. не вытесняют его из комплекса с ферментом.
Бесконкурентное ингибирование имеет место, когда ингибитор взаимодействует с ферментом только в составе фермент - субстратного комплекса, препятствуя его распаду.
Активность многих ферментов тормозится избытком субстрата, причем имеется несколько механизмов этого процесса.
Если в образовании фермент - субстратного комплекса участвует несколько функциональных групп фермента, то возможно одновременное присоединение к активному центру двух или более субстратов, что однозначно приведет к образованию неактивного комплекса.
В случае избытка субстрата возможно его присоединение не только к активному центру, но и к другим химическим группировкам, функционально связанным с активным центром. Такого рода взаимодействие может помешать ферментативной реакции.
1.9.4 Необратимая ковалентная модификация, ограниченный протеолиз
Относится к интенсивному механизму регуляции. В организме человека и млекопитающих регулирует активность ферментов свертывания крови - регуляция ограниченным протеолизом. Осуществляется механизм в 3 этапа:
E + S ⇄ ES* ⇄ E + R, (1.3)
S - субстрат, ES фермент - субстратный комплекс; R - продукт реакции.
Если реакция идет в прямом направлении с образованием R, то тогда продукт реакции R соединяется с ингибитором протеолитического фермента. В живом организме так осуществляется регуляция активности внутриклеточных протеолитических фермент - ферментов Асат или Алат.
R + Ингибитор*Алат ⇄ R*Ингибитор*Алат, (1.4)
где Ингибитор*Алат - неактивная форма фермента; К*Ингибитор*Алат - тройной комплекс.
В ходе второй стадии механизма образуется тройной комплекс R*Ингибитор*Acam: продукт, ингибитор, протеолитический фермент. Комплекс является активным в отношении фермента Е - (например, Асат) и вызывает его распад - протеолиз до неактивных фрагментов E1 и Е2. Причем, протеолитический фермент (Асат) наиболее чувствителен действию тройного комплекса:
3) Е + R*Ингибитор* Протеолитический фермент (Асат) —> E1 + Е2 + R + Ингибитор* Протеолитический фермент (Асат), (1.5)
где комплекс Ингибитор*Протеолитический фермент Асат - неактивная форма фермента, E1 и Е2 - неактивные фрагменты фермента Асат после протеолиза.
Если уменьшается концентрация продукта, то прекращает образовываться тройной комплекс. Следовательно, протеолитический фермент (Асат) прекращает разрушаться, фермент становится активным и вновь идет прямая ХФР (1 стадия).
1.9.5 Обратимая ковалентная модификация, регуляция ковалентным связыванием
Модификация активности фермента может заключаться в его ингибировании за счет образования ковалентных связей между ферментом и другим низкомолекулярным веществом, происходящим в клетке по принципу обратимого конкурентного ингибирования. У эукариот самым распространенным механизмом регуляции являются реакции фосфорилирования ферментов.
Пример: синтез и распад гликогена в клетках печени и в мышцах.
Гликоген —> глюкоза-1 -фосфат ⇄ глюкоза
Процесс синтеза и распада регулируется ферментами: гликогенфосфорилаза (А и В) - катализирует реакцию распада гликогена до глюкозы и гликогенсинтетаза (А и В) - катализирует реакцию синтеза гликогена.
Для гликогенфосфорилазы (ГФ), веществом регулятором выступает цАМФ. Поэтому ГФА - это активная форма фермента, образованная присоединением с помощью ковалентной связи циклического АМФ. ГФВ - неактивная форма гликогенфосфорилазы.
Если в клетке есть циклический АМФ, ГФА активируется за счет реакции фосфорилирования и присоединения фосфатной группы - начинается реакция распада гликогена до глюкоза-1-фосфат и глюкозы. Если цАМФ мало, то ГФ не фосфорилируется и фермент становится не активным - реакция распада гликогена до глюкозы приостанавливается.
Для гликогенсинтетазы таким веществом - регулятором является глюкоза-6- фосфат.
Принцип ковалентного связывания: к участку фермента присоединяется молекула низкомолекулярного вещества с образованием ковалентной связи. При этом фермент снижает свою активность.
В живых системах ковалентная модификация также представлена реакциями аденилирования, уридилирования. При этом нуклеотиды связываются с ферментами
ковалентными связями и регулируют скорость азотистого обмена. Активность фермента будет зависеть от количества азота в клетке.
1.9.6 Механизмы регуляции активности ферментов в безковалентной модификации
1.9.6.1 Аллостерический механизм: происходит за счет конформационных изменений фермента.
Аллостерический механизм - это механизм, при котором контроль активности ферментов реализуется путем изменения его конформации.
Изменение конформации происходит за счет присоединения метаболита - регулятора к аллостерическому центру фермента, пространственно удаленному от активного центра.
Изменение конформации фермента ведет к изменению его каталитической активности за счет изменения структуры активного центра: либо он активируется, либо он ингибируется.
Метаболит - регулятор, модифицирующий активность активного центра, называющийся аллостерическим регулятором.
Олигомерная молекула фермента, состоящая из нескольких субъединиц может содержать несколько активных и аллостерических центров, каждый из которых, чувствителен к определенным эффекторам. В таком олигомере возможно два варианта взаимодействия между центрами:
1. Ал.Ц —> AЦ1 и АЦ2
2. АлЦ1 —> АЦ1; АлЦ2 —> АЦ2.
Первый тип взаимодействия между активным центром фермента и субстратом называется кооперетивным. Кривая зависимости скорости химической реакции от концентрации субстрата для аллостерических ферментов, регулируемых по кооперативному механизму приобретает сигмоидальную форму.
вида:
1) согласованный аллостерический механизм (разработали Шанже, Моно, Уайман);
2) последовательный аллостерический механизм (разработал Кошланд).
1.9.6.2 Согласованный аллостерический механизм.
Фермент существует в двух формах. Если фермент состоит из двух R субъединиц - R - форма, если из Т субъединиц - Т - форма. Фермент может существовать в двух формах: RR и ТТ.
Рисунок 1.11 - R и Т формы фермента
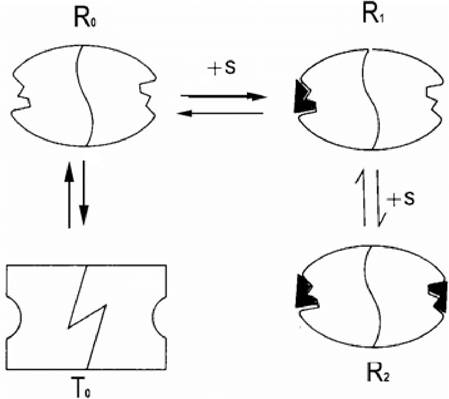
Присоединение субстрата ведет к изменению конформации одной субъединицы. При присоединении еще одной молекулы субстрата изменяется конформация другой субъединицы - т. е. согласованный механизм.
1.9.6.3 Последовательный аллостерический механизм.
Связывание субстрата изменяет конформацию той субъединицы, к которой присоединяется субстрат, переводя ее из неактивной в активную форму. Конформация другой субъединицы при этом не меняется.
Конформационные изменения, вызванные субстратом на одной субъединице могут повысить, либо понизить сродство к субстрату другой субъединицы.
Аллостерическое взаимодействие между ферментом и лигандом может быть двух видов:
1) гомотропное (взаимодействие субъединиц фермента с идентичными лигандами);
2) гетеротропное (взаимодействие субъединиц фермента с различными лигандами).
При согласованном механизме аллостерических взаимодействий гомотропные эффекты всегда положительны и кооперативны, а гетеротропные могут быть и положительными, и отрицательными.
Контрольные вопросы по изучаемой теме
1. Какие существуют виды механизмов регуляции активности ферментов?
2. Дайте определение метаболизма.
3. Какие существуют основные направления метаболизма?
4. Дайте понятие конститутивных и адаптивных ферментов.
5. Дайте классификация механизмов регуляции активности ферментов по интенсивному пути.
6. Опишите механизмы регуляции активности ферментов по экстенсивному пути.
7. Дайте понятие эффекторов, активаторов и ингибиторов.
8. В чем состоит механизм необратимой ковалентной модификации.
9. Какие существуют стадии в ограниченном протеолизе?
10. Какие механизмы относятся к регуляции ковалентным связыванием?
1.10 Ассоциативный механизм регуляции активности ферментов
К олигомерам относят ферменты, состоящие из двух или нескольких субъединиц. Эти ферменты представляют собой переход в новую мультимерную
структуру, которая называется четвертичная структура белка - фермента. Если олигомер состоит из одинаковых субъединиц - гомогенный олигомер, из разных - гетерогенный. Отдельные субъединицы - протомеры.
Мультимерная структура, содержащая три и более субъединицы, называется химерой. При образовании четвертичной структуры меняется молекулярная масса белка - фермента, и главное - его функциональные свойства. В живом организме один и тот же фермент может быть представлен в разных формах.
Каждая из форм будет обладать разной ферментативной активностью. В одних условиях фермент больше склонен к образованию ассоциатов (тетрамеров, димеров и т. д.). В других условиях существует в форме мономеров. Для каждого фермента активность мономерных и олигомерных форм разная. Для одних ферментов активны тетрамеры, а для других димеры.
В том случае, если активна ассоциативная форма фермента, то значит активный центр фермента образовался на месте контакта субъединиц. Если активный центр расположен в одной субъединице, то активна только его мономерная форма.
1.10.1 Механизмы ассоциаций ферментов
Различаю два типа ассоциаций олигомерных ферментов:
1) ассоциации с образованием замкнутых олигомерных структур;
2) линейная ассоциация протомеров неограниченной длины.
1. Ассоциации с образованием замкнутых олигомерных структур: образуется при взаимодействии двух и более идентичных центров ассоциаций, расположенных на разных субъединицах. Димер имеет замкнутую форму, поэтому центры ассоциации закрыты. Такой механизм образования ассоциаций называется изологическим. Примером образования является фермент: гликоген фосфорилаза В. При этом димер - активная форма, тетрамер - неактивная. Происходит экранирование AЦ фермента. Расположенного в центре замкнутой ассоциации от субстрата.
2. Линейная ассоциация протомеров неограниченной длины: образуется при взаимодействии двух и более различных центров ассоциации. Примером может служить фермент лизоцим: М <=> М2 <=> М3 <=> М4... Активной является только одна форма фермента, которая имеет определенную молекулярную массу.
С практической точки зрения определить присутствие в клетке различных форм олигомерных ферментов возможно с помощью констант ассоциации.
1.10.2 Зависимость активности фермента от его олигомерной ассоциации
Характер распределения ферментативной активности между различными формами ассоциаций ферментов показывает, что удельная активность ассоциативных ферментов зависит от концентрации ферментов.
Зависимость может быть:
1) линейной
2) нелинейной.
Нелинейная зависимость:
1. Прямо пропорциональная. Чем выше концентрация, тем выше удельная скорость реакции. Характерен для ферментов, у которых АЦ образуется в месте контакта субъединиц, т. е. активной формой является ассоциативная форма.
Например, фермент НАДзависимая изоцитратдегидрогеназа.
2. Обратно пропорциональная. Чем выше концентрация фермента, тем ниже удельная активность фермента, тем ниже скорость реакции. При образовании ассоциативной формы, АЦ становиться недоступным для субстрата, т. е. олигомерная форма будет неактивна.
Нелинейная зависимость. Для некоторых ферментов активными являются только определенные ассоциативные формы фермента оптимального размера.
Например, фермент фосфофруктокиназа существует в виде мономера, димера, тетрамера и т. д.: М <=> М2 <=> М4 и т. д. При этом М2-единственно активная форма. Олигомеризация этого фермента идет по пути образования ассоциаций неограниченной длины. Химер неактивный.
1.10.3 Регуляция активности олигомерных ферментов специфическими лигандами
Состояние равновесия между различными формами олигомерных ферментов может регулироваться специальными лигандами - это субстрат или аллостерический эффектор (активатор или ингибитор):
1) осуществляется за счет специфических аллостерических лигандов, которые выступают в качестве либо активатора, либо ингибитора и ковалентно связываются с аллостерическим центром фермента. Это приводит к конформационным изменениям структуры субъединицы, следовательно, к изменениям структуры центров ассоциаций, которые отвечают за белок - белковые взаимодействия.
Например, для глюкуронилтрансферазы В димер неактивен, а тетрамер активен;
2) центры связывания олигомерного фермента совпадают с активным центром фермента, и тогда, при образовании олигомерной формы, активный центр будет закрыт от субстрата. В живом организме переход от одной формы к другой является обратимым.
Контрольные вопросы по изучаемой теме
1 Какие ферменты называются олигомерными?
2 Какие особенности структуры олигомерных ферментов?
3 В чем состоит механизм гетерологической ассоциации ферментов?
4 Какая существует зависимость активации фермента от его олигомерной ассоциации?
5 Как осуществляется регуляция активности олигомерных ферментов специфическими лигандами?
6 Какой механизм образования ассоциаций называется изологическим?
1.11 Адсорбционный механизм регуляции активности ферментов
1.11.1 Физиологическое значение адсорбции ферментов на субклеточных структурах
Ферменты могут обратимо связываться с такими субклеточными структурами, как мембранах клеток и органелл (митохондрий, лизосом, рибосом, включений, на цитоскелете, на миофибриллах).
Физиологическая роль такого связывания:
1) обратимая адсорбция фермента приводит к изменению его каталитических и регуляторных свойств, т. е. является фактором, регулирующим активность фермента;
2) адсорбция фермента на мембране обеспечивает компартментализацию метаболитов на мембране. Это состояние, в котором метаболический процесс протекает изолированно, без выхода интермедиантов (участников ХФР: фермента, субстрата, продукта реакции, эффектора и т. д.) в окружающий объем;
3) адсорбированные ферменты могут образовывать метаболоны мультиферментные структуры, которые регулируют крупные метаболические процессы;
4) ферменты могут адсорбироваться на порах мембран и участвовать в активном транспорте метаболитов через мембрану;
5) адсорбированные формы ферментов более стабильны, чем свободные формы ферментов. Таким образом, адсорбция может служить фактором, снижающим скорость распада ферментов в клетке.
1.11.2 Адсорбционный механизм ргуляции
Основные признаки существования адсорбционного механизма:
1) существование обратимого равновесия между свободной формой фермента и адсорбированным ферментом;
2) изменение каталитических характеристик фермента при адсорбции;
График зависимости скорости ферментативной реакции от концентрации субстрата представлен на рисунке 1.18.
Рисунок 1.18 -Зависимость скорости ферментативной реакции от концентрации субстрата: 1) свободная форма фермента; 2) адсорбированная форма фермента.
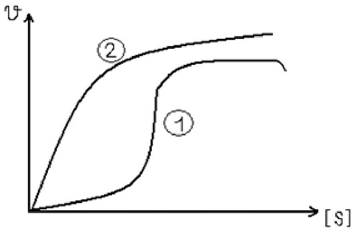
Чем больше содержание фермента во второй адсорбированной форме, тем больше будет нарастать скорость ХФР: (1) график имеет сигмоидальную форму, из чего следует наличие кооперативного эффекта по субстрату и низкой активности фермента. Из графика видно, что адсорбированная форма (2) является активной.
3) чувствительность подвижного равновесия между свободной и связанной формами фермента к присутствию клеточных метаболитов -регуляторов. Их называют еще эффекторами (ингибиторы и активаторы):
Рассмотрим адсорбционный механизм на примере 6-осфофруктокиназы. Фермент существует в двух формах: свободной и адсорбированной на мембране
эритроцитов человека. Между этими формами существует равновесие. Метаболитом - эффектором является АТФ, высокие концентрации которого являются ингибиторами. Активность фермента изменяется при адсорбции на мембране человека. Переход фермента в адсорбированное состояние сопровождается исчезновением кинетической кооперативности по субстрату - фруктозо — 6 - фосфату.
Для данного фермента присутствуют все три признака наличия адсорбционного механизма регуляции активности фермента, а именно:
1) переход свободной формы в связанную осуществляется на мембране эритроцита;
2) происходит исчезновение эффекта кооперативности по субстрату для связанной формы фермента, что подтверждает изменение его каталитических свойств;
3) в присутствии АТФ адсорбированная форма фермента становится менее чувствительной к ингибитору по сравнению со свободной формой, т.е. начинает проявлять свою активность.
Пример 2: фермент лактатдегидрогеназа (ЛДГ) может быть в двух формах: свободной и связанной. Субстратом является NADH, повышение концентрации которого, способствует переходу ЛДГ в свободную активную форму.
1.11.3 Эстафетная модель работы фермента
Адсорбционный механизм регуляции активности фермента обеспечивает компартментализацию метаболитов у поверхности субклеточных структур, на которых фермент адсорбируется.
Рассмотри эстафетную модель работы ферментов гидролиза при которой осуществляется данный механизм работы ферментов:
S0+ E1 —> E1S’ + Е2 ⇄ E1S’E2⇄ E1 + S»E2+ Е3 ⇄ E2S»E3, (1.6)
где S0 - начальная форма субстрата; E1 - первый фермент; Е2 - второй фермент; ЕЗ - третий фермент; E1S’- адсорбированная форма первого фермента с субстратом.
1) прямая передача интермедианта из активного центра одного фермента в активный центр другого;
2) обратимая адсорбция фермента на субклеточных структурах;
а) первый фермент E1 освобождается от интермедианта и адсорбируется на поверхности и переходит в неактивную форму;
б) второй фермент Е2 со своим продуктом высвобождается в объем, приобретая активные свойства.
Контрольные вопросы по изучаемой теме
1 Какое физиологическое значение имеет адсорбция ферментов на субклеточных структурах?
2 Что такое интермедианты?
3 Что такое компартментализация метаболитов?
4 В чем состоит адсорбционный механизм регуляции ферментативной активности?
5 Какие существуют признаки адсорбционного механизма регуляции активности ферментов?
6 Приведите примеры такой регуляции?
7 Что такое эстафетная модель работы ферментов?
8 Как осуществляется такой механизм?
9 Приведите примеры эстафетной модели