Основы биохимии - Филиппович Ю. Б. 1999
Ферменты
Свойства ферментов
Будучи белками, ферменты обладают всеми их свойствами. Вместе с тем биокатализаторы характеризуются рядом специфических качеств, тоже вытекающих из их белковой природы. Эти качества отличают ферменты от катализаторов обычного типа. Сюда относятся термолабильность ферментов, зависимость их действия от значения pH среды, специфичность и, наконец, подверженность влиянию активаторов и ингибиторов.
Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоких значениях к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрата, что ведет к усилению катализа.
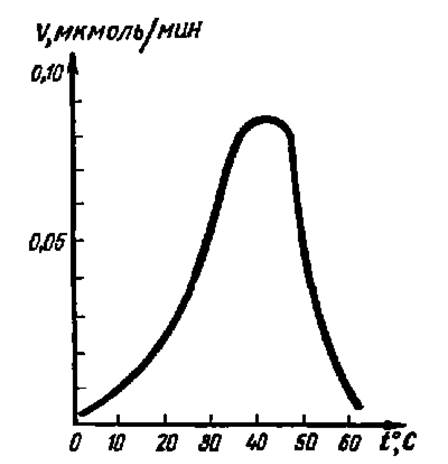
Рис. 49. Влияние температуры на активность фермента (пояснение в тексте)
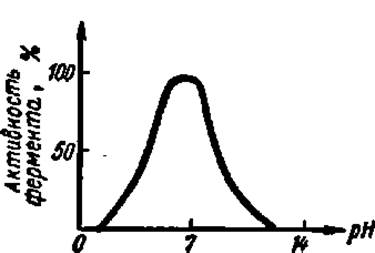
Рис. 50. Влияние pH среды на активность фермента
Зависимость каталитической активности фермента от температуры выражается типичной кривой (рис. 49). По характеру кривой видно, что до некоторого значения температуры (в среднем до 50° С) каталитическая активность растет, причем на каждые 10° С примерно в 2 раза повышается скорость преобразования субстрата. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше 50° С денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает.
Детальные исследования роста активности ферментов с повышением температуры, проведенные в последнее время, показали более сложный характер этой зависимости, чем указано выше: во многих случаях она не отвечает правилу удвоения активности на каждые 10° С в основном из-за постепенно нарастающих конформационных изменений в молекуле фермента.
Температура, при которой каталитическая активность фермента максимальна, называется его температурным оптимумом.
Температурный оптимум для различных ферментов неодинаков. В общем для ферментов животного происхождения он лежит между 40 и 50° С, а растительного — между 50 и 60° С. Однако есть ферменты с более высоким температурным оптимумом, например у папаина (фермент растительного происхождения, ускоряющий гидролиз белка) оптимум находится при 80° С. В то же время у каталазы (фермент, ускоряющий распад Н2О2 до Н2О и О2) оптимальная температура действия находится между 0 и 10° С, а при более высоких температурах происходит энергичное окисление фермента и его инактивация.
Зависимость активности фермента от значения pH среды была установлена свыше 50 лет назад. Для каждого фермента существует оптимальное значение pH среды, при котором он проявляет максимальную активность. Большинство ферментов имеет максимальную активность в зоне pH поблизости от нейтральной точки. В резко кислой или резко щелочной среде хорошо работают лишь некоторые ферменты (табл. 10).
Таблица 10 Оптимальные значения pH среды для некоторых ферментов
Фермент |
Характер катализируемой реакции |
pH |
Пепсин |
Гидролиз белка |
1,5-2,5 |
Липаза (из семян клещевины) |
Гидролиз жиров |
4,7-5,0 |
Уреаза |
» мочевины |
7,0 |
Трипсин |
» белка |
7,8 |
Аргиназа |
» аргинина |
9,5-9,9 |
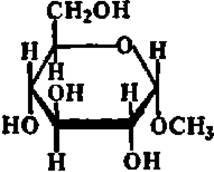
а-Метилглюкозид (гидролизуется по эфирной связи ферментом из солода)
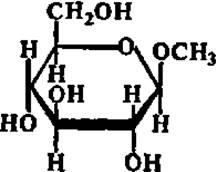
ß -Метил глюкозид (гидролизуется по эфирной связи ферментом из семян горького миндаля)
Переход к большей или меньшей (по сравнению с оптимальной) концентрации водородных ионов сопровождается более или менее равномерным падением активности фермента. На рис. 50 представлена кривая, выражающая типичную зависимость каталитического действия фермента от pH среды.
Влияние концентрации водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях pH в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т. п. Кроме того, pH среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и продуктов реакции, оказывает большое влияние на состояние фермента, определяя соотношение в нем катионных и анионных центров, что сказывается на третичной структуре белковой молекулы. Последнее обстоятельство заслуживает особого внимания, так как определенная третичная структура белка-фермента необходима для образования фермент-субстратного комплекса.
Специфичность — одно из наиболее выдающихся качеств ферментов. Это свойство их было открыто еще в прошлом столетии, когда было сделано наблюдение, что очень близкие по структуре вещества — пространственные изомеры (а- и ß-метилглюкозиды) расщепляются по эфирной связи двумя совершенно разными ферментами:
Таким образом, ферменты могут различать химические соединения, отличающиеся друг от друга очень незначительными деталями строения, такими, например, как пространственное расположение метоксильного радикала и атома водорода при 1-м углеродном атоме молекулы метилглюкозида.
По образному выражению, нередко употребляемому в биохимической литературе, фермент подходит к субстрату, как ключ к замку. Это знаменитое правило было сформулировано Э. Фишером в 1894 г. исходя из того, что специфичность действия фермента предопределяется строгим соответствием геометрической структуры субстрата и активного центра фермента.
В 50-е годы нашего столетия - это статическое представление было заменено гипотезой Д. Кошланда об индуцированном соответствии субстрата и фермента. Сущность ее сводится к тому, что пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом, что может быть выражено формулой «перчатка — рука». При этом в субстрате уже деформируются некоторые валентные связи и он, таким образом, подготавливается к дальнейшему каталитическому видоизменению, а в молекуле фермента происходят конформационные перестройки. Гипотеза Кошланда, основанная на допущении гибкости активного центра фермента, удовлетворительно объясняла активирование и ингибирование действия ферментов и регуляцию их активности при воздействии различных факторов. В частности, конформационные перестройки в ферменте в процессе изменения его активности Д. Кошланд сравнивал с колебаниями паутины, когда в нее попала добыча (субстрат), подчеркивая этим крайнюю лабильность структуры фермента в процессе каталитического акта.
В настоящее время гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия. Сохраняя основные положения гипотезы взаимоиндуцированной настройки субстрата и фермента, она фиксирует внимание на том, что специфичность действия ферментов объясняется в первую очередь узнаванием той части субстрата, которая не изменяется при катализе. Между этой частью субстрата и субстратным центром фермента возникают многочисленные точечные гидрофобные взаимодействия и водородные связи.
Несомненно, что специфичность ферментов объясняется в первую очередь совпадением пространственных конфигураций субстрата и субстратного центра фермента. Видимо, только тогда, когда совпадение - это достаточно полно, может образоваться фермент-субстратный комплекс и, следовательно, начаться процесс ферментативного катализа. Выяснение третичной структуры некоторых белков-ферментов полностью оправдало такую точку зрения. Так, в молекуле лизоцима (фермент, ускоряющий гидролиз гликозидных связей в полисахаридах клеточной стенки бактерий) обнаружена выемка (щель) (см. рис. 34) для присоединения субстрата. В эту выемку плотно входит участок молекулы субстрата протяженностью ровно в шесть звеньев:
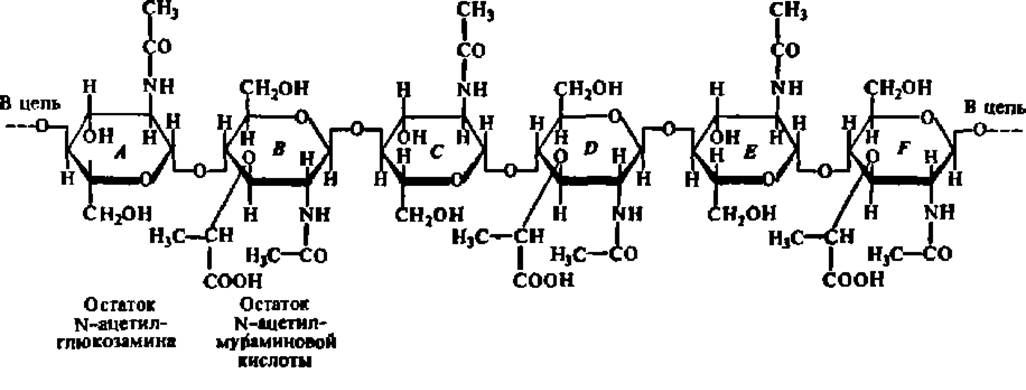
Остальная часть молекулы субстрата, состоящая из нескольких сотен остатков аминосахаров или их производных, остается свободной. Не только общая форма щели в молекуле лизоцима соответствует параметрам входящего в нее участка субстрата, но и расположение отдельных аминокислотных радикалов в субстратном центре этого фермента совершенно точно согласуется с размещением определенных атомов и атомных групп в молекуле субстрата. Именно за счет указанных радикалов и групп замыкаются водородные связи между лизоцимом и полисахаридом в процессе становления фермент-субстратного комплекса (табл. 11).
Таблица 11 Многоточечное взаимодействие фрагмента молекулы полисахарида клеточной стенки бактерии с лизоцимом
|
Буквенные обозначение полисахаридных звеньев |
Число связей и слабых взаимодействий |
Энергия ассоциации, кДж/моль |
|
водородных |
Ван-дер-Ваальса |
||
А |
1 1 |
7 |
7,5—9,6 |
В |
1 |
11 |
11,7—16,3 |
С |
4 |
30 |
19,6—23,8 |
D |
2 |
35 |
12,1—25,0 |
Е |
3 |
45 |
3,8—16,7 |
F |
4 |
13 |
6,3—21,0 |
Одновременно против радикалов каталитического центра (остатки глу и асп, занимающие в полипептидной цепи лизоцима 35-е и 52-е положения соответственно) устанавливается гликозидная связь, расположенная между кольцами D и Е субстрата, и наступает каталитический акт:
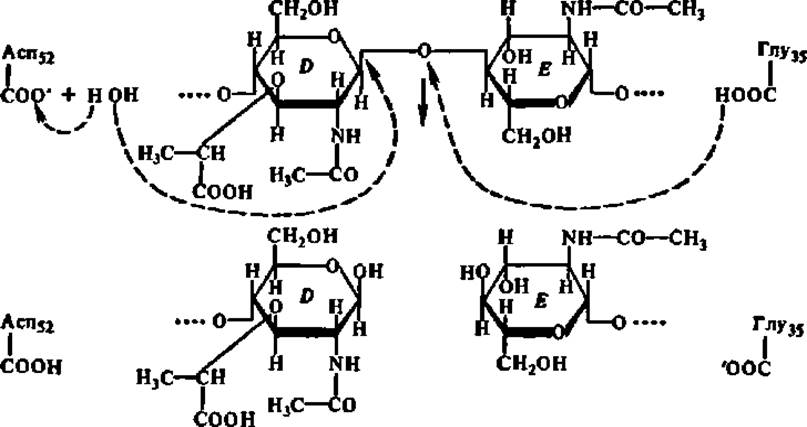
Приведенная схема еще раз иллюстрирует механизм ферментативного катализа.
Детальное изучение специфичности ферментов показало, что пределы ее у разных ферментов различны. Одни ферменты обладают абсолютной специфичностью, т. е. каталитически ускоряют одну-единственную реакцию. Примером такого фермента может служить уреаза. Другие ферменты осуществляют катализ реакций определенного типа независимо от того, какие конкретные вещества в них взаимодействуют или распадаются. Основным признаком для ферментов этого типа является характер разрушаемой или создаваемой связи. Такие ферменты характеризуются, следовательно, групповой специфичностью. Некоторые ферменты отличаются стереохимической специфичностью, т. е. действуют только на один из пространственных изомеров Примером могут служить уже упоминавшиеся выше ферменты, расщепляющие а- и ß-метилглюкозиды.
Влияние на ферменты активаторов и ингибиторов впервые было обнаружено при изучении активаторов (стимулин) и ингибиторов (антиферменты) А. Я. Данилевским с сотр. еще в прошлом столетии. К числу агентов, повышающих активность ферментов, относятся ионы многих металлов и некоторые анионы. Особенно часто активаторами ферментов бывают Mg2+, Мn2+, Zn2+, К+ и Со2+, а из анионов — Cl-. В одних случаях ионы металлов входят в состав простетической группы фермента, в других — облегчают образование фермент-субстратного комплекса, в третьих — способствуют присоединению кофермента к апоферменту, в четвертых — обеспечивают становление четвертичной структуры фермента или же действуют иными путями. Как выяснено в последнее время, мощное действие на ферменты оказывают аллостерические активаторы. Они присоединяются по аллостерическому центру фермента и изменяют третичную структуру белковой молекулы. В результате этого субстратный и каталитический центры фермента приобретают наиболее выгодную для осуществления своих функций конфигурацию (рис. 51, II).
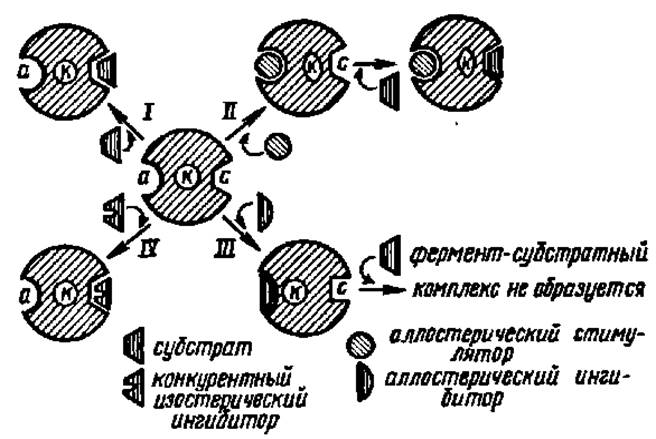
Рис. SI. Активирование и ингибирование действия фермента:
а — аллостерический центр фермента; к — каталитический центр фермента; с — субстратный центр фермента; I — взаимодействие фермента с субстратом; полного совпадения конфигураций субстратного центра фермента и субстрата нет, вследствие чего нет тесного контакта между ферментом н субстратом; активность фермента далека от максимума; II — в результате взаимодействия фермента с аллостерическим стимулятором каталитический центр сближается с субстратным, причт последний приобретает форму, полностью совпадающую с таковой субстрата; вследствие этого образуется полноценный фермент-субстратный комплекс; активность фермента максимальна; III — взаимодействие фермента с аллостерическим ингибитором сопровождается деформацией субстратного центра, к которому становится невозможным присоединение субстрата; фермент не проявляет активности; IV — к субстратному центру фермента присоединяется конкурентный ингибитор; активность фермента подавлена, так как образование фермент-субстратного комплекса невозможно
Ингибиторы тормозят действие ферментов. Механизм ингибирующего действия разнообразен, но в большинстве сводится к двум типам торможения: необратимому и обратимому. При необратимом торможении ингибитор, обладающий структурным сходством (изостерией) с субстратом, соединяется с ферментом, подменяя собой субстрат. Наиболее ярким примером такого типа торможения является угнетение действия холинэстеразы при помощи диизопропилфторфосфата, который структурно весьма близок к ацетилхолину и, являясь псевдосубстратом, легко присоединяется вместо него к ферменту:
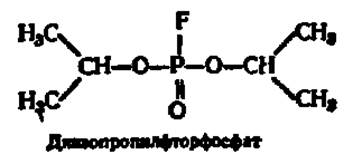
Диизопропилфторфосфат блокирует активный центр холинэстеразы, фосфорилируя радикал серина (см. рис. 47). Так как образовавшийся диизопропилфосфосерин гораздо прочнее ацетилсерина и распадается очень медленно, активный центр фермента надолго выводится из строя. Это и аналогичные ему соединения образуют большую группу так называемых нервных ядов, ибо, приостанавливая гидролиз ацетилхолина, они резко нарушают деятельность нервной системы. Среди них широко известны многочисленные инсектициды и боевые отравляющие вещества.
При необратимом ингибировании фермента ингибитор может не обладать структурным сходством с субстратом, т. е. может модифицировать фермент вне его активного центра, тем не менее резко изменяя каталитическую активность последнего вследствие нарушения конформации как фермента в целом, так и его активного центра. Это происходит, например, при алкилировании сульфгидрильных групп фермента:
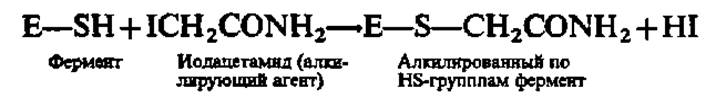
Недавно обнаружены необратимые инактиваторы ферментов, возникающие из инертных соединений после их взаимодействия с каталитическим центром фермента, например:
![]()
Присоединяясь к активному центру фермента, такой необратимый ингибитор, возникший в процессе ферментативного катализа, соединяется с активным центром фермента и полностью его блокирует. Поэтому эти ингибиторы образно называют ингибиторами типа «самоубийц».
Обратимое ингибирование действия ферментов может быть конкурентным и неконкурентным. Классическим примером конкурентного ингибирования ферментативной активности является торможение действия дегидрогеназы янтарной кислоты дикарбоновыми кислотами (малоновая, глутаровая), близкими по структуре к янтарной кислоте: между ними идет конкуренция за связывание в активном центре фермента.
При неконкурентном торможении ингибитор взаимодействует с апоферментом или простетической группой, вследствие чего фермент теряет активность. Одним из вариантов такого торможения может служить блокирование ферментов тяжелыми металлами (ртуть, мышьяк, свинец и др., которые присоединяются к сульфгидрильным группам полипептидной цепи), солями синильной кислоты, оксидом углерода (II) и др. (присоединяются к железосодержащим простетическим группам и т. п.). В качестве другого варианта неконкурентного торможения действия фермента следует отметить аллостерическое ингибирование (см. рис. 51, IV).
Специфическую группу ингибиторов ферментов, которой уделяют огромное внимание в последние годы, составляют ингибиторы белковой природы. Они блокируют действие фермента за счет белок-белковых взаимодействий, в результате чего закрывается активный центр фермента. Особенно энергично белковые ингибиторы регулируют деятельность протеиназ клетки, что сильно сказывается на регуляции обмена веществ в целом, поскольку под воздействием ингибиторов протеиназ тормозится переход проферментов в ферменты, отщепление сигнальных пептидов и других пептидных фрагментов при созревании белков, блокируются реакции протеолиза, ведущие к образованию биологически активных пептидов (гормоны пептидной природы, рилизинг-факторы и т. п.—см. гл. XII). Так, например, ингибитор белковой природы — a1-антитрипсин (гликопротеин с М = 52000, получаемый методом генетической инженерии из пекарских дрожжей), нашел применение для лечения эмфиземы (частичного распада) легких, так как он блокирует действие эластазы, выделяемой в норме нейтрофилами легочной ткани (рис. 52). От 2 до 4 граммов a1-антитрипсина достаточно для заместительной терапии при эмфиземе легких, развивающейся в результате курения.
Учение об активаторах и ингибиторах ферментов в настоящее время сливается с более широким и общим вопросом о регуляции действия ферментов в целом. В частности, установлено, что конечный, а иногда и промежуточный продукт многостадийного процесса биосинтеза может служить аллостерическим ингибитором одной из первых его реакций (см., например, ретроингибирование биосинтеза пиримидиновых нуклеотидов — гл. XIII).
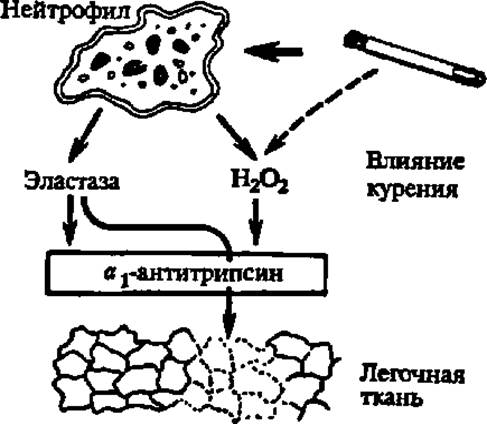
Рис. 52. a-Антитрипсин и его роль в поддержании целостности легочной ткани
В норме в легких деструктирующее действие эластазы. выделяемой нейтрофилами, блокируется а1-антитрипсином, приносимым током крови в составе а1-глобулина. Курение вызывает увеличение числа и активности нейтрофилов и, как следствие этого, усиление действия эластазы и падение эластичности легочной ткани (отмечено пунктиром при ее изображении на рисунке). К тому же продукты сгорания табака понижают ингибирующие свойства а1-антитрипсина, который следовало бы называть антиэлистазой, тик как он ингибирует эластазу сильнее, чем, трипсин