Основы биохимии - Филиппович Ю. Б. 1999
Ферменты
Кинематика ферментативных реакций
Под ферментативной кинетикой в широком смысле понимают зависимость скорости реакции, ускоряемой ферментом, от химической природы реагирующих веществ (субстраты, фермент) и условий их взаимодействия (концентрация, температура, pH среды, наличие активаторов или ингибиторов и т. п.). Однако зависимость скорости ферментативного процесса от температуры, pH среды и влияния ингибиторов и активаторов в значительной мере связана с изменением свойств фермента как белкового тела. Поэтому здесь будет освещен только вопрос о закономерностях, определяемых природой и концентрацией реагирующих веществ и их изменением.
Как показано выше, первой фазой биокаталитического процесса является образование фермент-субстратного комплекса:
![]()
Эта равновесная система может быть охарактеризована соответствующей константой равновесия. Величину, обратную ей, называют константой диссоциации фермент-субстратного комплекса или субстратной константой и обозначают Ks:
![]()
Она зависит от природы субстрата и фермента и отражает степень их сродства. Так, для сахаразы (фермент, ускоряющий реакцию гидролиза сахарозы) Кs = 0,0167М, т. е. концентрация фермент-субстратного комплекса превышает концентрацию свободных фермента и субстрата примерно в 60 раз. Чем ниже значение Кs, тем выше, следовательно, сродство фермента к субстрату.
Так как концентрация фермент-субстратного комплекса изменяется вследствие перехода последнего в продукт реакции с регенерацией свободного фермента:
![]()
то значение Ks находят из соотношения констант скоростей прямой (k+1) и обратной (K+1) реакций, т. е.
![]()
К указанному выводу можно прийти, приравнивая скорости прямой и обратной реакций, что характерно для равновесного состояния системы: v1 = k+1 [E] [S]сли v2 = v2,то; k+1 [E] [S] = k-1[ES] = k-1 [ES], т. е. [E] [S] / [ES] = k-1/k+1 = Ks.
Таким образом, субстратная константа, или константа диссоциации, фермент-субстратного комплекса (Ks) характеризует биокаталитический процесс с точки зрения сродства фермента и субстрата и соотношения констант скорости реакций распада и становления фермент-субстратного комплекса.
Так как одновременно с диссоциацией фермент-субстратного комплекса на исходные вещества происходят превращения субстрата в продукт и распад комплекса фермент —продукт на составляющие его компоненты:
![]()
для полной характеристики ферментативного процесса введено понятие о константе Михаэлиса (Кm), которая представляет отношение констант скоростей всех трех реакций, осуществляющихся в процессе ферментативного катализа: Km = (k-1 + k+2)/k+1. Кm всегда несколько выше по числовому значению, чем Ks. Так, Кs для комплекса сахаразы и сахарозы равно 0,0167М, а Кm составляет 0,0280М.
Скорость химической реакции, ускоряемой ферментом (как и скорость обычной химической реакции), измеряют количеством молей субстрата, превращаемых в единицу времени. Однако принципиально важно, чтобы при этом поддерживались стандартные условия для проявления активности фермента: температура 25° С, оптимальное значение pH и, что особенно существенно, полное насыщение фермента субстратом. Скорость ферментативной реакции, измеренной при соблюдении перечисленных условий, обозначают V и называют максимальной скоростью ферментативной реакции. Она определяется концентрацией фермента и константой скорости распада комплекса фермент-продукт: V = k+2[Е].
Скорость ферментативной реакции, наблюдаемую при отсутствии полного насыщения фермента субстратом, обозначают v. Она в каждый данный момент пропорциональна концентрации фермент-субстратного комплекса: v = k+2[ES]. Так как [ES] = k+1/k-1 = 1/Ks, т. е. [ES] = [E] [S] / K, то v = k+1, [E][S] / Ks.
Таким образом, наблюдаемая скорость ферментативной реакции зависит от концентрации фермента и субстрата и их сродства. Численно Кm равна той концентрации субстрата (в молях на литр), при которой V составляет 1/2V (рис. 48).
Концентрацию фермента и субстрата выражают обычно в микромолях на литр. Однако ввиду того, что точная молекулярная масса большинства ферментов и число каталитических (активных) центров в их молекулах неизвестны, применяют условный способ выражения абсолютного количества фермента. За единицу любого фермента (обозначаемую на русск. и нем. Е, а на англ., франц., итал. и исп. U) принимают то его количество, которое в стандартных условиях катализирует превращение 1 мкмоль субстрата в 1 мин. Эта величина (1 мкмоль/мин) является также единицей активности фермента. Указанная стандартная система обозначения количества фермента была введена в 1961 г. Комиссией по ферментам Международного биохимического союза и прочно вошла в ферментологию. Ею пользуются и поныне. Как отмечено выше, согласно этой системе скорость ферментативной реакции выражали числом микромолей субстрата, превращаемых в 1 мин.
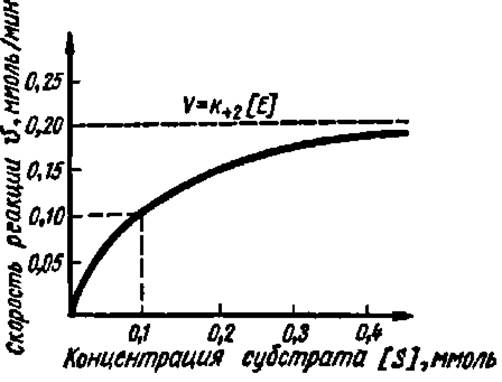
Рис. 48. Зависимость скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента
В 1972 г., в связи с переходом на выражение скорости биокаталитических превращений в молях субстрата, преобразуемого в течение 1 с, было предложено вместо старой, безымянной единицы ферментативной активности (Е или U) ввести новую единицу — катал (символ — кат), обозначающую количество фермента, способное в течение 1 с обеспечить превращение 1 моля субстрата (в стандартных условиях). Так как единица ферментативной активности в 1 кат, соответствующая скорости реакции 1 моль/с, мало реальна (превращения идут с гораздо меньшей скоростью), каталитическую активность в новой системе единиц выражают в микрокаталах (мккат), нанокаталах (нкат) и пикокаталах (пкат), чему отвечают скорости реакций в микромолях, наномолях и пикомолях в секунду соответственно. Старая единица (Е или U) равна 16,67 нкат. В течение ближайших лет предполагают осуществить переход на выражение ферментативной активности в каталах.
Концентрацию фермента в растворе в указанных единицах (Е) выражают числом их в 1 мл раствора. В случае сухого препарата фермента приводят данные о количестве Е на 1 мг. Если в препарате фермента определено содержание белка, то высчитывают удельную активность ферментного препарата, выражаемую числом Е на 1 мг белка. При наличии данных о числе Е в 1 мг чистого фермента говорят об удельной активности фермента. Если известна молекулярная масса фермента, то легко рассчитать число Е на 1 мкмоль его, т. е. молекулярную активность фермента. Следовательно, речь идет уже не о выражении концентрации фермента, а о выражении активности фермента либо числом микромолей субстрата, превращенных в 1 мин 1 мг фермента (удельная активность фермента), либо числом молекул субстрата, превращенных в 1 мин одной молекулой фермента (молекулярная активность).
Если известно, сколько активных центров находится в молекуле фермента, активность его характеризуют числом молекул субстрата, превращенных при посредстве одного активного центра. Так, молекулярная активность каталазы равна 5 млн., тогда как активность ее каталитического центра (их в молекуле каталазы 4) составляет всего 1 млн. 250 тыс. молекул Н2О2.