Основы биохимии - Филиппович Ю. Б. 1999
Обмен белков
Посттрансляционная модификация белков
Не следует думать, что все белки, образовавшиеся в результате рибосомального синтеза, обладают полностью завершенной структурой. Во многих случаях они синтезируются в виде предшественников и лишь после протеолитического отщепления пептидного фрагмента приобретают законченную форму. Примерами такого рода посттрансляционной модификации белков может служить отщепление сигнальных пептидов по завершении переноса белков через биологические мембраны (см. рис. 101), фрагментирование белковых предшественников при образовании из них функционально активных белков, например трипсина из трипсиногена, инсулина из проинсулина, или биологически активных пептидов, например гормонов и рилизинг-факторов. Аналогичный характер носит посттрансляционная модификация белков, сводящаяся к протеолитическому отщеплению N-концевого формилметионина или метионина, с которых, как показано выше, начинается сборка полипептидных цепей в процессе рибосомального синтеза белков.
Вместе с тем широко представлена посттрансляционная модификация белков по аминокислотным радикалам. К их числу относятся: гидроксилирование радикала пролина при переходе проколлагена в коллаген; ацетилирование N-концевой аминокислоты в белковой молекуле, как, например, при биосинтезе яичного альбумина; метилирование радикалов лизина и аргинина при посредстве S-аденозил-b-метиошш: протеин N-метил- или О-метилтрансферазы, особенно широко представленное при посстрансляционной модификации гистонов, негистоновых ядерных белков и рибосомальных белков; присоединение олигосахаридных фрагментов к радикалам аспарагина, серина и треонина при биосинтезе гликопротеинов; амидирование радикалов аспарагиновой и глутаминовой кислоты, что связывают в настоящее время с изменчивостью белков в онтогенезе и, в частности, при старении; карбоксилирование радикалов глутаминовой кислоты по у-углеродному атому, в результате чего в белке возникают остатки у-карбоксиглутаминовой кислоты, необходимые, в частности, для связывания Са2+; аденилирование и уридилирование радикалов тирозина. К посттрансляционным процессам, имеющим важнейшее значение для регуляции метаболической активности генома, относится фосфорилирование гистонов и негистоновых белков хроматина. Один из примеров котрансляционной модификации белков приведен на рис. 102.
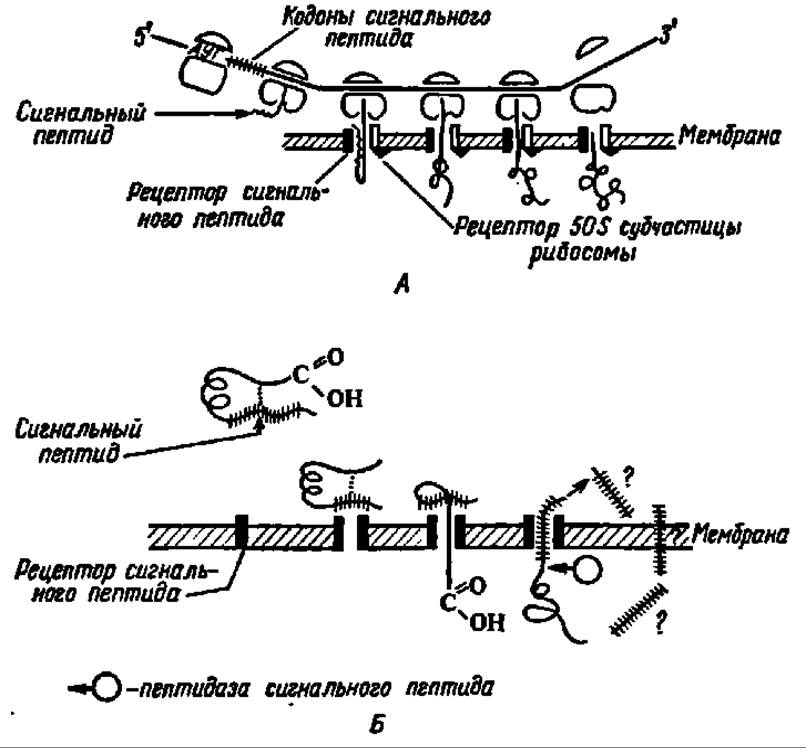
Рис. 101. Транслокация белка через липопротеиновую мембрану:
А — контрансляционный перенос белка; Б — посттрансляционный перенос белка. Сигнальный пептид, взаимодействуя с рецептором мембраны, обеспечивает поступление новообразуемого на рибосоме белка в липопротеиновую мембрану.
В случае котрансляционного переноса на мембране при посредстве специфического рецептора закрепляется также рибосома, а сама транслокация белка осуществляется за счет возникновения конформера полипептидной цепи. При посттрансляционном переносе в транслокации участвуют белковые факторы, примыкающие к рецепторам сигнального пептида. И в том и в другом случае сигнальный пептид отщепляется от функциональной части белка при посредстве пептидазы сигнального пептида; судьба его пока не выяснена