Основы биохимии - Филиппович Ю. Б. 1999
Углеводы и их обмен
Строение углеводов
Общая характеристика углеводов. К классу углеводов относят органические соединения, содержащие альдегидную или кетонную группу и несколько спиртовых гидроксилов. Их элементарный состав выражается общей формулой СmН2nОn. Из этого правила есть немногочисленные исключения, и хотя указанное определение не является абсолютно точным, оно позволяет наиболее просто характеризовать эту группу разнообразных органических соединений в целом.
Ни название класса, ни общая формула этих соединений не дают ясного представления об их химическом характере и строении. Более того, термин «углеводы», предложенный впервые К. Шмидтом, профессором Юрьевского университета (1844), наводит на мысль, что их следует рассматривать как «гидраты» углерода. На самом деле это было бы совершенно неправильно. Поэтому сравнительно давно (1927) для обозначения этого класса соединений был предложен другой термин — «глюциды», который, к сожалению, с большим трудом пробивает себе дорогу в химической номенклатуре.
К углеводам относятся соединения, обладающие разнообразными и часто совершенно различными свойствами. Среди них есть вещества низкомолекулярные и высокомолекулярные, кристаллические и аморфные, растворимые в воде и не растворимые в ней, гидролизуемые и негидролизуемые, способные очень легко окисляться и сравнительно устойчивые к действию окислителей и т. д. Это многообразие качеств находится в тесной связи с химической природой углеводов, со строением их молекул; оно предопределяет то или иное участие углеводов в процессах жизнедеятельности и в построении тканей животных и растений.
Во всех без исключения организмах углеводы служат материалом, при окислении которого выделяется энергия, необходимая для осуществления химических реакций. Такие углеводы рассматривают как резервные. Наряду с этим промежуточные продукты окисления углеводов используются для синтеза многих других органических соединений.
Перечисленные функции углеводов (структурная, энергетическая и метаболическая) рассматривают как канонические. Однако в последнее время выяснено, что углеводам присущи многие другие, нестандартные, неканонические функции. Многие углеводы и углеводсодержащие биополимеры обладают уникальным строением и специфичностью. Так, групповые вещества крови, являющиеся гликопротеинами, где 80% молекулы представлены углеводами, именно за счет ассимметрических центров, стереоизомеров, таутомеров и конформеров последних приобретают поразительную специфичность взаимодействия. Олигосахаридные фрагменты гликопротеинов и гликолипидов клеточных стенок выдвинуты как антенны за пределы клеточных оболочек и служат локаторами, выполняющими рецепторные функции. В частности, при их посредстве с клетками связываются белковые токсины (например, холерный, ботулический, столбнячный, дифтерийный, шигатоксины и др.), бактерии (например, кишечная палочка с олигосахаридами, составленными из остатков маннозы), вирусы (например, вирус гриппа) и т. п. Структуры олигосахаридных фрагментов иммуноглобулинов высоковоспроизводимы и умеренно консервативны, что обеспечивает специфические углеводно-белковые взаимодействия между доменами этих удивительно тонко организованных защитных белков. Более 250 ферментов обладают олигосахаридными фрагментами, которые избирательно взаимодействуют с многочисленными лектинами — белками, дающими конъюгаты с углеводами. Таким образом, наряду с нуклеиновыми кислотами и белками углеводы с современной точки зрения являются информационными молекулами, т. е. кодовыми словами в молекулярном языке жизни. Благодаря этому все более ясно начинают вырисовываться контуры нового направления в биохимии углеводов — гликобиология и гликотехнология.
В зависимости от состава, строения и свойств, в частности от поведения при нагревании с разбавленными водными растворами кислот (т. е. в зависимости от отношения к гидролизу), углеводы делят на две группы: простые и сложные. Простые углеводы не подвергаются гидролизу. Сложные углеводы при гидролизе распадаются с образованием простых углеводов.
Простые углеводы. Подавляющее большинство простых углеводов имеет состав СnН2nОn. Ввиду того что простые углеводы не гидролизуются, их называют моносахаридами. Все простые углеводы — кристаллические тела, хорошо растворимые в воде и имеющие, как правило, сладкий вкус. По химическим свойствам они бифункциональны и могут быть охарактеризованы как полиоксиальдегиды или полиоксикетоны. Это значит, что в их молекулах содержится альдегидная или кетонная группа и несколько спиртовых (окси-) групп. В зависимости от числа кислородных атомов в молекуле моносахариды делят на несколько групп, названия которых образуют из греческих числительных с добавлением окончания -оза, характерного для углеводов. Ряд простых углеводов в целом называют поэтому рядом моноз. Сейчас известно более 200 природных моноз. В зависимости от положения в молекуле карбонильной группы моносахариды существуют в виде изомеров: альдоз и кетоз.
Так как в молекулах моносахаридов присутствуют асимметрические атомы углерода и, следовательно, молекулы в целом построены асимметрично, данной группе соединений свойственна оптическая, или зеркальная, изомерия. Как и у других оптически деятельных соединений, зеркально построенные формы моносахаридов носят название оптических антиподов. Эквимолекулярные смеси или соединения последних друг с другом называются рацематами. Стереоизомеры моносахаридов, отличающиеся пространственным расположением водорода и ОН-группы у соседнего с альдегидной группой углеродного атома, являются эпимерами. Природные сахара относятся в основном к правому ряду, что, видимо, связано с особенностями их первичного биосинтеза в растениях.
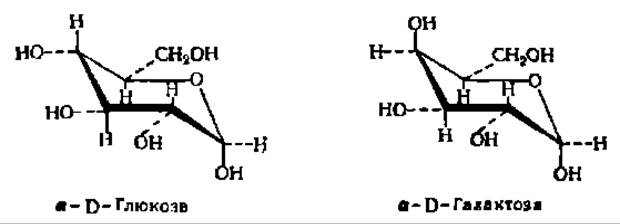
Из альдоз особенно широко распространены в природе D-рибоза, D- глюкоза, D-манноза и D-галактоза:
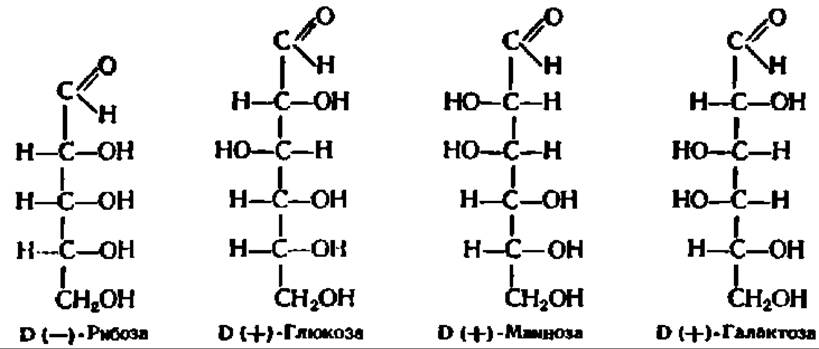
Из кетоз наиболее известными являются D-рибулоза и D-фруктоза; из гептоз целесообразно отметить D-седогептулозу:
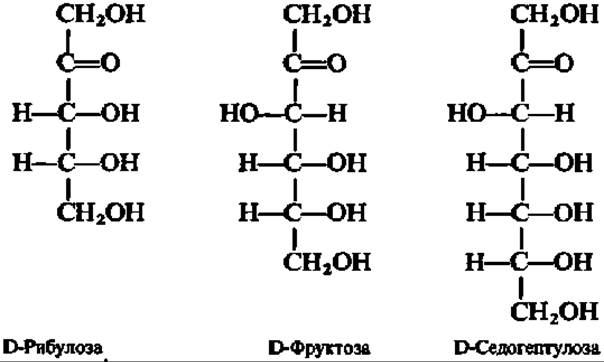
Все указанные кетозы активно участвуют в превращениях углеводов в организме.
Характерной особенностью моносахаридов является их ярко выраженная способность к таутомерным превращениям. Различают два вида таутомерии моносахаридов: кето-енольную и кольчато-цепную.
Кето-енольная таутомерия моносахаридов состоит в переходе формы с карбонильным кислородом в альдегидной или кетонной группе в енольную форму (с ОН-группой при углеродном атоме, связанном двойной связью). Благодаря кето-енольной таутомерии эпимерные моносахариды могут превращаться друг в друга.
Кольчато-цепная таутомерия моносахаридов заключается в существовании кольчатых (циклических) форм и цепной (т. е. с открытой углеродной цепью) формы моносахарида, находящихся в динамическом равновесии. Мысль о существовании циклических форм моносахаридов была впервые (1870) высказана профессором Московского высшего технологического училища А. А. Колли. Замыкание цикла осуществляется при сближении СО-группы моносахарида с гидроксилом углеродного атома, удаленного от нее на 3—4 звена. По карбонильному кислороду проходит реакция присоединения атома водорода упомянутой спиртовой группы, в результате чего образуется новый гидроксил, получивший название гликозидного или полуацетального. Одновременно с этим замыкается кислородный мостик, дающий начало пяти- или шестичленному гетероциклу (типа фурана или пирана):
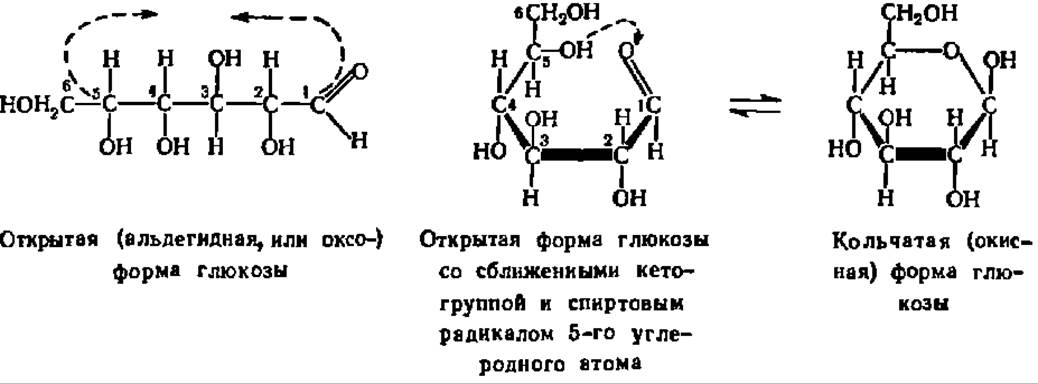
Углеродные атомы шести- или пятичленного гетероцикла в циклических формулах моносахарида, а иногда и все остальные боковые группы опускают, и тогда они при написании приобретают следующий вид:
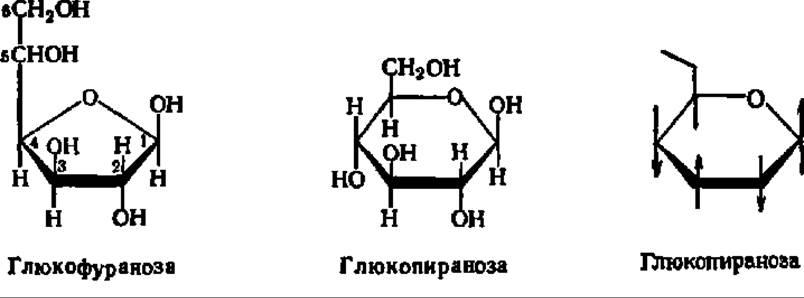
Жирными линиями изображают те связи между углеродными атомами цикла, которые направлены к наблюдателю, тонкими — те, что находятся за плоскостью бумаги; это облегчает пространственное восприятие циклической формулы. Атомы водорода и ОН-группы представляются расположенными соответственно над и под плоскостью гетероцикла.
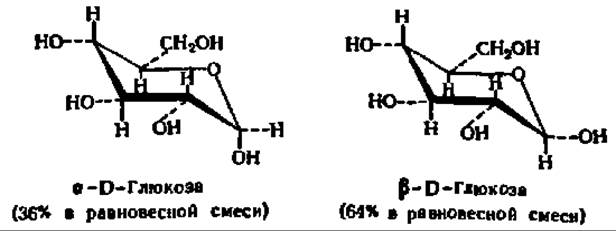
Так как в момент замыкания цикла углеродный атом бывшей СО-группы становится асимметрическим, появление циклической формы моносахарида сопровождается возникновением двух новых оптических изомеров. Тот из них, у которого гликозидный гидроксил направлен в ту же сторону, что и спиртовой гидроксил при предпоследнем углеродном атоме моносахарида (определяющем принадлежность его к D- или L-ряду), называют a-формой. Противоположная по пространственному расположению гликозидного радикала форма называется ß-формой. Ниже приведены соответствующие примеры а и ß-форм, называемых также анамерами (от греч. ана — вверх, так как гликозидные радикалы располагаются обычно при 1-м, верхнем углеродном атоме):
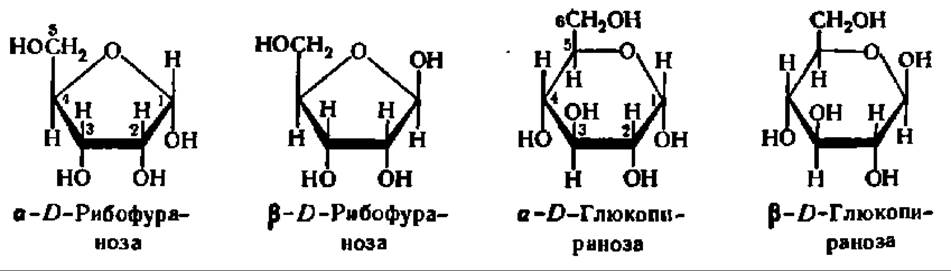
Кетозы, как и альдозы, образуют кольчатые формы. В качестве примера рассмотрим кольчато-цепную таутомерию фруктозы. Как и другие моносахариды, фруктоза образует 4 циклические формы, находящиеся в динамическом равновесии с открытой формой (см. с. 310).
Обычно циклические формы моносахаридов в растворе резко преобладают над открытой цепной формой; кроме того, как правило, одна из циклических форм моносахарида присутствует в равновесной смеси всех форм в большем количестве, чем другие. Так, среди 4 циклических форм D-глюкозы резко преобладает в растворе ß-D-глюкопираноза (64%); содержание же альдегидной формы глюкозы в равновесной смеси составляет всего 0,024%. Концентрация а и ß-глюкофураноз в смеси также ничтожна и все остальное количество глюкозы представлено а-анамером. В целом пиранозные формы резко преобладают над фуранозными формами.
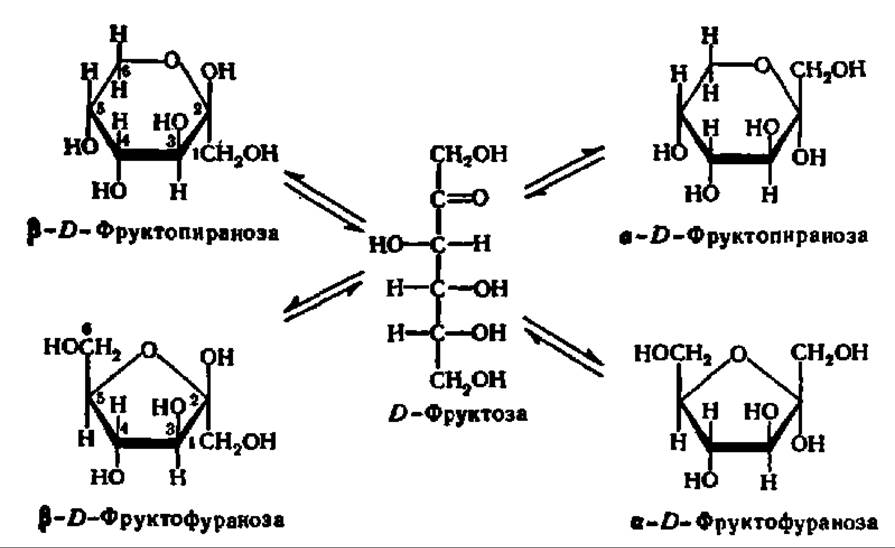
Кольчато-цепная таутомерия моносахаридов является причиной любопытного свойства простых углеводов. В кристаллическом состоянии моносахариды находятся только в циклической форме. В зависимости от условий кристаллизуется либо а-, либо ß-форма. Так, при кристаллизации из воды глюкоза получается в a-форме, a из пиридина — в ß-форме. После растворения a-D-глюкозы в воде вначале наблюдается характерное для нее значение удельного вращения, равное +112,2°. Однако при стоянии раствора эта величина постепенно снижается и наконец достигает устойчивого значения + 52,5°. Аналогично этому исходное удельное вращение раствора ß-D-глюкозы (+17,5°) при стоянии также изменяется, повышаясь до +52,5°. Так как в течение некоторого времени после растворения кристаллических препаратов глюкозы в растворе удается наблюдать много значений удельного вращения, пока не установится его равновесное значение, это явление получило название мультиротации или мутаротации (от лат. multum — много, rotatio — круговращение). Оно связано с тем, что в растворе устанавливается равновесие между всеми возможными кольчатыми и цепной модификациями глюкозы, каждая из которых обладает своим удельным вращением, а их смесь — средним значением удельного вращения (+52,5°).
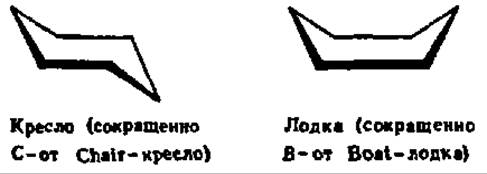
Конформации углеводов крайне разнообразны. Известно, что шестичленные, алициклические соединения (циклогексан) существуют в геометрически различных формах, которые принимает молекула, без нарушения длины валентных связей и углов между ними. Указанные формы называются конформационными изомерами. Для моносахаридов, которым присуща в основном пиранозная структура, конформационная изомерия также характерна. Однако если для циклогексана известно всего две конформации — типа кресла и типа лодки:
то для моносахаридов в пиранозной форме известно 8 конформаций — 2 типа кресла и 6 типа лодки ввиду присутствия в шестичленном цикле гетероатома — кислорода:
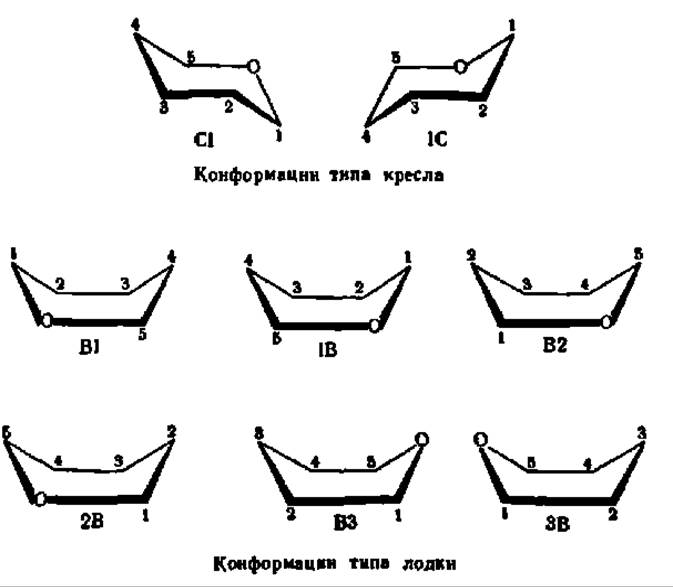
Из перечисленных 8 конформаций пиранозного цикла наиболее устойчивы креслообразные. В свою очередь, из них С-изомер более предпочтителен, так как подавляющее число заместителей в нем ориентировано в экваториальном, совпадающем с плоскостью цикла, направлении. Именно в виде Сl-конформации существует большинство моносахаридов, например:
Естественно, что β-анамер D-глюкозы преобладает в равновесной смеси над а-анамером, так как гликозидный гидроксил в конформации Cl у первого расположен экваториально:
Так обстоит дело не только у анамеров глюкозы, но и у анамеров ряда других моносахаридов.
Кольчато-цепная таутомерия моносахаридов является свойством, которое зависит от одновременного присутствия в их молекулах СО-группы и спиртовых радикалов. Поведение гликозидного гидроксила, возникающего при образовании циклической формы моносахарида, своеобразно: он гораздо активнее вступает в химические реакции, чем остальные гидроксильные группы. Производные циклических моносахаридов, полученные в результате замещения атома Н гликозидного гидроксила на какой-либо радикал, получили название гликозидов, а сам этот радикал именуют агликоном. Примером могут служить а- и ß-метилгликозиды (см. с. 109).
В качестве агликона в природных гликозидах, отличающихся, как правило, сильным физиологическим действием, встречаются многие, часто весьма сложные радикалы. Так, например, в растениях много гликозидов со стероидными агликонами; они являются сильными ядами и защищают растения от вирусов и патогенов. Высоким содержанием гликозидов с разнообразными агликонами отличаются морские беспозвоночные. Многие из этих гликозидов применяют в медицине. Сложные углеводы являются тоже типичными гликозидами.
Моносахариды дают все типичные реакции по альдегидной группе и по спиртовым радикалам. Так, по альдегидной группе для них характерны реакции окисления и восстановления, замещения карбонильного кислорода, поликонденсации (осмолення) и др., по спиртовым — образование простых и сложных эфиров и другие взаимодействия, хорошо известные из курса органической химии. В биохимии же особое значение придают окислительно-восстановительным реакциям моносахаридов и реакциям образования их фосфорных эфиров.
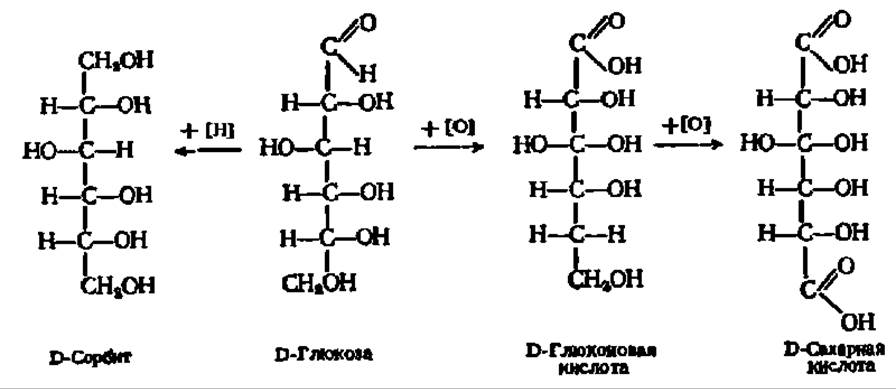
Так, при окислении или восстановлении, например, глюкозы, протекающем очень легко, получается соответственно кислота или спирт:
Из фосфорных эфиров особо важное значение имеют глюкозо-1-фосфат, глюкозо-6-фосфат, фруктозо-1,6-дифосфат, рибулозо-5-фосфат и др.:
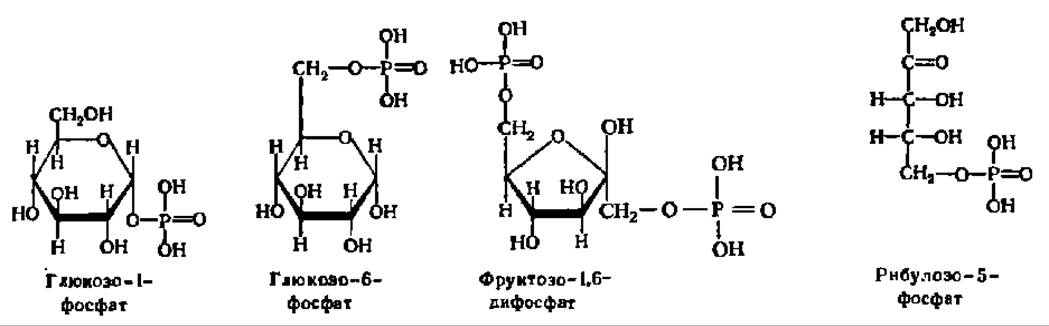
Эти соединения принимают самое активное участие в биохимических процессах, протекающих в живых объектах. Фосфорилирование (т. е. введение в молекулу моносахарида остатка фосфорной кислоты) — это первый, подготовительный этап как к распаду простых углеводов, так и к биосинтезу из них более сложных углеводов. По мнению А. Е. Чичибабина (1932), фосфорилированне моносахаридов способствует их переходу из циклической формы в открытую цепную форму.
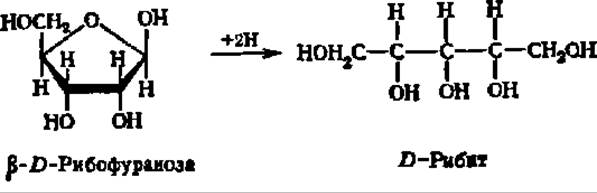
Важнейшими представителями моноз являются рибоза, глюкоза, манноза, галактоза и фруктоза. D-Рибоза входит в состав нуклеиновых кислот в качестве структурного элемента нуклеотидных остатков, где она находится в ß-D-фуранозной форме. Кристаллическая рибоза плавится при 87° С, удельное вращение в водном растворе равно 23,7°. При восстановлении рибозы получается пятиатомный спирт — рибит, принимающий участие в построении многих биактивных соединений:
D-Глюкоза — один из наиболее распространенных природных сахаров. Впервые кристаллический сахар из сиропа, полученного после обработки крахмала кислотой, выделил К. Киргоф (1811); четверть века спустя Жан Батист Андре Дюма назвал его глюкозой. В организмах она содержится в свободном состоянии или в связанной форме, являясь в последнем случае основой таких важнейших природных соединений, как тростниковый (свекловичный) сахар, крахмал, клетчатка и др. Образует кристаллы с tпл= 146° С у а-глюкопиранозы и 148—150° С—у ß-глюкопиранозы. При нагревании в пиридине a-форма (удельное вращение +112,2°) превращается в ß-форму (удельное вращение +17,5°). Поэтому из водных и спиртоводных растворов кристаллизуется a-D-глюкопираноза, а из растворов в пиридине — ß-D-глюкопираноза. При восстановлении глюкозы образуется D-сорбит, а при окислений — D-глюконовая и далее сахарная кислота.
D-Галактоза входит в состав ряда сложных углеводов, в том числе молочного сахара. Кристаллизуется в виде моногидрата. Безводные кристаллы плавятся при 164° С; удельное вращение (конечное значение) +81°.
D-Манноза образует природные сложные углеводы — маннаны, часто являющиеся углеводными компонентами гликопротеинов и слизей, а также оболочек растительных клеток. Маннопираноза плавится при 132° С, а ее а- и ß- формы имеют разное значение угла вращения (+30 и —17° соответственно); конечный угол вращения, устанавливающийся в результате мутаротации, равен +14,5°.
D-Фруктоза встречается как в свободном (например, в составе меда), так и в связанном (например, в составе тростникового сахара и некоторых высокомолекулярных природных углеводов — фруктозанов) виде. Она в 2,5 раза слаще глюкозы и в 1,7 раза — тростникового сахара. Безводная фруктоза плавится при 102—104° С. Значение удельного угла вращения в равновесном (после достижения постоянного значения при мутаротации) состоянии равно — 92°, благодаря чему фруктозу называют левулозой.
В течение последнего времени накопились данные о существовании новой группы моносахаридов, которая Н. К. Кочетковым и сотр. (1975) названа гликолактиловыми кислотами. Моносахариды этой группы составлены из остатков обычных моносахаридов и молочной кислоты, связанных между собой простой эфирной связью (от лат. acidum lacticum — молочная кислота, происходит вторая половина названия этой новой группы моносахаридов). Важнейшим представителем гликолактиловых кислот является мурамовая кислота:
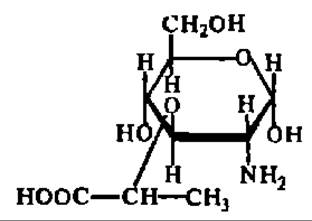
Она представлена кристаллами с tпл = 150—155° С; удельное вращение (равновесное) ее растворов составляет 103—123° в зависимости от значения pH. N-ацетилмурамовая кислота входит в состав пептидогликанов клеточных стенок бактерий; полисахаридные фрагменты пептидогликанов атакуются лизоцимом (см. с. 110—111).
Сложные углеводы. К категории сложных относят углеводы, молекулы которых распадаются при гидролизе с образованием простых углеводов. Состав сложных углеводов выражается общей формулой CmH2nOn, где m > n. Среди сложных углеводов выделяют две группы:
1. Олигосахариды — сахароподобные сложные углеводы, характеризующиеся сравнительно невысокой (несколько сотен) молекулярной массой, хорошей растворимостью в воде, легкой кристаллизацией и, как правило, сладким вкусом. Молекулы олигосахаридов составлены из небольшого числа (от греч. олигос — малый, немногочисленный) остатков простых углеводов.
2. Полисахариды — высокомолекулярные сложные углеводы, образованные из многих сотен остатков простых углеводов. Их молекулярная масса составляет обычно сотни тысяч. Они не дают ясно оформленных кристаллов, и лишь некоторые из них обладают псевдокристаллическим строением. Полисахариды либо не растворимы в воде, либо дают растворы, напоминающие по свойствам коллоидные, что можно объяснить большой молекулярной массой растворенных частиц. Для полисахаридов сладкий вкус не характерен.
Олигосахариды. В зависимости от количества остатков моносахаридов, входящих в молекулы олигосахаридов, последние делят на дисахариды, трисахариди и т. д. Наибольший интерес из олигосахаридов представляет группа дисахаридов — соединений, которые широко распространены в природе; многие из них имеют огромное практическое значение.
По химическому строению дисахариды являются гликозидами моносахаридов, агликонами которых служат также остатки моносахаридов. Дисахариды, у которых остаток моносахарида, служащий агликоном, присоединяется к гликозидному радикалу основного моносахарида по месту своего гликозидного гидроксила, называют гликозидо-гликозидами. Если же связь между агликоном и основным моносахаридом осуществляется за счет спиртового гидроксила агликона, то дисахариды называют гликозидо-глюкозами. Это иллюстрируют формулы трегалозы и мальтозы:
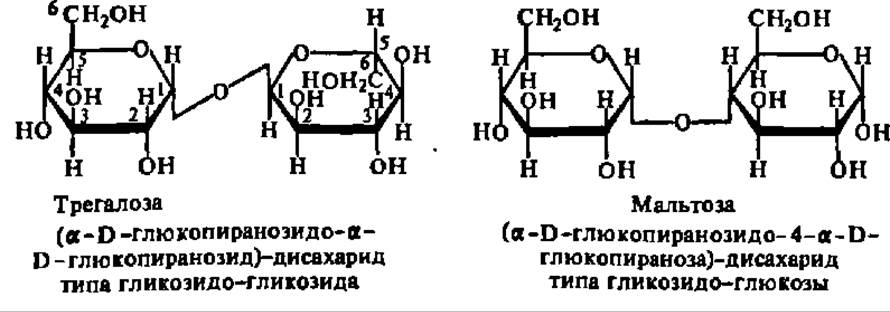
В соответствии со своим химическим строением дисахариды типа трегалозы (гликозидо-гликозиды) и типа мальтозы (гликозидо-глюкозы) обладают существенно различными химическими свойствами: первые не дают никаких реакций, свойственных альдегидной или кетонной группе, т. е. не окисляются, не восстанавливаются, не образуют озазонов, не вступают в реакцию поликонденсации (не осмоляются), не мутаротируют и т. п. Для дисахаридов типа мальтозы все упомянутые реакции, наоборот, весьма характерны. Причина этого различия вполне понятна из сказанного выше о двух типах структуры дисахаридов и свойствах входящих в их состав остатков моносахаридов. Она заключается в том, что только в дисахаридах типа мальтозы возможна кольчатоцепная таутомерия, в результате чего образуется свободная альдегидная или кетонная группа, проявляющая свои характерные свойства:
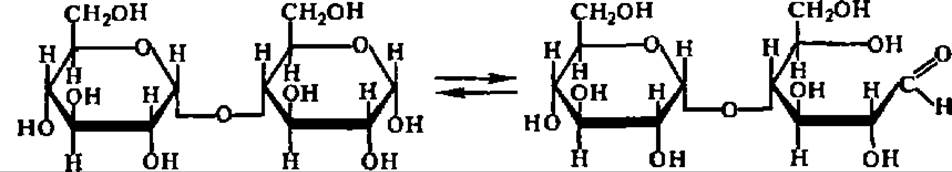
У дисахаридов типа трегалозы, где оба гликозидных гидроксила использованы для образования гликозидной связи между остатками моносахаридов, раскрытие цикла невозможно.
По спиртовым гидроксилам оба типа дисахаридов дают одинаковые реакции: образуют простые и сложные эфиры, взаимодействуют с гидратами оксидов металлов [например, растворяют Сu(ОН)2] и т. д.
В природе существует большое число дисахаридов; существенное значение среди них имеют упомянутые выше трегалоза и мальтоза, а также сахароза, целлобиоза и лактоза.
Сахароза представляет собой дисахарид типа гликозидо-гликозида, составленный из остатков a-D-глюкопиранозы и ß-D-фруктофуранозы. При гидролизе сахароза распадается на два моносахарида — a-D-глюкозу и ß-D-фруктозу (см. с. 128). Сахароза — один из самых распространенных в природе и практически наиболее важных дисахаридов. Она больше известна под названием тростникового или свекловичного сахара, так как из сока этих двух растений практически получают весь сахар. Сахароза содержится также в соке многих других растений, но в сравнительно небольшой концентрации, хотя в соке клена, березы и пальмы содержание ее довольно высоко.
Сахароза хорошо кристаллизуется (tпл = 184° С), легко растворяется в воде и незначительно в спирте. Растворы ее не мутаротируют, как это и свойственно гликозидо-гликозидам, но вращают плоскость поляризации света вправо на [a]D1 = 66,5°. Концентрацию сахара в растворе обычно измеряют при помощи специального поляриметра, шкала которого градуирована в величинах, показывающих процентное содержание сахара в растворе.
Так как при гидролизе сахарозы получающиеся из нее моносахариды имеют противоположные углы удельного вращения (в равновесном состоянии + 52,5° у глюкозы и —92° у фруктозы), суммарный угол вращения после гидролиза становится отрицательным. В связи с этим гидролизованную сахарозу называют инвертным сахаром, а сам процесс гидролиза — инверсией (от лат. inversio — переворачивание, перестановка).
1 Знак [а]D обозначает удельное вращение [а], измеренное в поляризованном свете, длина волны которого соответствует длине волны спектральной линии натрия (D = 588 нм).
Мальтоза относится к дисахаридам типа гликозидо-глюкоз и составлена из двух остатков óc-D-глюкопиранозы, соединенных гликозидной связью в положениях 1,4 (см. с. 314). Связь такого типа называют а-1,4-гликозидной связью. Мальтозу получают при гидролитическом расщеплении крахмала с помощью специфического фермента (см. с. 329), которым очень богаты прорастающие зерна ячменя. Так как проросшие, а затем высушенные и измельченные семена ячменя называют солодом, а английское название солода — malt, то образующийся из крахмала при участии фермента солода дисахарид и получил наименование мальтозы.
Мальтоза кристаллизуется из водных растворов в виде моногидрата, не имеющего резко выраженной точки плавления. Водные растворы мальтозы (она очень хорошо растворима в воде) мутаротируют, так как за счет кольчатоцепной таутомерии постепенно идет превращение исходной формы сначала в полуциклическую, а затем в другие таутомеры мальтозы, содержащие вместо a-D-глюкопиранозы ее ß-модификацию или а- и ß-глюкофуранозные циклы. Равновесный угол удельного вращения мальтозы равен +136°.
Мальтоза образуется в растительных и животных организмах как промежуточный продукт при гидролизе крахмала и может быть обнаружена в свободном виде. При гидролизе мальтоза распадается на две молекулы глюкозы.
Целлобиоза, как и мальтоза, состоит из двух остатков D-глюкозы и относится к дисахаридам типа гликозидо-глюкоз. Строение ее молекулы отличается от строения мальтозы только тем, что гликозидная связь между остатками моносахаридов начинается от гликозидного гидроксила, находящегося в ß- положении. Следовательно, молекула целлобиозы характеризуется наличием ß-1,4-гликозидной связи:
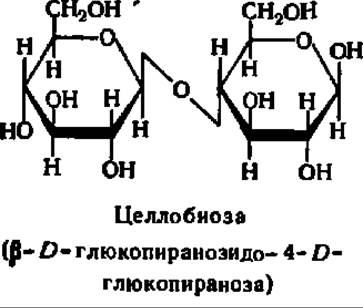
Целлобиоза отлично кристаллизуется, хорошо растворима в воде и мало растворима в спирте, мутаротирует: [a]D = +34,6°, легко окисляется и является хорошим восстановителем, образует характерный озазон, при гидролизе дает исключительно D-глюкозу.
Целлобиоза широко распространена в растительном мире; она найдена в прорастающих семенах, косточках абрикосов, пасоке деревьев. Целлобиоза образуется при ферментативном гидролизе целлюлозы (клетчатки), составляющей оболочки растительных клеток.
Лактоза является ß-D-галактoпиpанoзидo-4-D-глюкoпиpанoзoй:
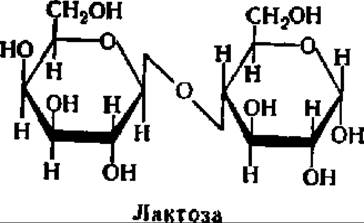
Она содержится в значительном количестве в молоке (5—8%) и называется поэтому молочным сахаром. Однако лактоза присуща не только млекопитающим (хотя ее роль в их питании бесспорна), так как она найдена, например, в пыльцевых трубочках ряда растений. Лактоза плохо растворима в воде, может быть получена путем упаривания молочной сыворотки. Кристаллизуется в виде моногидрата с tпл = 202° С. Ввиду того что остаток глюкозы обладает свободным гликозидным гидроксилом, возможна мутаротация, и лактоза, следовательно, может существовать в двух формах. Равновесная смесь ее а и ß-формы имеет удельное вращение + 52,2°. В отличие от других дисахаридов кристаллы лактозы не гигроскопичны.
Полисахариды. К полисахаридам относятся вещества, построенные из большого числа остатков моносахаридов или их производных. Если полисахарид содержит остатки моносахарида одного вида, его называют гомополисахаридом. В том случае, когда полисахарид составлен из моносахаридов двух видов или более, регулярно или нерегулярно чередующихся в молекуле, его относят к гетерополисахаридам.
К числу наиболее важных природных гомополисахаридов принадлежат крахмал, гликоген (животный крахмал), клетчатка, декстран и хитин. Первые четыре полисахарида при гидролизе дают только D-глюкозу, последний — высвобождает производное D-глюкозы — N-ацетил-глюкозамин. Кроме того, известно много других гомополисахаридов. Так, полисахарид инулин при гидролизе дает только фруктозу, маннан — маннозу, галактан — галактозу, арабан — арабинозу и т. п. Названия этим полисахаридам даны по конечным продуктам их расщепления.
К числу важнейших природных гетерополисахаридов относят гиалуроновую и хондроитинсерную кислоты, гепарин, капсулярные полисахариды бактерий, агарозу, порфираны и каррагинаны красных водорослей, альгиновыe кислоты бурых водорослей, структурные полисахариды простейших.
Биологическое значение полисахаридов разнообразно. Многие из них (крахмал, гликоген, инулин и др.) являются в растительных и животных организмах запасными питательными веществами. Некоторые полисахариды (например, хондроитинсерная кислота, капсулярные полисахариды и клетчатка) несут исключительно опорные и защитные функции. Ряд полисахаридов (маннаны, галактаны и др.) используется и как строительный, и как питательный материал. Гиалуроновая кислота, составляющая межклеточное вещество тканей животных, наряду со структурной функцией регулирует распределение жизненно необходимых веществ в тканях. Гепарин предотвращает свертывание крови в организме человека и животных. Во многих случаях полисахариды дают очень прочные комплексы с белками, образуя гликопротеины, выполняющие в организме ряд ответственных функций.
Химическое строение полисахаридов однообразно. Все они являются полигликозидами, в молекулах которых за счет кислородных мостиков объединяются сотни, тысячи, а иногда и десятки тысяч остатков моносахаридов и их производных. При этом непременным партнером в образовании кислородных мостиков служит гликозидный гидроксил моносахаридов, а другим партнером оказывается один из спиртовых гидроксилов моносахарида, чаще всего в положении 4 (у линейных полисахаридов) или 4 и 6 (у разветвленных форм).
Полисахариды сравнительно легко гидролизуются при кипячении с разбавленными растворами кислот или при инкубации с соответствующими ферментами. Щелочи не гидролизуют полисахаридов. Так, гликоген можно нагревать в течение нескольких часов с 30%-ным раствором щелочи без какого-либо разложения его. На этом основан метод количественного определения гликогена. Характерно, что в ряде случаев при ферментативном гидролизе таких распространенных полисахаридов, как крахмал и клетчатка, образуются дисахариды (мальтоза и целлобиоза соответственно), тогда как при неспецифическом кислотном гидролизе образуется моносахарид (D-глюкоза).
Крахмал — один из наиболее распространенных запасных полисахаридов растений. Он интенсивно накапливается в результате фотосинтеза и откладывается в семенах, клубнях и других частях растений. Семена и клубни содержат 40—70% крахмала, другие части растений — от 4 до 25%. При кислотном гидролизе крахмал распадается с образованием D-глюкозы, являющейся его структурным элементом, и небольшого количества глюкозо-6-фосфата, так как все виды крахмала содержат немного (0,02—0,16%) фосфора. Установлено, что глюкоза в составе крахмала находится в виде a-D-глюкопиранозы.
Природный крахмал состоит из двух различных фракций, отличающихся по своему строению и свойствам. Примерно 20% крахмала составляет амилоза (от греч. амилон — крахмал). Остальное приходится на вторую фракцию, получившую название амилопектина (от греч. пектос — студнеобразный). Такая терминология отражает некоторые свойства этих двух видов крахмала. Амилопектин с трудом растворяется в горячей воде, причем раствор получается вязкий (крахмальный клейстер) и при охлаждении застывает в студневидную массу. Амилоза же хорошо растворима в теплой воде и не образует клейстера. Пользуясь этим обстоятельством, амилозу отделяют от амилопектина, многократно извлекая ее теплой водой. С этой же целью используют способность амилозы осаждаться под действием бутилового спирта при насыщении последним горячего раствора, содержащего смесь амилозы и амилопектина. Применяют и хроматографические методы. Например, после пропускания диспергированного крахмала через колонку с фосфатом кальция и последующего промывания фосфатным буфером амилоза элюируется, а амилопектин остается на сорбенте.
Молекулярная масса амилозы и амилопектина различна: у не деградировавших в процессе выделения препаратов амилозы она составляет от 100000 до 400000, а у амнлопектина превышает, как правило, 20 ∙ 106. Эти данные получены методом гельфильтрации через сефадекс G-200 и сефарозу 2В. При этом картофельный крахмал, например, разделен на 9 фракций с молекулярными массами от 7 ∙ 106 до 73 ∙ 106. Видимо, значения молекулярных масс рассматриваемых здесь и ниже полисахаридов зависят от примененного способа выделения. В тех случаях, когда нативность препарата не утрачена, молекулярные массы очень высоки. Соответственно коэффициент поликонденсации a-D-глюкопиранозы в молекулах амилозы оценивается в несколько сотен, а у амилопектина — в несколько десятков и даже сотен тысяч.
Различна и химическая структура амилозы и амилопектина. Молекулы первой, как правило, строго линейны. В них остатки a-D-глюкопиранозы связаны друг с другом — исключительно а-1,4-глюкозидными связями, т.е. кислородные мостики возникают за счет гликозидного гидроксила 1-го углеродного атома одной молекулы a-D-глюкопиранозы и спиртового гидроксила при 4-м углеродном атоме другой:
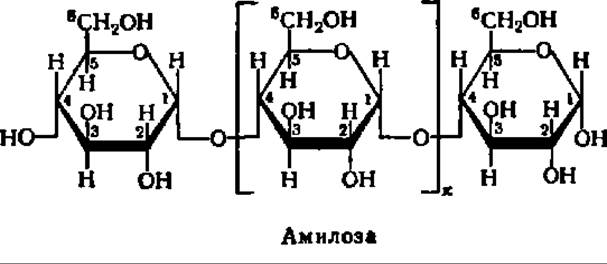
В соответствии с таким строением амилозу можно характеризовать как а-1,4-глюкан. Таким образом, амилоза представляет линейный полисахарид, молекулы которого имеют нитевидную структуру (рис. 103 и 104). Остатки a-D-глюкопиранозы в составе амилозы имеют конформацию типа лодки. В этом случае структурная формула амилозы принимает следующий вид:
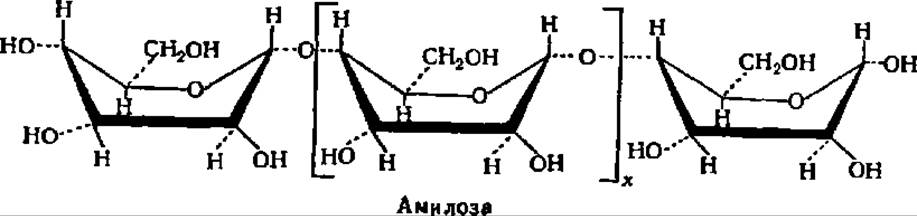
Лодкообразная конформация a-D-глюкопиранозных остатков в молекуле амилозы способствует спирализации полигликозидной цепи. При этом один виток спирали включает 6—7 остатков глюкозы. При длине каждого остатка глюкозы, равной 0,5 нм, возникает спираль диаметром около 1 нм (рис. 103). Допускают, что молекулы амилозы, как и других линейных полисахаридов, могут на том или ином протяжении взаимодействовать друг с другом, образуя вторичные структуры биспирального типа с взаимозакрученными полисахаридными цепями.
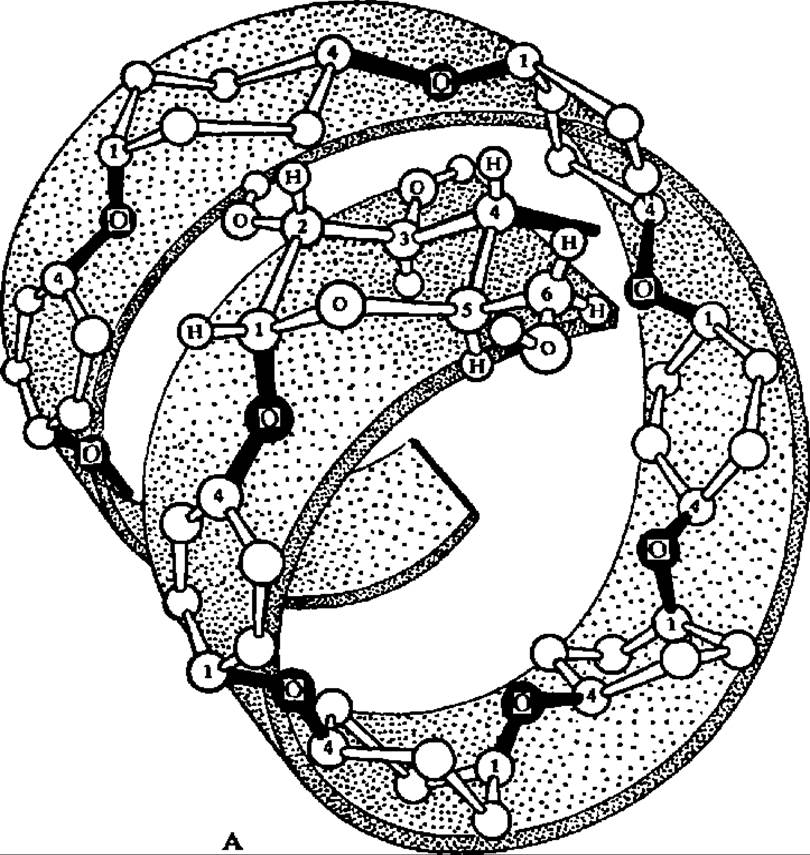
Рис. 103. Спиральная конформация молекулы амилозы (А), точки приложения действия a-амилазы при гидролизе (Б) и структура адсорбционного комплекса между спирализованными участками крахмала и молекулами иода (В)
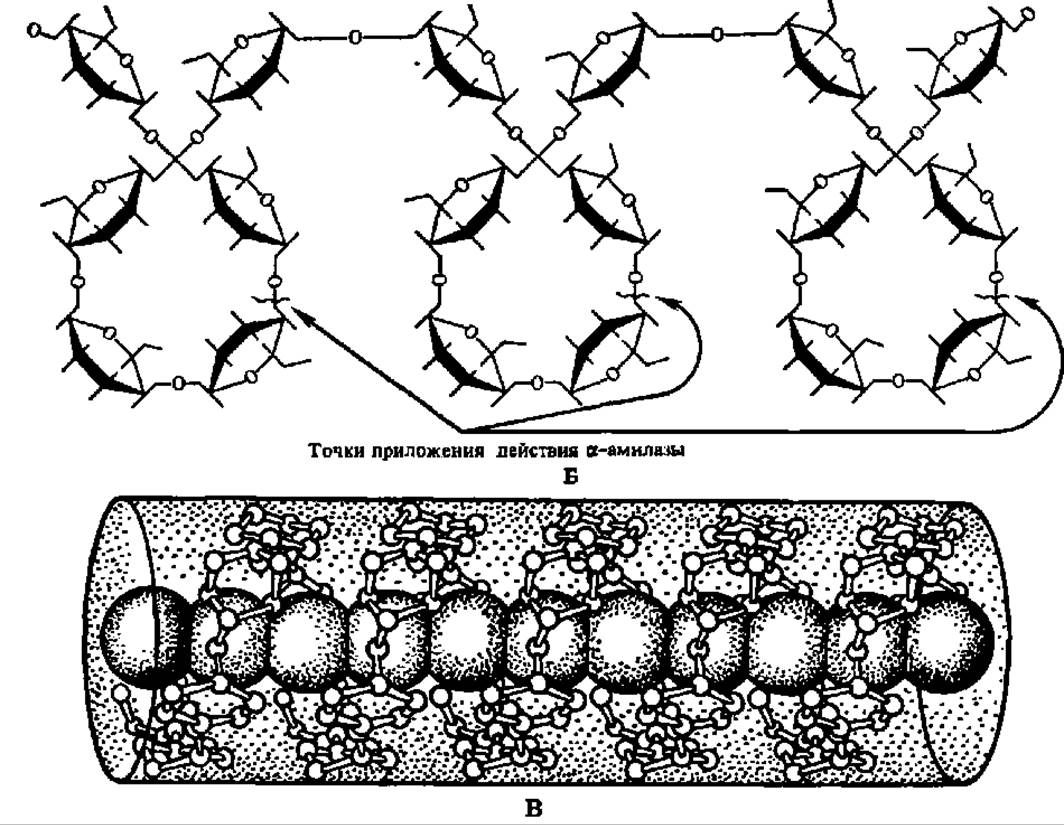
Рис. 103. Продолжение
Амилопектин имеет сферические молекулы с радиусом вращения от 82 до 255 нм. Их сферическая форма обеспечивается тем, что молекула составлена из множества (несколько сотен) коротких полигликозидных цепочек, каждая из которых в среднем содержит 20 остатков а-D-глюкопиранозы. В пределах каждой короткой цепи глюкозные остатки соединены а-1,4-глюкозидными связями. Друг с другом цепи соединяются посредством а-1,6-глюкозидных связей. Строение разветвленного участка молекулы амилопектина таково:
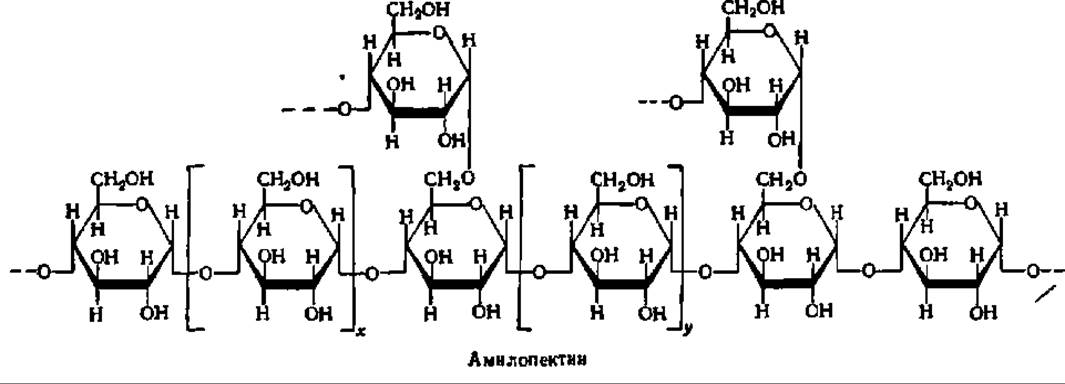
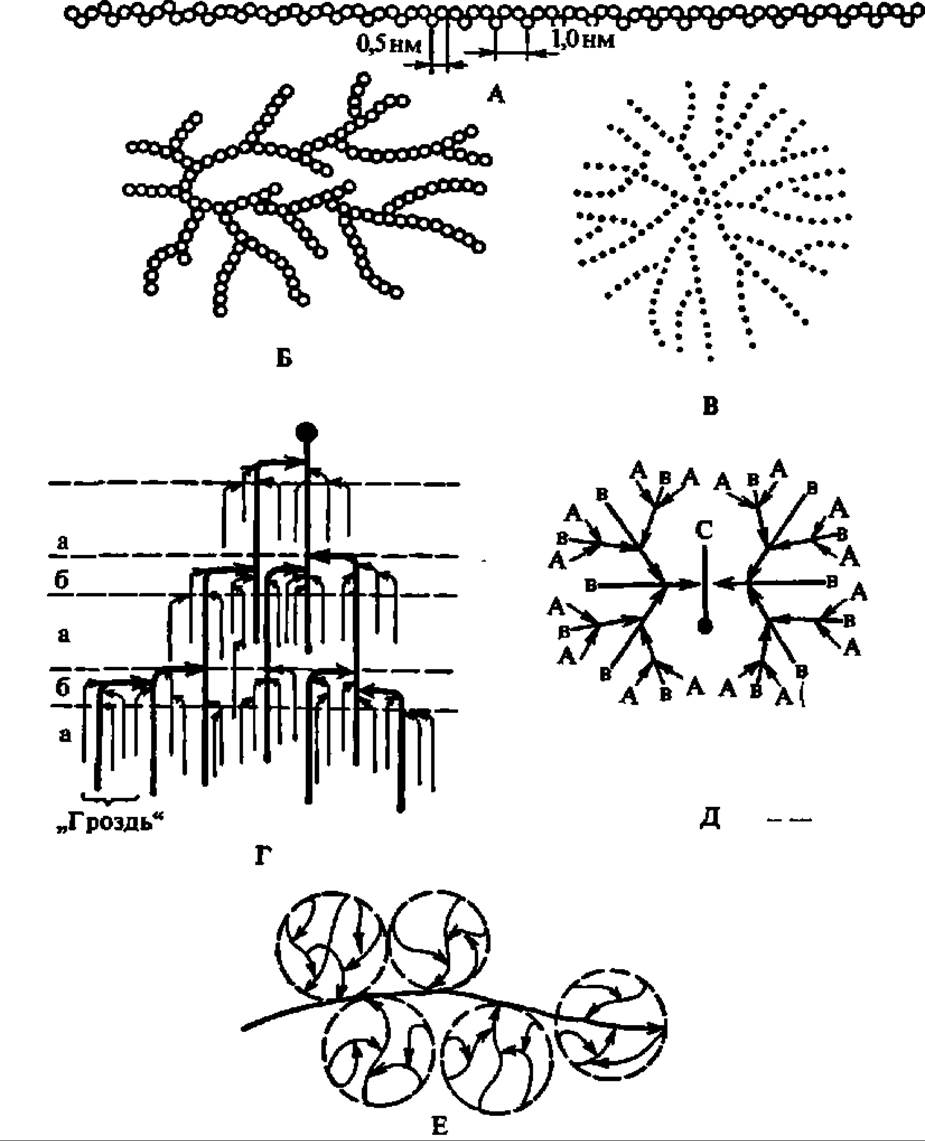
Рис. 104. Строение молекул крахмала и гликогена:
А — амилоза; Б — амилопектин; В — гликоген; каждый кружок обозначает остаток глюкозы; Г — современная гроздевидная модель молекулы амилопектина (а — компактная, псевдокристаллическая область; б — менее компактная, аморфная область; точкой обозначена редуцирующая группа); Д — модернизированная модель молекулы гликогена, демонстрирующая наличие спрятанных полигликозидных цепей; Е — строение частичкового гликогена; центральная линия — полипептидная цепь, к которой через радикалы оксиаминокислот присоединены ß-частицы, образующие а-частицу, построенную по типу сложной костянки; Ж — объемная модель фрагмента молекулы амилопектина (Р — редуцирующий конец; Н — нередуцирующие концы)
Общая структура молекулы амилопектина в соответствии с ранними данными показана на рис. 104, Б. На этом же рисунке приведена более современная модель молекулы амилопектина (Г), выведенная на основании детального исследования продуктов ферментативного гидролиза и рентгенографического анализа этого полисахарида. Она получила название гроздевидной, так как по расположению в ней полигликозидных звеньев весьма напоминает гроздь винограда. Степень полимеризации остатков a-D-глюкозы в звеньях, обозначенных утолщенными линиями, достигает 45, тонкими 15. Протяженность каждой псевдокристалли ческой области составляет 6 нм, аморфной — втрое меньшую величину.
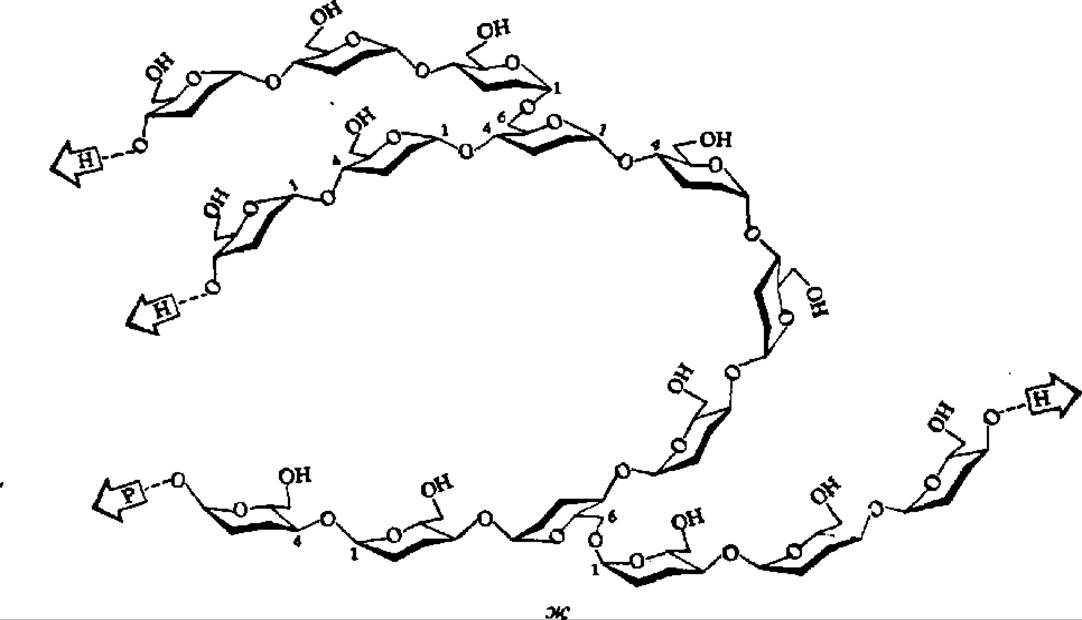
Рис. 104. Продолжение
Считают, что в составе амилопектина a-D-глюкопираноза также находится в лодкообразной конформации. Вследствие этого отдельные участки полигликозидных цепочек, составляющих молекулу амилопектина, видимо, спирализованы подобно амилозе (рис. 104, ж).
Обе фракции крахмала дают окрашивание с иодом в растворе К1, однако амилоза окрашивается в чисто синий цвет, а амилопектин — в фиолетовый. Реакция крахмала с иодом не связана с химическим взаимодействием между ними, а состоит в образовании комплексов адсорбционного типа. Так как ведущую роль в возникновении этих комплексов играют спиральные участки молекул крахмала того или другого типа, то различие в тональности окраски вполне естественно. Предполагают, что молекулы иода втягиваются внутрь полигликозидной спирали, где и замыкаются соответствующие связи, дающие начало цветным комплексам (рис. 103, в).
При кратковременном нагревании порошкообразного крахмала его гигантские молекулы распадаются, образуя смесь более простых полисахаридов меньшей молекулярной массы — декстринов. Декстринизация крахмала при нагревании сопровождается повышением его растворимости в воде. Обработанный таким образом крахмал называют растворимым. Распад молекул крахмала до декстринов особенно интенсивно идет при нагревании крахмального клейстера с 10%-ным раствором H2SO4. При дальнейшей обработке молекулярная масса декстринов прогрессивно падает и конечным продуктом распада является Р-глюкоза. Крупномолекулярные декстрины окрашиваются иодом в красный цвет, низкомолекулярные — окраски с иодом не дают. Таким образом, гидролиз крахмала проходит ступенчато и может быть выражен следующей схемой:
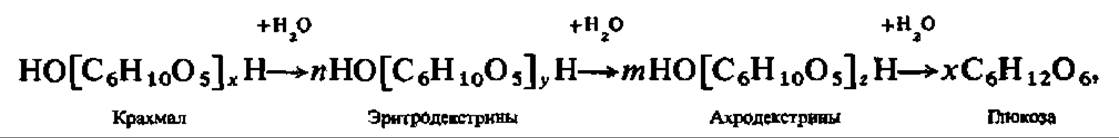
где x>y>z.
Декстринизация и осахаривание крахмала широко применяются в спиртовой промышленности, при производстве клея и т. д.
Так как крахмал составлен из оптически активных остатков а-D-глюкопиранозы, его растворы вращают плоскость поляризации света вправо ([а]D = +195°).
Пшкоген служит резервным питательным веществом в организме человека и животных, вследствие чего за ним сохраняется название «животный крахмал». Однако он найден также в грибах, дрожжах и зернах кукурузы, что ставит под сомнение его название «животный». Содержание гликогена в печени животных достигает 20%, а в мышцах — 4%. Распадаясь до простых продуктов довольно сложным путем, который называется гликогенолизом (см. с. 351), гликоген обеспечивает потребность организма в энергии и метаболитах. Таким образом, его биологическая роль весьма велика.
Гликоген сравнительно хорошо растворяется в горячей воде, хотя некоторые виды натурального гликогена труднорастворимы. Подобно крахмалу, гликоген дает цветную реакцию с иодом, причем тон окраски (красно-фиолетовый или красно-коричневый) свидетельствует о том, что гликоген ближе к амилопектину, нежели к амилозе. Действительно, гликоген и амилопектин весьма похожи. Так, молекулярная масса некоторых фракций нативного гликогена близка к молекулярной массе амилопектина, хотя в целом гликоген в этом отношении отличается крайней гетерогенностью: препараты гликогена из печени животных содержат фракции с М от 10 млн. до 3 млрд. с преобладанием среди них молекул с М от 200 млн. до 600 млн. При неполном гидролизе гликогена образуются декстрины, а при полном — D-глюкоза. Как и амилопектин, гликоген оптически активен, причем удельное вращение его растворов (+196°) весьма близко к таковому крахмала.
Причины близости свойств гликогена и амилопектина заключаются в сходстве строения их молекул: оно по существу одно и то же; различие состоит лишь в том, что в молекуле гликогена средняя длина коротких цепей, которые сочетаются здесь а-1,6-гликозидными связями, равна 12 остаткам a-D-глюкопиранозы. Таким образом, молекула гликогена несколько плотнее, компактнее, чем молекула амилопектина (см. рис. 104). Гликоген низших животных ближе к амилопектину, так что во многих случаях трудно провести резкую границу между первым и вторым, хотя накапливающиеся данные о структуре гликогена (см. рис. 104, Д и Е) - определенно свидетельствуют о большей симметричности его молекулы, о наличии в ней значительного числа спрятанных (не выходящих на поверхность молекулы) полигликозидных звеньев (это часть звеньев В на рис. 104, Д), а также о существовании у гликогена макромолекулярной структуры. Последняя характерна для так называемого частичкового гликогена, впервые выделенного А. Лазаревым (1942) в мягких условиях методом дифференциального ультрацентрифугирования. Он представлен огромными, глобулами, названными a-частицами (диаметр до 200 нм) и напоминающими ягоды шелковицы или малины. В свою очередь, а-частицы составлены из ß-частиц, а те, в свою очередь, — из у-частиц с диаметром 20—40 нм (см. рис. 104, Е).
Клетчатка — основной структурный полисахарид растений. Листья содержат 15—30% клетчатки, древесина — 50—70%, стебли волокнистых растений (например, льна) еще больше, а волокна (волоски на семенах) хлопка представляют собой почти чистую клетчатку. Само название этого полисахарида подчеркивает его большую роль в построении клеточных стенок; в связи с этим распространен также термин целлюлоза (от лат. cellula — клетка). Подсчитано, что при сжигании всей клетчатки, содержащейся в составе растений, количество СО2 в атмосфере возросло бы наполовину.
Клетчатка отличается очень малой растворимостью в подавляющем большинстве агентов; лишь аммиачный раствор Сu(ОН)2 и концентрированный раствор Ca(SCN)2 при нагревании заметно растворяют ее. Устойчивость клетчатки к действию растворителей объясняют тем, что ее длинные нитевидные молекулы, взаимодействуя друг с другом, образуют прочные мицеллы, которые, в свою очередь, собраны в фибриллы, располагающиеся вдоль оси волокна. Так, тончайшие элементарные волокна хлопка диаметром 20 нм состоят из множества молекул целлюлозы (диаметр 0,6—0,7 нм), упакованных очень плотно. Отрыв индивидуальных молекул клетчатки от упомянутых устойчивых агрегатов весьма затруднен, и только немногие вещества, способные нарушать межмолекулярные связи в мицеллах, растворяют клетчатку.
При гидролизе клетчатки в присутствии специфического фермента, найденного у ряда бактерий, некоторых видов насекомых, плесневых грибков и в прорастающих семенах, образуется целлобиоза. Однако при гидролизе в присутствии кислот почти с количественным выходом возникает ß-D-глюкопираноза; она и является основным структурным элементом молекулы целлюлозы:
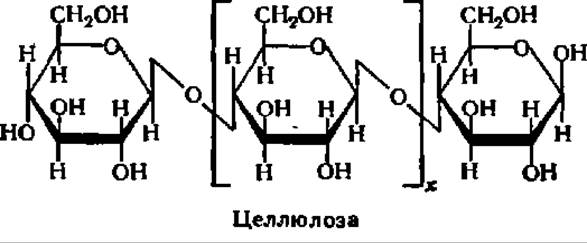
Тип связи остатков друг с другом аналогичен таковому в молекулах амилозы, но в отличие от последней клетчатка является ß-полигликозидом, так как остатки глюкозы соединены друг с другом ß-1,4-гликозидными связями. Как у амилозы, в молекулах клетчатки нет разветвлений, они построены строго линейно, но намного длиннее молекул амилозы. Число остатков D-глюкозы в молекуле клетчатки очень велико и достигает нескольких тысяч, что соответствует молекулярной массе нативной целлюлозы в 10—20 млн. Эти, на первый взгляд, небольшие отличия в строении амилозы и клетчатки приводят к резкой разнице в их свойствах.
Более глубоко различие между амилозой и клетчаткой вскрывается при сопоставлении строения упомянутых полисахаридов с учетом конформации составляющих их остатков D-глюкозы. Установлено, что ß-D-глюкопираноза в составе клетчатки находится в креслообразной конформации:
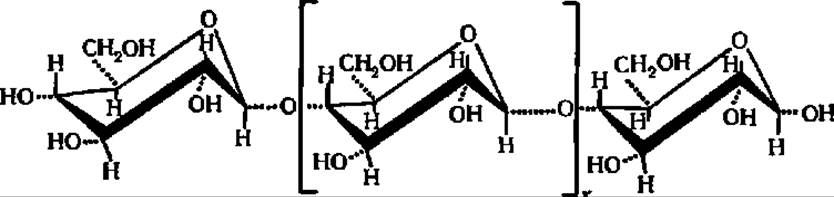
Это исключает возможность спирализации полигликозидной цепи, и молекула целлюлозы сохраняет строго линейное строение.
Раствор клетчатки в медно-аммиачном реактиве обнаруживает небольшую оптическую активность ([а]D = 3,21°).
Как и у других полисахаридов, в молекулах клетчатки остается свободным большое число спиртовых гидроксилов (при 2, 3 и 6-м углеродных атомах каждого остатка ß-D-глюкопиранозы). По этим ОН-группам возможны соответствующие химические реакции. Среди них особенно важны те, что ведут к получению производных, широко применяемых в ионообменной хроматографии для разделения аминокислот, пептидов, белков, нуклеотидов и нуклеиновых кислот. К их числу относятся карбоксиметилцеллюлоза (КМ-целлюлоза) и диэтиламиноэтилцеллюлоза (ДЕАЕ-целлюлоза).
КМ-целлюлозу получают, обрабатывая щелочную целлюлозу монохлоруксусной кислотой:

В результате целлюлоза обогащается СООН-группами, придающими ей свойства катионообменника.
ДЕАЕ-целлюлозу синтезируют, действуя на целлюлозу ß-хлорэтилдиэтил-аммоний хлоридом в щелочной среде:
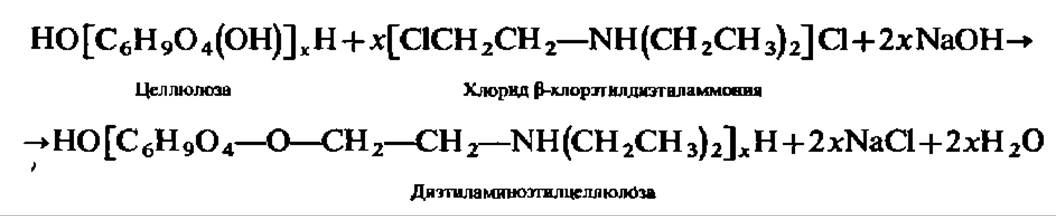
Диэтиламиноэтил-группировки придают ДЕАЕ-целлюлозе свойства анионообменника.
Декстрин — полисахарид, продуцируемый некоторыми видами бактерий. Молекулярная масса его огромна: различные препараты декстрана обнаруживают значения М от 12 млн. до 1 млрд. Молекула декстрана состоит из сравнительно коротких полигликозидных цепочек по 10—12 остатков a-D-глюкопиранозы в каждой. Остатки a-D-глюкозы в них (см. с. 31) соединены а-1,6-гликозидными связями, a между собой цепи соединяются дополнительными 1,4-гликозидными связями. При обработке декстрана эпихлоргидрином получают сефадексы — материалы, отличающиеся сетчатой структурой, прекрасно набухающие и используемые в качестве молекулярных сит.
Хитин — главная составная часть покровных тканей насекомых и ракообразных. Этот полисахарид широко распространен в природе; подсчитано, что только крабы ежегодно синтезируют 1 млн. т хитина. Будучи освобожден от белков или СаСО3, в комплексе с которыми он участвует в построении покровных тканей упомянутых животных, хитин представляет белое вещество, напоминающее бумажную массу. Хитин отличается очень плохой растворимостью, и только муравьиная кислота и насыщенные растворы некоторых солей способны перевести его в частично растворенное состояние. Видимо, поэтому до сих пор не получено точных данных о молекулярной массе хитина.
Элементарной структурной единицей хитина является N-ацетил-ß-D-глюкозамин, соединенный ß-1,4-гликозидными связями в линейную молекулу:
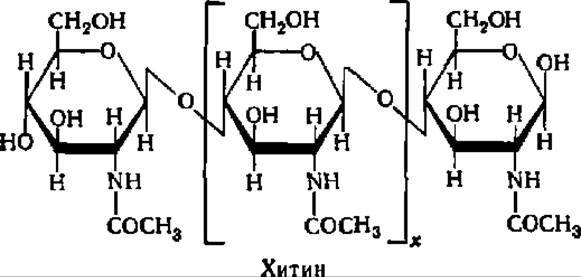
Структура хитана, как можно видеть из приведенной выше формулы, весьма напоминает таковую целлюлозы. Рентгенограммы этих двух полисахаридов очень похожи.
Гиалуроновая кислота — важнейшая составная часть межклеточного вещества тканей животных. Особенно высоко ее содержание в коже, стекловидном теле глаза, сухожилиях и т. п. Гиалуроновую кислоту можно получить из указанных тканей путем экстракции разбавленными щелочами, трихлоруксусной кислотой или фенолом. После осаждения из экстракта спиртом гиалуроновую кислоту освобождают от прочно связанного с ней белка перевариванием последнего ферментами.
Молекулярная масса гиалуроново-белкового комплекса достигает нескольких миллионов. Однако препараты гиалуроновой кислоты отличаются сравнительно низкими значениями молекулярных масс (270000—500000). Видимо, в процессе выделения происходит деградация молекул гиалуроновой кислоты.
Являясь гетерополисахаридом, гиалуроновая кислота содержит в своем составе две различные структурные единицы — N-ацетил-Р-О-глюкозамин и ß-D-глюкуроновую кислоту в отношении 1:1. Они соединены друг с другом попеременно ß-1,3- и ß-1,4-гликозидными связями:
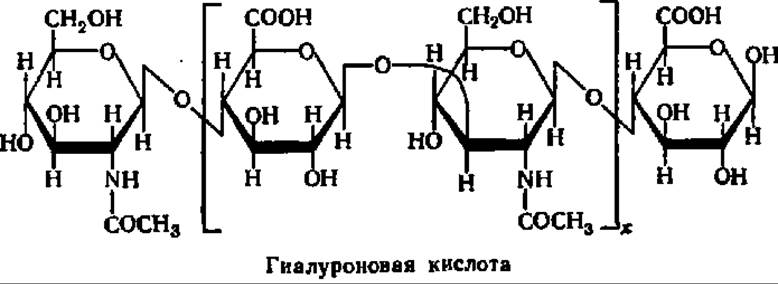
Гиалуроновой кислоте в тканях животных присущи не только структурные функции. Пронизывая ткани в качестве межклеточного вещества, гиалуроновая кислота регулирует поступление в клетки тех соединений, которые или нужны для жизнедеятельности клетки, или являются ее продуктом. Эта функция гиалуроновой кислоты в значительной степени осуществляется при участии фермента — гиалуронидазы, свойства которой интенсивно изучаются.
Хондроитинсульфат — непременная составная часть хряща, костной ткани, сухожилий, сердечных клапанов и других подобных тканей животных. Содержание его, например, в хряще носовой перегородки составляет 20—40%.
Хондроитинсульфат выделить в чистом виде трудно, так как он прочно связан с белком — коллагеном. Вероятно, при выделении идет сильная деградация молекул хондроитинсульфата, так как молекулярная масса его препаратов не превышает 50 000, тогда как М его комплекса с белком составляет от 4 до 50 млн.
В виде очищенного препарата хондроитинсульфат представляет собой белое вещество, распадающееся при гидролизе до глюкуроновой кислоты и N-ацетилгалактозаминсульфата, которые соединены друг с другом ß-1,3- и β-1,4-гликозидными связями, аналогичными связям в гиалуроновой кислоте:
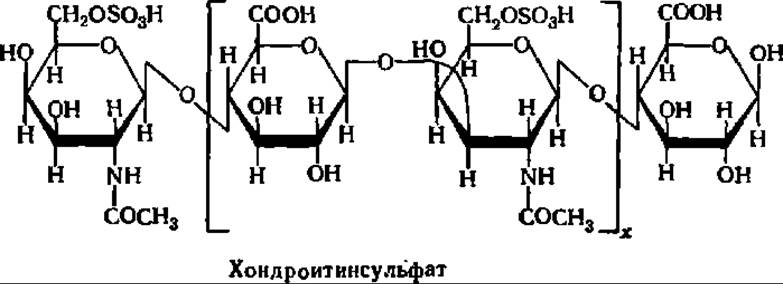
Сульфогруппа, связанная с остатком N-ацетилгалактозамина в хондроитинсульфате, может занимать также 4-е положение. Эту разновидность хондроитинсульфата обозначают как хондроитинсульфат А. Есть и другие виды хондроитинсульфатов, отличающиеся от указанных выше форм некоторыми деталями строения.
Гeпарии —специфический гетерополисахарид, препятствующий свертыванию крови у животных и человека. Он обладает также антилипемическим, антимитотическим и регуляторным по отношению к ряду ферментов действием. Гепарин содержится в печени (до 100 мг/кг ткани), легких, селезенке, щитовидной железе, крови и, вероятно, в других тканях и органах; он получен в кристаллическом состоянии. Молекулярная масса гепарина, выделенного из разных объектов, колеблется от 4000 до 20000. Определения молекулярной массы гепарина из разных объектов гравиметрическим, вискозометрическим и гельфильтрационным методами дали более узкие ее пределы: 11000—12900. Молекула гепарина состоит из остатков глюкуроновой кислоты и a-глюкозамина в виде двойного производного серной кислоты:
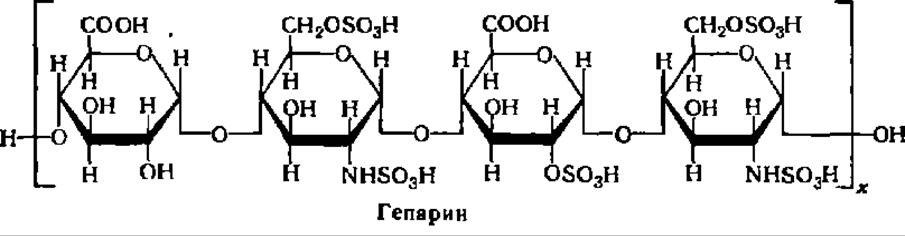
Под действием ряда ферментов (гепариназа, дисахаридсульфоэстераза, сульфамидаза, сульфоэстераза и др.) гепарин распадается до составляющих его структурных элементов и продуктов их деградации, т. е. в конечном счете до глюкуроновой кислоты и глюкозамина. Период полураспада гепарина в организме кроликов составляет 17,5 + 6,5 мин, собак — 34 + 13,5 мин.
В настоящее время широко развернулись работы по выделению, очистке и изучению состава, строения и функций ряда других гомо- и гетерополисахаридов. К их числу относятся гемицеллюлозы, пектиновые вещества, глюкоманнаны и галактоманнаны высших растений, полисахариды водорослей (агар, каррагинаны, альгиновые кислоты, галактаны, маннаны, ламинарии и др.), внеклеточные (ксантан, пуллулан и др.) и капсулярные полисахариды бактерии и, наконец, полисахариды простейших (парамилон и др.). Как химия, так и особенно биохимия многих из них представляет большой интерес.