Основы биохимии - Филиппович Ю. Б. 1999
Взаимосвязь и регуляция обмена веществ
Регуляция обмена веществ
Приведенные выше данные о взаимосвязи и взаимозависимости обмена белков, нуклеиновых кислот, углеводов и липидов убеждают в том, что обмен веществ представляет собой стройный ансамбль многочисленных и тесно увязанных друг с другом химических процессов. Ведущая роль в этом бесчисленном множестве взаимодействий принадлежит белковым телам. Благодаря их каталитической функции осуществляется все это великое множество химических процессов распада и синтеза. С помощью нуклеиновых кислот поддерживается строгая специфичность при биосинтезе макромолекул, т. е. в конечном счете видовая специфичность в строении важнейших биополимеров. Благодаря обмену углеводов и липидов в организме постоянно возобновляются запасы АТФ — универсального донора энергии для химических преобразований. Эти же вещества поставляют простейшие органические молекулы, из которых строятся биополимеры и другие соединения. В результате совершается непрерывный процесе самообновления живой материи, обслуживаемый теми биохимическими механизмами, изучение которых составляет предмет общей биохимии.
Слаженность биохимических превращений, их теснейшая связь и взаимообусловленность, возможность быстрой мобилизации одних соединений для синтеза других, возможность взаимопереходов от одного класса органических соединений к другому, всеобщая соподчиненность биохимических механизмов как никогда ярко выступают, когда мы оцениваем обмен веществ в целом. Общий ход биохимических процессов в организме, регулируемый внутренними и внешними факторами, представляет единое неразрывное целое, и сам организм в этом смысле выглядит как самонастраивающаяся, саморегулирующаяся система, поддерживающая свое собственное существование путем обмена веществ.
Тем не менее, исходя из методических соображений, регуляцию жизненных процессов принято рассматривать на метаболитном, оперонном, клеточном, организменном и популяционном уровнях. Каждый из них характеризуется своими закономерностями регуляции обмена вещества, действующими в снятом виде на каждом последующем уровне организации живой материи. Характерно, что чем выше уровень регуляции обмена веществ, тем яснее выступает иерархическая, блочная система управления, суть которой сводится к слежению за поступлением сигнала и ответом на него.
Метаболитный уровень регуляции. Слаженность обмена веществ в организме, в значительной мере, определяется концентрацией разнообразных метаболитов — низкомолекулярных соединений, представляющих собой продукты тех или иных химических превращений в биологических объектах или поступающих в них в процессе питания.
Формы регуляции обмена веществ при участии метаболитов крайне многообразны. Простейшая из них сводится к ускорению или замедлению биохимических процессов за счет недостатка или избытка тех соединений, которые являются участниками соответствующих реакций. Так, объем белкового синтеза у гетеротрофов лимитируется поступлением незаменимых аминокислот и интенсивностью синтеза полузаменимых аминокислот. На этом, в частности, базируется микробиологический метод количественного определения содержания аминокислот в белковых гидролизатах и иных средах.
Более сложный характер носит регуляция обмена веществ за счет конкурентных взаимоотношений тех обменных процессов, которые замыкаются на общие метаболиты, относящиеся, как правило, к категории ключевых: пировиноградную, щевелевоуксусную и а-кетоглутаровую кислоты, ацетил-КоА, глюкозо-6-фосфат. Многочисленные примеры такого рода приведены в разделе о взаимосвязи обмена веществ в начале этой главы.
Несомненно, велика роль в регуляции обменных процессов ряда низкомолекулярных соединений, относящихся к разряду биологически активных, — витаминов, антивитаминов, коферментов, гормонов, антигормонов, вторичных посредников и др.
Метаболиты, взаимодействуя с ферментами, способны активировать или ингибировать их активность; примером первого рода является неоднократно упоминавшееся активирование протеинкиназ при действии на них цАМФ; не меньшую роль в регуляции обмена веществ играет другой вторичный посредник — цГМФ, активирующий фосфолипазу А2 и С, а также участвующий в биосинтезе простагландинов из арахидоновой кислоты. Источником новой группы вторичных посредников, как показано недавно, являются фосфоинозитиды (см. с. 384):
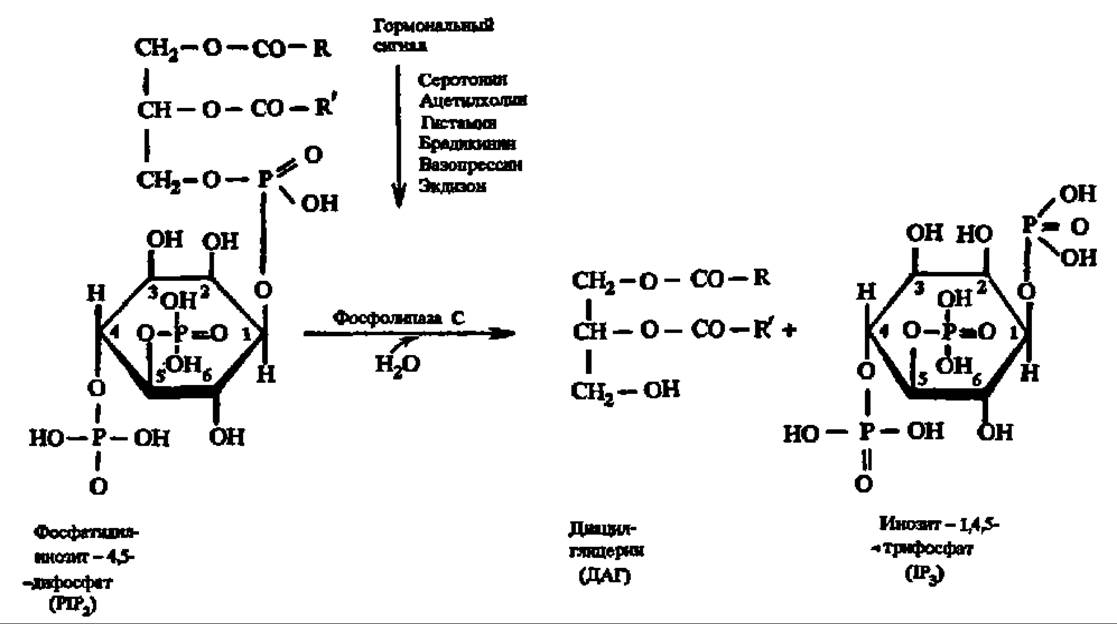
Гормональный сигнал воспринимается рецептором, передающим его G-белку, который активирует фосфолипазу С. И диацилглицерин, и инозит-1,4,5-трифосфат являются вторичными посредниками, передающими гормональный сигнал далее: первый — протеинкиназе С (М = 67—83 кДа, активируется Са2+, переносит фосфат с АТФ на радикалы серина и треонина, насчитывает не менее 7 форм — а, ßI, ßII, у, δ, ε, ζ, фосфорилирующей около 20 ферментов и ряд белков (белки цитоскелета, белки-рецепторы и др.), а второй — в эндоплазматический ретикулум, из которого высвобождается Са2+, возбуждающий активность Са2+/кальмодулин-зависимой протеинкиназы, тоже обеспечивающей фосфорилирование функционально значимых белков (рис. 139). К числу вторичных посредников относится также оксид азота (NO)—мощный фактор гомеостаза. Он образуется в различных клетках и тканях, в том числе и в тромбоцитах человека из L-аргинина за счет окисления азота аминогруппы гуанидиновой группировки последнего под действием L-аргинин-NО-синтазы. Она существует в трех формах, две из которых являются конституивными, а одна—индуцибельной, причем в индукцию экспрессии гена последней вовлекаются липополисахариды и ядерный белковый фактор. Возникший так оксид азота активирует гуанилатциклазу, что приводит к повышению концентрации цГМФ, функции которого в регуляции обмена веществ отмечены выше (см. предыдущую стр.). Кроме того, непосредственно сам оксид азота является нейротрансмиттером и цитотоксическим агентом.
Примером второго рода является ретроингибирование (ингибирование по принципу обратной связи) активности фермента, стоящего в начале многоступенчатого превращения субстрата конечным продуктом реакции, что детально разработано при изучении регуляции биосинтеза пиримидиновых нуклеотидов (см. с. 239):
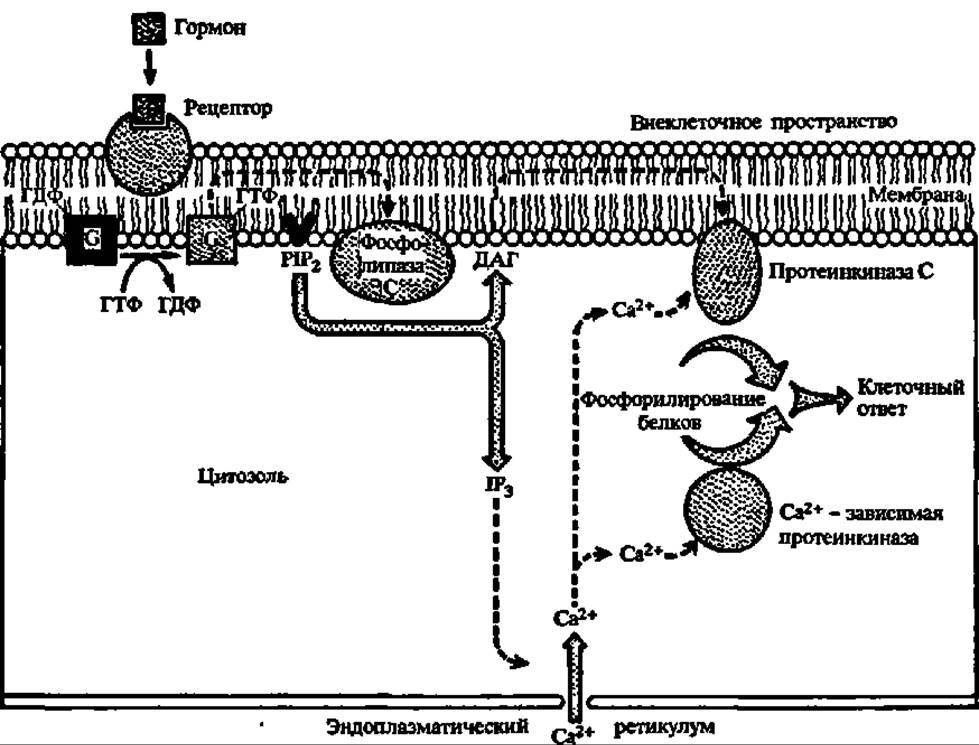
Рис. 139. Фосфоинозитидный путь регуляции обмена веществ (пояснения в тексте)
Явления такого же порядка происходят во многих других случаях аллостерического изменения активности ферментов. Вместе с тем метаболиты могут быть и изостерическими (конкурентными) ингибиторами ферментов (см. с. 112). Высказано предположение, что метаболоны (см. с. 355) регулируются сигналами, передаваемыми через вторичные посредники; так, например, считают, что гликолитический метаболой регулируется потоком ионов Са, поступающих в микрокомпартменты клетки, где он локализован. Наконец, метаболиты являются индукторами и корепрессорами в системах, действующих на оперонном уровне регуляции обмена веществ.
Оперонный уровень регуляции. Оперонам называется упорядоченная компактная совокупность цистронов (вместе со знаками начала и конца), считываемая как единое целое в процессе синтеза мРНК на ДНК. В случае моноцистронного оперона на нем синтезируется мРНК, предназначенная для биосинтеза в рибосомальном аппарате клетки одного единственного белка, в случае полицистронного (до полутора десятков цистронов) — ряд мРНК, на которых рибосомальным путем создается семейство различных белков (чаще всего ферментов), необходимых для осуществления многостадийного биохимического процесса в клетке. Первичное представление о моноцистронном опероне, равно как и о знаках начала и конца его считывания, дает рис. 87 на с. 259.
Сейчас ясно, что на уровне оперона регулируется главным образом объем биосинтеза ферментов за счет изменения количества молекул мРНК, возникающих в процессе транскрипции. Это оказывает решающее влияние на ход обменных процессов, мощными двигателями которых являются ферменты. Вместе с тем нельзя упускать из виду и то обстоятельство, что на уровне оперона регулируется синтез мРНК для новообразования гистонов, негистоновых и рибосомальных белков, а также ряда других протеинов, не обладающих каталитической активностью, но являющихся регуляторами метаболической активности генома, деятельности трансляционного аппарата клетки и других фундаментальных процессов обмена веществ.
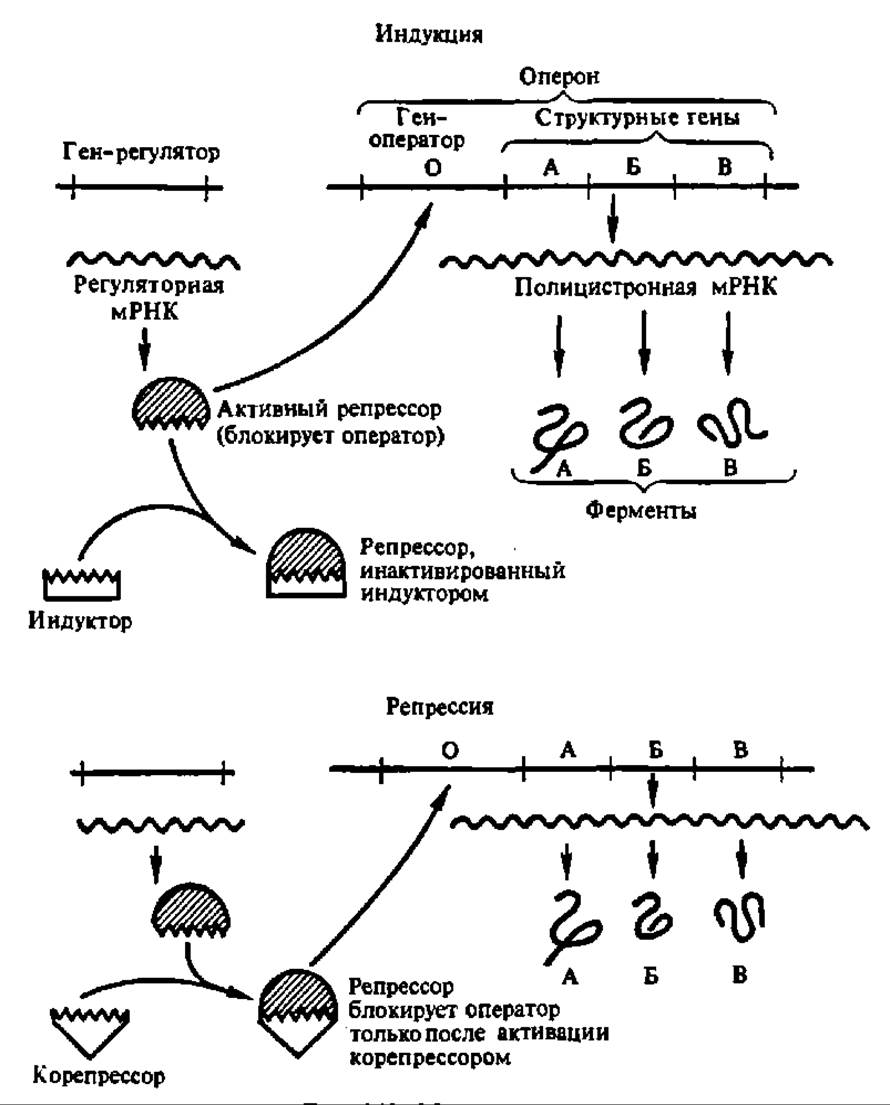
Рис. 140. Модель оперона
Если рассмотреть несколько детальнее регуляцию на оперонном уровне объема биосинтеза ферментов в клетке, то вырисовываются два пути: индукция и репрессия. Сущность и того и другого ясна из рассмотрения рис. 140. Биосинтез фермента может быть индуцирован низкомолекулярным метаболитом — индуктором, который, соединяясь с репрессорным белком (он запрещает транскрипцию), освобождает зону оператора (знак начала оперона), что сопровождается присоединением РНК-полимеразы и началом синтеза про-мРНК, а затем, после ее посттранскрипционной модификации, — фермента.
Ферменты, биосинтез которых регулируется этим путем, называются индуцибельными. К ним относятся ß-галактозидаза, рибулокиназа, тирозиназа, аспарагиназа и многие другие. Добавление индуктора (как правило, субстрата индуцибельного фермента) резко повышает объем синтеза фермента. Например, при добавлении ß-галактозида (лактоза) в культуральную среду кишечной палочки у последней синтез ß-галактозидазы возрастает в 10000 раз. В отличие от этого ферменты, биосинтез которых стопорится под влиянием низкомолекулярного метаболита — корепрессора (рис. 140) (переводит репрессорный белок, не способный в норме оккупировать зону оператора, в активное состояние), называются репрессибельными. К их числу принадлежат орнитин-карбамилтрансфераза (ее корепрессор — аргинин), глутаминсинтетаза, уреаза (их корепрессор — NH4) и ряд других.
В последнее время показано, что индукция и репрессия могут быть генерализованными, т. е. контролироваться не каким-либо одним конкретным индуктором или корепрессором, а целой группой сходных с тем и другим соединений. Накапливаются также сведения о том, что один-единственный эффектор (например, ppGpp — 3'-пирофосфо-гуанозин-5'-дифосфат) может индуцировать биосинтез целого семейства ферментов (например, ферментов биосинтеза гистидина и ряда других аминокислот). Поэтому проблема индукции и репрессии биосинтеза ферментов достаточно сложна, особенно в отношении индукции синтеза ферментов, не свойственных данному организму (например, ферменты детоксикации инсектицидов у насекомых).
Конечно, только индукцией и репрессией синтеза ферментов не исчерпывается регуляция обмена веществ на уровне генетического аппарата клетки. Как репликация самой ДНК, так и синтез на ней в качестве матрицы разнообразных РНК, в том числе и мРНК, что, в значительной мере, предопределяет ход обмена веществ в клетке, зависит от множества других событий. Среди них — метилирование ДНК; фосфорилирование и ацетилирование гистонов и негистоновых белков, входящих в состав хроматина; взаимодействие с хроматином гормон-рецепторных комплексов; аденилирование белков, участвующих в деятельности репликационного аппарата и др. Все они связаны с изменением метаболической активности генома, регуляцией его функций в целом.
Клеточный уровень регуляции. К регуляторным процессам на уровне клетки относятся: ядерно-цитоплазменные отношения; посттранскрипционная и посттрансляционная модификация макромолекул; транспорт веществ через мембраны субклеточных частиц и мембраны эндоплазматической сети; макромолекулярные (белок-белковые, белково-нуклеиновые, углеводно-белковые и липидбелковые) взаимодействия и др. Все они носят фундаментальный характер в регуляции обмена веществ.
Ядерно-цитоплазменные отношения сводятся к взаимозависимому контролю синтеза важнейших функционально активных биополимеров. Так, малые белковые субъединицы рибулозо-1,5-дифосфат-кар6оксилазы, при посредстве которой осуществляется важнейший процесс акцептирования СO2 в растительной клетке (см. с. 360), синтезируются в цитоплазме, а большие субъединицы — в хлоропластах. Биосинтез первых контролируется, следовательно, ядерным аппаратом клетки, вторых — хлоропластным геномом, локализованным в цитоплазме. В целом, из 800—1000 белков, необходимых для функционирования хлоропластов, лишь около 15% кодируется геномом этих клеточных органелл. Кроме рибулозо-1,5-дифосфат-карбоксилазы, при участии двух генетических систем растительной клетки (ядерной и хлоропластной) формируются тилакоидные мембраны, АТФазный и РНК-полимеразный комплексы хлоропластов. Аналогичный ядерно-цитоплазматический контроль характерен также для синтеза белковых субъединиц таких важнейших каталитически активных систем, как протонная АТФаза и цитохромоксидаза, белков внутренней и внешней мембран митохондрий, белков хлоропластных и митохондриальных рибосом и т. п. Таким образом, только при согласованной деятельности генома ядра и геномов митохондрий, хлоропластов и других субклеточных структур, при согласованной работе белоксинтезирующих систем перечисленных субклеточных частиц возникают сложные белково-ферментные комплексы клетки, обеспечивающие фундаментальные направления обмена веществ.
Посттранскрипционная и посттрансляционная модификация макромолекул — второй важнейший регуляторный процесс на клеточном уровне. Возникающие при транскрипции предшественники рибонуклеиновых кислот после ряда преобразований (метилирование, отщепление и присоединение олигонуклеотидных фрагментов и т. п.) превращаются в функционально активные РНК. Эти процессы детально изучены при созревании мРНК, рРНК, тРНК (см. гл. VI). В целом они предопределяют интенсивность белкового синтеза в клетке. Однако и белки, образующиеся при рибосомальном синтезе, тоже подвергаются посттрансляционной модификации (метилирование, отщепление пептидных фрагментов, присоединение углеводной составляющей при биосинтезе гликопротеинов и т. п.). В результате из полипептидов-предшественников получаются активные ферменты, гормоны, биологически активные пептиды и др. Естественно, что от уровня посттрансляционной модификации прямо или опосредованно зависят многие обменные процессы в клетке.
В последние годы особое значение придают ковалентной модификации ферментов, так как по этому принципу регулируется активность не менее 100 из них. Кроме фосфорилирования по радикалам серина, треонина и тирозина соответствующими протеинкиназами (см. гл. IX, XII) большая роль принадлежит аденилированию и уридилированию, а также АДФ-рибозилированию ферментов.
Аденилирование и уридилирование, например, детально изучено Е. Стедманом у глутаминсинтетазы:
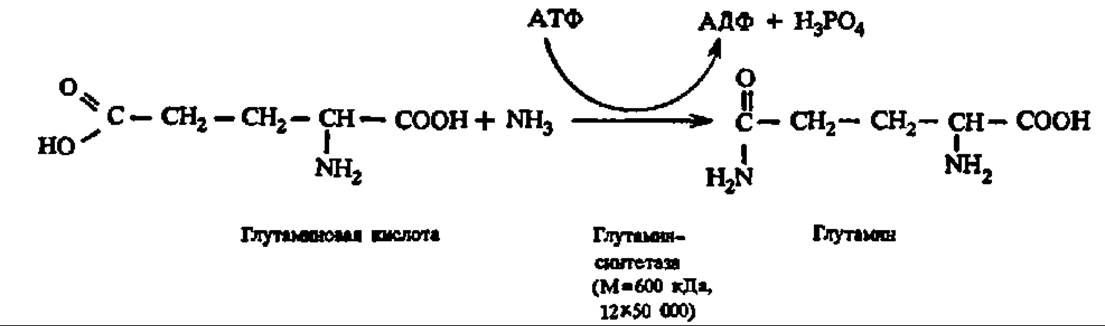
Активна в биосинтезе глутамина деаденилированная глутаминсинтетаза; по мере присоединения к каждой из ее 12 субъединиц остатков адениловой кислоты (при этом возможно существование 382 форм фермента) активность ее падает. Аденилирование идет по радикалу тирозина:
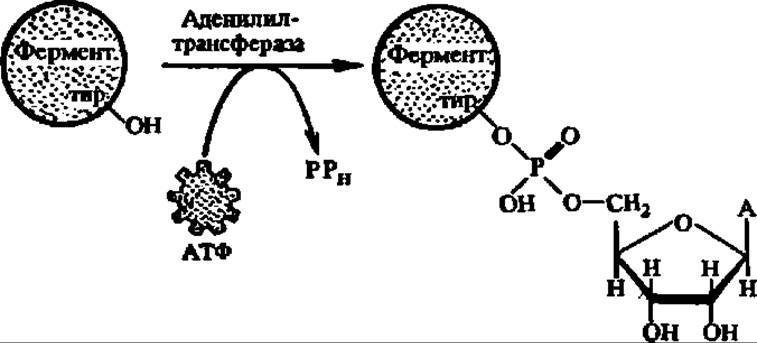
В свою очередь, аденилилтрансфераза активна лишь в том случае, когда она связана с регуляторным белком, не уридилированным по остатку тирозина; если же регуляторный белок уридилирован (реакция идет аналогично аденилированию, но с УТФ в качестве донора уридилатного остатка), то аденилилтрансфераза ускоряет реакцию деаденилирования глутаминсинтетазы и переводит ее снова в более активное состояние.
В случае АДФ-рибозилирования на гуанидиновый фрагмент радикала аргинина фермента (или H2N-гpyппy лизина или аспарагина) переносится остаток АДФ-рибозы из состава НАД+; при этом высвобождается молекула никотинамида. Эту реакцию ускоряет НАД+-аза, обладающая АДФ-рибозилтрансферазной активностью:
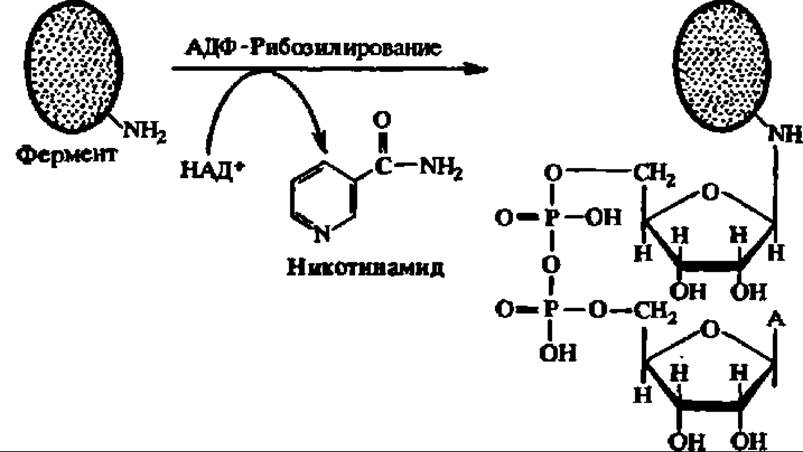
К посттрансляционной модификации белков тесно примыкает протеолитическая деградация белков, особенно ферментов. Благодаря ей в клетке непрерывно идет противоборство двух процессов — распада ферментов и их синтеза, определяющее в конечном итоге количество того или иного фермента и ход ускоряемой им реакции.
Посттрансляционная модификация является источником возникновения множественных форм ферментов в клетке, как, например, в случае глутаминсинтетазы. Наряду с генетически детерминированными изоферментами они обеспечивают тончайшие нюансы в регуляции обменных процессов, так как каждый из них подобен отдельному инструменту в оркестре, звучание которого составляет симфонию жизни. В последнее время также активно разрабатывают проблему контроля транскрипции ядерного и митохондриального генома продуктами цитоплазмы у животных и растений.
Перенос веществ через мембраны ядра, митохондрий, лизосом, эндоплазматической сети и других субклеточных элементов, равно как и через клеточную оболочку, — один из существенных механизмов регуляции обмена веществ и многих физиологических функций организма на клеточном уровне. В переносе ионов ведущая роль принадлежит циклическим пептидам и депсипептидам, низкомолекулярных веществ — специальным ферментам (транслоказам) (см. рис. 43), высокомолекулярных соединений, в частности белков, — сигнальным пептидам и их взаимодействию с белково-липидной частью мембран. Недавно обнаружена и изучена особая категория белков, названных поринами: они образуют в мембранах поры и активно переносят по ним различные соединения (см. рис. 101 и 102).
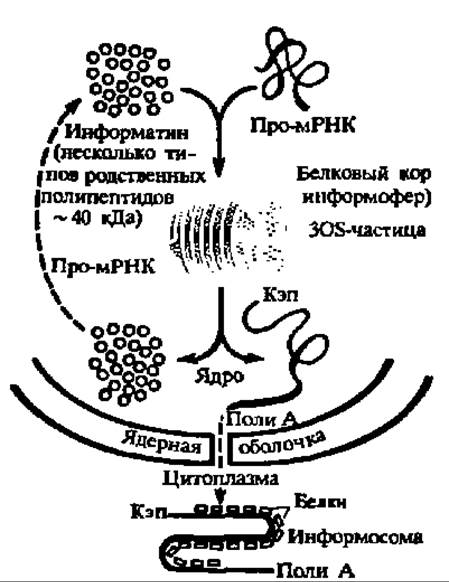
Рис. 141. Белково-нуклеиновые взаимодействия при созревании и переносе мРНК
Изучению процесса транспорта веществ уделяется все большее внимание в мембранологии. В конечном итоге поступление метаболитов внутрь субклеточных частиц и компартментов клетки, равно как и вынос их оттуда самым непосредственным образом, сказывается на скорости биохимических превращений. Конечно, проблема пространственного разобщения обменных реакций в клетке не сводится только к созданию градиентов концентрации метаболитов. Сейчас привлечено внимание к существованию связанных с субклеточными частицами ферментов, причем в этом случае их активность значительно возрастает («адсорбционный механизм» регуляции ферментов, сопровождаемый эстафетной передачей промежуточных продуктов каталитического процесса).
Роль макромолекулярных взаимодействий в регуляции обмена веществ на клеточном уровне особенно отчетливо выявилась при изучении белково-нуклеиновых взаимодействий. Оказалось, что про-мРНК, синтезируемые в ядре, сначала соединяются с ядерными белками (информагинами), причем уже здесь идет отбор про-мРНК: лишь часть из них превращается в рибонуклеопротеины (308-частицы и их ансамбли), а остальные, несущественные в данный момент для метаболических потребностей клетки, разрушаются. В составе 308-частиц про-мРНК созревают и транслоцируются через ядерную оболочку, теряя при этом белковую часть. Однако в момент выхода в цитоплазму мРНК снова соединяются с обладающими высоким сродством к ним цитоплазматическими белками, образуя информосомы. В составе последних мРНК сохраняются в латентном состоянии вплоть до поступления в рибосомы. Вполне понятно, что рассмотренный каскадный механизм переноса информации из ядра и цитоплазму самым существенным образом сказывается на ходе обмена веществ (рис. 141). Исследования в этой области, проведенные у нас под руководством академиков Г. П. Георгиева и А. С. Спирина, удостоены Государственной премии СССР. Разнообразные и важные для регуляции обменных процессов белково-нуклеиновые взаимодействия идут на уровне генетического и рибосомного аппарата клетки.
В течение последнего десятилетия получены принципиально новые данные о контроле обмена веществ на уровне белково-нуклеиновых взаимодействий. Обнаружено, что основная роль универсальной и наиболее изученной протеинкиназы эукариотических клеток, а именно — казеинкиназы типа II, состоит в регуляции степени маскирования — демаскирования-мРНК взаимодействующими с ней белками. При этом молекулам как самой мРНК, так и особому классу иных РНК отводится роль регулятора активности протеинкиназы: чем сильнее фосфорилированы РНК-связывающие белки, тем ниже их сродство к мРНК и тем выше ее способность включаться в трансляционные процессы.
Не менее впечатляющие результаты получены при изучении липид-белковых взаимодействий. Для регуляции обмена веществ особенно важны те из них, что развертываются в составе белково-липидных мембран клетки. Именно они предопределяют уровень активности мембранно-связанных ферментов, степень проницаемости мембран для метаболитов, возможность трансмембранного переноса макромолекул и осуществления ряда других процессов, зависящих от физико-химических параметров мембранного аппарата.
Изучение углеводно-белковых взаимодействий открыло новую страницу в развитии представлений о специфических контактах на уровне макромолекул, субклеточных частиц и клеток. Они основаны на существовании белков (лектинов), избирательно узнающих углеводные компоненты, что инициирует процессы, имеющие важнейшее значение для регуляции метаболиза.
Что касается белок-белковых взаимодействий, то их значение для регуляции обмена веществ на клеточном уровне наиболее существенно. Они сводятся к становлению ферментов-мультимеров, образованию мультиэнзимных комплексов, формированию ансамблей ферментов и метаболонов, возникновению гормон-рецепторных комплексов в случае гормонов пептидной и белковой природы. Соответствующие конкретные примеры рассмотрены ранее.
До недавнего времени практически не было данных по биологически значимому углевод — углеводному взаимодействию. Сейчас ситуация диаметрально противоположна. Открыты закономерности межклеточной адгезии, опосредуемой или инициируемой углевод-углеводным узнаванием, причем последнее является быстрым первичным процессом, предваряющим белокбелковую адгезию. Установлены особенности контактов мембранного аппарата, где высока плотность встроенных гликолипидов, получены поразительные данные о функциональной роли и регуляционных потенциях последних.
Организменный уровень регуляции. Главный механизм регуляции обмена веществ на уровне организма — гормональный (см. гл. XII). Осуществляясь гуморальным путем у животных и через системы проводящих путей у растений, он, в свою очередь, направляется сигналами нервной системы у первых и внешней среды — у вторых. Таким образом, здесь осуществляется естественный и логический переход из области биохимии в сферу физиологии.
Популяционный уровень регуляции. Так же, как и предыдущий, этот уровень регуляции лежит на грани биохимии и физиологии, постепенно перерастая в новую науку — химическую экологию. Поэтому сейчас логичнее говорить об уровне регуляции метаболизма в экосистемах, имея в виду глобальные аспекты химических взаимодействий в живой природе. Суть его сводится к мощному влиянию химических соединений, вырабатываемых и выделяемых одними особями, на обмен веществ и поведенческие реакции других особей. Оно реализуется через рецепторные системы или ткани-мишени организма реципиента. Выше (см. гл. IV) приведены соответствующие примеры, касающиеся антибиотиков и телергонов. Однако перечень веществ, участвующих в химических внутри- и межвидовых взаимодействиях особей, гораздо более широк и непрерывно возрастает. Среди них: фитонциды — антибактериальные вещества, вырабатываемые здоровыми растениями (важную роль в их исследовании сыграли работы Б. П. Токина и его учеников); фитоалексины — защитные соединения, образующиеся в растениях в ответ на бактериальное или грибковое заражение; новые виды антибиотиков, фитогормонов, нейрогормонов и т. п. Их всестороннее изучение, глубокое раскрытие сути и механизмов существующих в природе биохимических связей крайне существенно для разработки экологической стратегии, столь необходимой человечеству в наше время.