Основы биохимии - Филиппович Ю. Б. 1999
Квантово-механические аспекты биохимии
При рассмотрении строения и свойств ряда соединений, а также некоторых биохимических процессов в предыдущих главах сделана попытка привлечь квантово-механические представления к объяснению ряда явлений и закономерностей. В частности, такой подход использован при описании пептидной связи (зависимость ее свойств от делокализации и сопряжения электронов) и вторичной структуры белка (вклад п-электронов в поддержание а-спиральной конформации) (см. гл. II), механизма действия пиридоксалевых ферментов (смещение электронной плотности в фермент-субстратном комплексе — см. гл. III), природы цис-транс-изомерных превращений ретиналя (зависимость этого явления от значений порядка связей в сопряженной системе), структуры и свойств тиаминпирофосфата (причина повышенной электронной плотности у 2-го углеродного атома тиазольного цикла) и повышенной реакционной способности изоаллоксазина в 1-м и 10-м положениях (у них максимальны индексы свободных валентностей) (см. гл. IV), при обсуждении вопроса о сущности жизни, при изучении природы макроэргических связей (неустойчивость системы сопряжения электронов) (см. гл. V), структуры и свойств пиримидиновых и пуриновых оснований (зависимость между порядком связи и реакциями присоединения), стэкингвзаимодействий в молекулах ДНК (их изменение при контактах молекул воды с протон-донорными и протон-акцепторными центрами азотистых оснований) (см. гл. VI), механизма активирования молекулярного кислорода в процессе биологического окисления (см. гл. X) и некоторых других случаях.
Как можно видеть из этого перечисления, в данном руководстве использованы лишь некоторые простейшие понятия квантовой биохимии, оформившейся как самостоятельное научное направление в начале 60-х годов нашего столетия. Оно возникло на стыке квантовой химии и молекулярной биологии, а в более широком плане — на границе физики и биологии, перерастая постепенно в увлекательную и перспективную новую науку — физико-химическую биологию.
Логика и смысл возникновения и развития квантовой биохимии состоят в том, что от простейших представлений об элементарном составе, порядке расположения и пространственной локализации атомов в молекулах органических соединений (имеющих, естественно, биологическое значение) она обеспечивает переход посредством квантово-механических расчетов к данным о распределении в них электронной плотности и подвижности электронного облака, а также к энергетическим характеристикам, говорящим об устойчивости молекул и их способности отдавать и принимать электроны, т. е. в конечном счете об их реакционной способности, связи структуры и биологической функции.
Квантово-механические расчеты дают достаточно отчетливые представления об энергетических индексах молекул (энергия делокализации электронов, энергия высшей заполненной молекулярной орбитали, энергия низшей свободной молекулярной орбитали, энергия возбуждения), равно как и о структурных индексах молекул (электронные заряды атомов, порядок связи, индекс свободной валентности).
Знание уровней энергии делокализации электронов (разность между наблюдаемой энергией молекулы и энергией, рассчитанной на основании канонической структурной формулы) необходимо для более глубокого понимания механизма действия коферментов и других биологически активных соединений, обладающих системой сопряженных двойных связей; значения энергии делокализации электронов важны, кроме того, для оценки устойчивости водородных связей между комплементарными пуриновыми и пиримидиновыми основаниями, а также существенны при рассмотрении вопроса об установлении равновесия в разнообразных таутомерных превращениях моносахаридов, кетокислот, азотистых оснований и т. п. Данные об энергии высшей заполненной и низшей незаполненной орбиталей прямо взаимосвязаны с электрондонорными и электрон-акцепторными свойствами молекул соответственно и используются для характеристики оксидоредуктазных систем клетки. Сведения об энергии возбуждения, т. е. разности энергии электрона до и после перехода на новую орбиту, неоднократно обсуждались в связи с вопросом о полупроводниковых свойствах белков и нуклеиновых кислот.
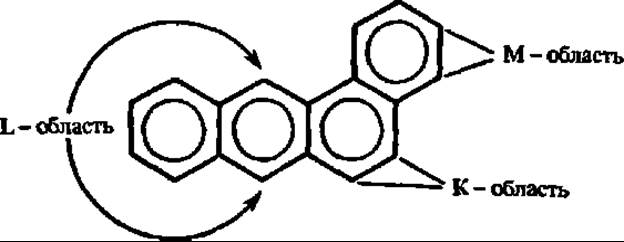
Что касается структурных индексов молекул, то они наиболее часто учитываются при рассмотрении связи структуры и функции органических соединений. Электронные заряды атомов, характеризующие вероятность пребывания электрона вблизи данного атома на всех присущих ему и заполненных орбиталях, специфически распределяются, например, у легко гидролизуемых субстратов, в том числе макроэргических (см. данные об электрондефицитных связях в молекулах АТФ — гл. V). Порядок связи, характеризующий относительную близость рассматриваемой связи к стандартной простой или двойной, помогает понять реакционную способность определенных участков молекулы не только, например, в пиримидинах и пуринах, но и в более сложных соединениях (классическим примером здесь является выявление высокореакционной так называемой К-области в молекулах канцерогенных ароматических углеводов). Индексы свободной валентности атомов (как показатель остаточной, нереализованной валентности у данного атома) указывают на наиболее реакционно-способные центры в молекуле, по которым может происходить присоединение свободных радикалов, атомов водорода (см. структуру изоаллоксазинового кольца в молекуле витамина В2).
Рассмотрение современного состояния квантово-механических подходов к анализу биохимических процессов показывают, что наиболее плодотворные результаты получены при толковании механизмов ряда ферментативных реакций (аминотрансферазная, оксидоредуктазная, лиазная и др.), природы макроэргических связей, канцерогенности ароматических углеводов, особенностей структуры и функции нуклеиновых кислот, связи структуры и фармакологического эффекта молекул. Так, например, при квантово-химических расчетах энергий электронных переходов для различных ионных форм пиридоксаль-5-фосфата, пиридоксамин-5-фосфата и оксимпиридоксаль-5-фосфата, образующихся в процессе аминотрансферазной реакции, получены хорошие совпадения с таковыми, выведенными на основании спектроскопических данных, что способствовало выяснению природы промежуточных кофермент-субстратных комплексов в этой реакции. Исходя из гипотезы, что треугольник из атомов N—О—О в составе обладающих противоопухолевым действием производных антрахинона ответствен за названную биологическую активность, синтезирован эффективный новый канцеростатический препарат: 1,4-дигидрокси-5,8-бис-2-(гидроксиэтил) аминоэтилами но-9,10-антрацендион. Это еще раз подчеркнуло плодотворность применения методов квантовой биохимии для понимания механизма биологической активности канцерогенных и антиканцерогенных веществ, начало чему было положено в классической работе А. Пюльмана и Б. Пюльмана, касающейся выявления способности канцерогенных углеводородов взаимодействовать с клеткой через К-область:
В какой-то мере, данные квантовой биохимии оказались полезными для объяснения свойств белков и пептидов, а также порфириновых соединений.
Вместе с тем необходимо реально представлять себе, что квантовая биохимия находится в самом начале своего пути. Существуют немалые трудности при квантово-химических расчетах электронной структуры не очень сложных молекул, не говоря уже о полных молекулах ДНК, РНК и белков — важнейших природных биополимеров. Ее расчеты справедливы, по-видимому, лишь для фиксированных молекулярных структур, но в них не учитываются еще множественные конформационные состояния макромолекул, неизбежно отражающихся на распределении электронных плотностей. Нерешенным остается вопрос о распределении зарядов в исследуемом соединении в зависимости от характера растворителя и взаимодействия его молекул с атомными группировками изучаемого вещества, иначе говоря — вопрос о корректности электронных характеристик для вещества в той биологической жидкости, где, собственно, и происходят биохимические реакции.
Еще более трудную, но, конечно, центральную задачу квантовой биохимии представляет изучение межмолекулярных взаимодействий, оценка и сопоставление значений энергии в возникающих комплексах, где метод молекулярных орбиталей явно недостаточен из-за невозможности учитывать электронную корреляцию. Поэтому сейчас возлагают надежды на квантово-статистические подходы, где, по существу, уже рассматривается статистика молекул, а не электронов. Вместе с тем методом ЛКАО (линейной комбинации атомных орбиталей) получены вполне удовлетворительные результаты в «квантовой фармакологии» (например, предсказаны новые нейтролептики). И наконец, все построения современной квантовой биохимии осуществляются без учета того, что взаимодействия молекул в живых системах идут на более высоком, качественно новом уровне их организации. Таковы, например, пиктографический способ распознавания молекул в процессе их рецепции (узнавание образа, а не конкретных атомных или электронных структур), а также принципы, закладываемые в новое научное направление — топобиологию, т. е. учение о биологических взаимодействиях, определяемых пространственным расположением биологических структур, дающим ключ к пониманию сложнейших проблем морфогенеза.
Сюда же следует отнести наметившиеся тенденции рассматривать пространственную организацию некоторых биологических структур, например, белкового цитоскелета, как компьютерную систему, осуществляющую непрерывную переработку информации и выдачу необходимых команд для обеспечения нормальной жизнедеятельности клетки. В связи с этим вряд ли оправдан основной методологический принцип квантовой биохимии — свести явления жизни к «самореализации потенциальных возможностей электронных состояний атомов».