ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 1. ВАЖНЕЙШИЕ ФЛАВОНОИДЫ
1.10. Ауроны
Название «ауроны» происходит от латинского aurum - золото. Ауроны придают растениям золотисто-желтый цвет, присутствующий в окраске цветов некоторых известных садовых растений (рис. 22).
Рис. 22. Примеры некоторых наиболее известных ауронов. Представлена также общая формула ауронов в виде двух стереоизомеров и нумерация атомов в молекуле.
Например, лептосидин, присутствующий в цветах кореопсиса крупноцветкового (Coreopsis grandiflora), был первым ауроном, открытым в 1943 г. Еще одним известным примером является ауреусидин, присутствующий в цветах львиного зева (Antirrhinum). В настоящее время делаются попытки создания трансгенных растений, содержащих ауреусидин для улучшения их пищевых качеств. Так был получен трансгенный салат латук (Lactuca sativa), содержащий ауреусидин в листьях. Было показано, что изменение цвета листвы растений, продуцирующих ауреусидин, сопровождается повышенной способностью удалять радикалы супероксида.
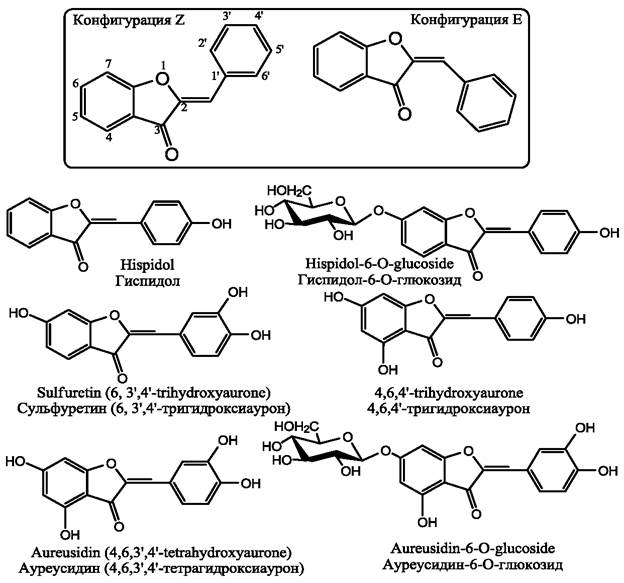
Гиспидол и его гликозиды найдены в бобах сои (Glycine max). Сульфурин присутствует в декоративном растении бутии односеменной (Butea monosperma), различных видах рода кореопсис (Coreopsis), георгин (Dahlia), симсии (Simsia). 4,6,4'-тригидроксиаурон присутствует в растении претокарпус мешковидный (Pterocárpus marsupium). Хотя большинство ауронов присутствует в высших растениях, принадлежащих к двудольным, эти вещества могут присутствовать также в бурых водорослях (Spatoglossum variabile).
В природе ауроны распространенны менее широко, чем другие флавоноиды. Ауроны также менее изучены. Молекула аурона состоит из бензофурана, соединенного с бензилдиеном в положении 2. При этом пятичленное кольцо отличает ауроны от большинства флавоноидов, имеющих шестичленные кольца. Молекулы ауронов могут образовывать два изомера, обозначаемые как Е-конфигурация и Z-конфигурация (рис. 22). В растениях чаще присутствуют Z-ауроны, поскольку указанная конфигурация более устойчива.
В растениях ауроны служат для защиты от грибковой и бактериалной инфекции, защиты от насекомых-вредителей, тогда как яркая окраска цветов, содержащих ауроны, может использоваться для привлечения насекомых-опылителей. Перспективы использования в медицине стали причиной роста числа работ, посвященных исследованию ауронов. Возможность синтеза новых ауронов, обладающих повышенной терапевтической активностью, стала дополнительной причиной развития исследований в этом направлении. Развитие техники синтеза, например, использование ультразвука, позволяет существенно сократить время синтеза до 5-30 мин.
1.10.1. Антиканцеронгенное действие
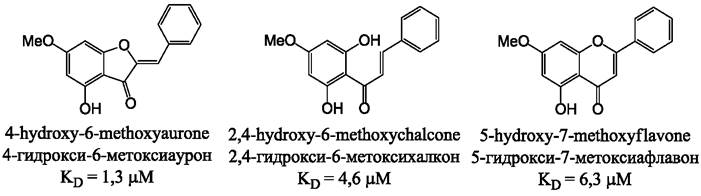
В лечении многих заболеваний, особенно канцерогенных, большое значение имеет феномен множественной лекарственной устойчивости. Было обнаружено, что 4-гидрокси-6-метокси-ауроны и 4,6-диметокси- ауроны (рис. 23) обладают высоким сродством к С-концу нуклеотид- связывающего домена Р-гликопротеина (обозначаемого также АВСВ1), принадлежащего к классу АВС-транспортеров, ответственных за удаление лекарственных веществ из клетки.
Рис. 23. Сравнительная величина сродства к Р-гликопротеину синтетических ауронов, халконов и флавонов.
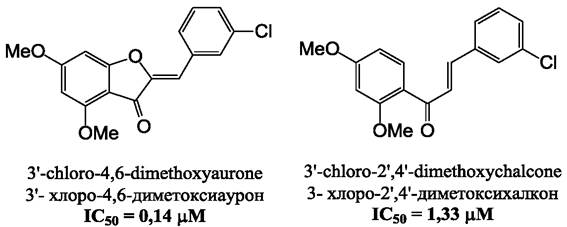
Экспериментально было показано, что вследствие нарушения работы механизмов удаления лекарственных веществ, ауроны значительно эффективнее, чем халконы или флавоны, стимулировали накопление лекарственного агента Паклитаксела в клетках рака молочной железы. Так, полученный путем синтеза 4,6,3’,4’,6’-пентаметоксиаурон, снижал скорость выведения этого лекарственного агента из клеток в десять раз. Ауроны могут оказывать также ингибирующее действие на белок устойчивости рака молочной железы (ВСRР). Было показано, что в присутствии микромолярных концентраций синтетического 4,6-диметоксиаурона, накопление лекарственного вещества митоксантрона в культуре опухолевых клеток возрастало более чем в два раза (рис. 24). Этот аурон оказывал также антипролиферативную активность. В результате величина IС50митоксантрона снижалась в 20 раз. Было показано, что 4,6,3’,4’-, а также 4,6,3’,5’-тетраметоксилированные ауроны способны подавлять экспрессию белка лекарственной устойчивости АВСG2. Кроме того, метоксилированные ауроны могут непосредственно взаимодействовать с субстрат-связывающим центром этого белка, повышая АТФ-азную активность и оказывая ингибирующее действие на способность АВСG2 удалять лекарственные вещества из клетки.
Рис. 24. Сравнение активности синтетического аурона и халкона в отношении ABCG2.
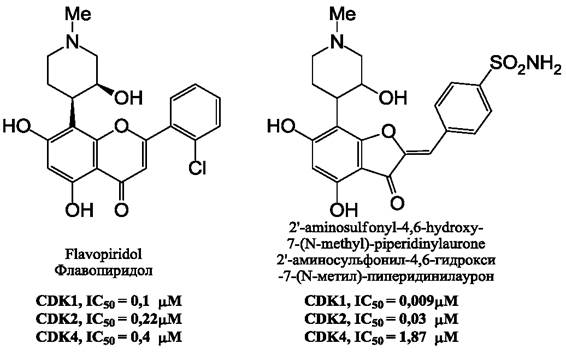
Антиканцерогенное действие ауронов проявляется также в способности ингибировать протеинкиназы, регулирующие клеточное деление. Например, циклин-зависимые киназы (СDК) являются удобной, хотя и труднодоступной, мишенью для лекарственных препаратов, которые могли бы использоваться в терапии рака, в частности, хронического лимфоцитарного лейкоза. Флавоноиды оказались весьма эффективными агентами, действующими на указанные киназы. В настоящее время проводятся клинические исследования действия флавопиридола на течение этого заболевания. Однако эффективность флавопиридола ограничивается низкой специфичностью действия на различные виды СDК- киназ, тогда как некоторые синтетические ауроны (рис. 25) оказались более эффективны в отношении киназы СDК1, что предпочтительно в терапии этого заболевания.
Рис. 25. Сравнение молекулярной структуры и активности в отношении различных форм CDK флавопиридола и синтетического аурона.
Исследовалось также действие синтетических ауронов в отношении сфингозин-киназы (SрhК), регулирующей синтез биоактивных липидов клеточных мембран, сфингозинов и церамидов. Эти липиды участвуют в процессах клеточной сигнализации, апоптоза и развитии многих заболеваний, включая рак. Как было показано в экспериментах на животных, 3’,4’-дигидроксиаурон способен влиять на активность сфингозин-киназы и, благодаря этому, подавлять рост опухоли. При обработке в течение 18 суток удавалось достичь 50 % уменьшения размеров опухоли.
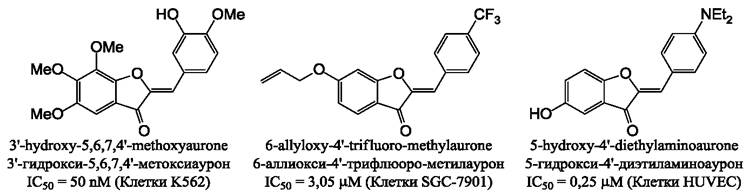
Цитотоксичность веществ в отношении опухолевых клеток широко используется в терапии раковых заболеваний. Некоторые синтетические ауроны (рис. 26) могут проявлять высокую токсичность в отношении клеток рака. Небольшая модификация аурона, полученного из тропического растения Uvaria hamiltonii позволяет получить высокотоксичный для быстро делящихся клеток миелоидной лейкемии (К562) агент, способный останавливать деление на стадии G2/М, что связано со способностью этого вещества взаимодействовать с тубулином в области связывания колхицина и препятствовать его полимеризации.
Рис. 26. Цитотоксичность синтетических ауронов в отношении клеток миелоидной лейкемии (К562), аденокарциномы желудка (SGC-7901) и клеток эндотелия плаценты человека HUVEC.
Необходимо отметить, что в данном случае ауроны уступают некоторым другим флавоноидам. Так, аналогичные молекулы, полученные на основе халконов, проявляют в сотни раз большую активность в связывании тубулина, чем ауроны, что вероятно связано с большей гибкостью молекулы халконов. Напротив, синтетическая молекула 6- аллоиксил-4’-трифторометилаурона оказывается наиболее эффективным ингибитором деления в отношении клеток эндокарциномы желудка, хотя механизм их действия до сих пор не установлен. Кроме того, при замене В-кольца аурона на пиперазин позволило получить высокоэффективные ингибиторы деления клеток различных форм карциномы на стадии G0/G1 которые способны также инициировать апоптоз с IС50 = 4,1-13,1 мкМ.
Одной из стратегий терапии роста опухолей является подавление развития их кровеносной системы. В частности, используются агенты, препятствующие росту сосудистого эпителия. Было установлено, что наличие в молекуле аурона группы диэтиламина в положении 4’ необходимо для получения высокоэффективных ингибиторов деления клеток сосудистого эпителия НUVEС с IС50 = 0,25 мкМ. Эти молекулы оказались также ингибиторами роста клеток рака легких и рака молочной железы, но проявляли низкую токсичность к нераковым клеткам.
Использование антиоксидантов является одним из механизмов терапии канцерогенеза. Флавопротеин NAD (Р)Н-хинон-оксидоредуктаза-1 (NQO1) является частью клеточной системы защиты от действия реактивных форм кислорода (ROS), способной восстанавливать токсические хиноны. Удаление хинонов обеспечивает стабильность фактора подавления опухолей р53. Поэтому терапевтические действия, направленные на повышение уровня NQO1 в цитоплазме, часто рассматриваются как эффективные меры терапии рака. Было показано, что фторированные производные 4,6-диметоксиаурона (рис. 27) в два раза увеличивают активность NQO1 при субмикромолярных концентрациях.
Рис. 27. Индукция NQO1 и удаление супероксидного радикала синтетическими производными ауронов. CD - концентрация ауронов, необходимая для удвоения активности NQO1.
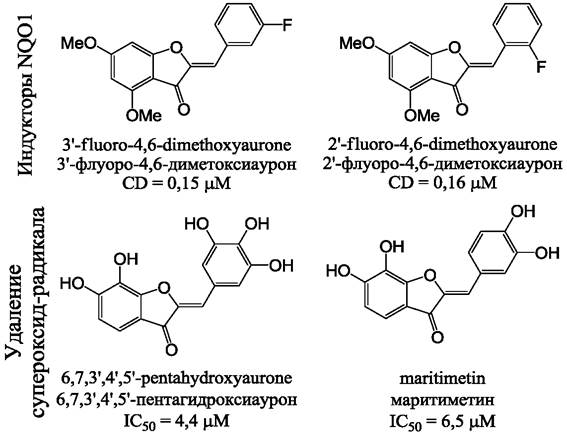
Индукция NQO1 происходит вследствие активации системы защиты против ксенобиотиков с участием рецептора полифенолов AhR и фактора транскрипции Nrf2. Ауроны проявляют также высокую активность в отношении радикалов, например, супероксидного радикала. В условиях эксперимента антирадикальная активность ауронов исследовалась с использованием дифенил-пикрил-гидразина (DPPH) в отношении которого ауроны проявляют активность в 100 раз более высокую, чем аскорбиновая кислота.
1.10.2. Противовоспалительное действие
Замена бензилдиеновой группы ауронов на 2,2-бис-аминометил позволяет получить вещество, способное ингибировать продукцию цитокинов, участвующих в процессе воспаления - фактора некроза опухолей TNF-α и интерлейкина IL-6. Наибольшую активность проявил 2,2-бис-перролидинометил аурон, который полностью подавлял синтез цитокинов при концентрации 10 мкМ. Кроме того, было показано, что ауроны являются ингибиторами продукции окиси азота, способны удалять продукты окисления липидов.
В народной медицине Азии используется экстракт древесины ствола лакового дерева (Rhus vemiciflua) для лечения стаза крови и рака. Было обнаружено, что содержащийся в этом растении сульфуретин ингибирует экспрессию синтазы окиси азота, циклооксигеназы-2, провоспалительных цитокинов TNFα, IL-1P и простагландина Е2. Среди присутствующих в этом растении ауронов наибольшую активность в снижении количества окиси азота (IC50= 9,3 мкМ) и простагландина Е2 (IC50= 1,6 мкМ) проявлял 6-О-метилсульфуретин.
1.10.3. Терапия нарушений функций мозга
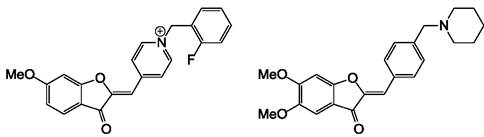
Аминометилауроны и их аналог инданон являются ингибиторами ацетилхолинэстеразы, что может использоваться для временного улучшения состояния пациентов, страдающих болезнью Альцгеймера. В экспериментах in vitro ауроны были более активны (IC50 = 0,082-1,54 мкМ), чем обычно используемое лекарство ривастигмин (IC50 = 2,07 мкМ). Хорошие результаты получены также в поведенческих тестах на животных, получавших эти ауроны. Молекулярное моделирование показывает, что инданон хорошо соответствует активному сайту ацетилхолинэстеразы. Активность этих веществ может быть существенно улучшена при замене В-кольца на группу N-бензилпиридина (рис. 28). Активность этих производных аурона (IC50 = 10-22 нМ) превышает активность лекарственного средства донепезила (IC50 = 28 нМ), используемого для сравнения.
Рис. 28. Синтетические аналоги аурона, содержащие пиридиновую группу, являются ингибиторами ацетилхолинэстеразы.
1.10.4. Гормональное действие
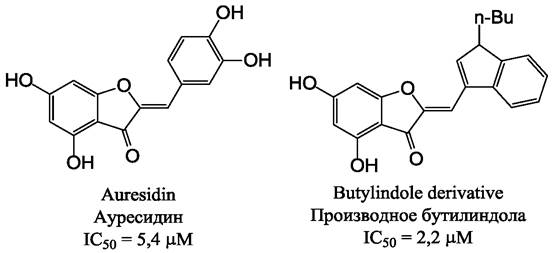
Заболевание гипертиреоз (базедова болезнь), вызвана избыточной продукцией гормонов щитовидной железы трийодтиронина и тироксина. Одной из мишеней в терапии этого заболевания является фермент йодотиронин-дейодиназа, избыточная экспрессия которого приводит к сверхпродукции соответствующего гормона. Растительные экстракты с антигормональной активностью, не содержащие ауронов, давно используются в лечении базедовой болезни. Однако было обнаружено, что некоторые природные ауроны: ауреусидин, сульфуретин, а также 4,6,4’- тригидроксиаурон являются наиболее мощными природными ингибиторами указанного фермента. Еще в середине 80-х гг. прошлого века было показано, что при введении в молекулу 4,6,4’-тригидроксиаурона атома йода в положении 3’ получается агент, способный успешно конкурировать с тироксином, и благодаря этому ингибировать фермент (IC50 = 0,5 мкМ). Предполагается, что молекула аурона, содержащая гидроксильные группы в положении 4 и 4’, может ошибочно распознаваться ферментом как молекула гормона.
1.10.5. Защита против ожирения и диабета
Аурон сульфуретин из растения Rhus verniciflua является одним из наиболее активных среди флавоноидов ингибиторов альдозоредуктазы (ALR2) - фермента, участвующего в восстановлении глюкозы до сорбитола, что является одной из причин развития диабета. Активность сульфуретина сравнима с лекарственным агентом эпалрестатом. Кроме того, сульфуретин является ингибитором образования конечных продуктов гликозилирования (AGE), появление которых является причиной различных осложнений здоровья больных диабетом. Однако активность сульфуретина в торможении формирования AGE была в 10 раз ниже, чем лекарственного агента аминогуанидина. В условиях эксперимента на животных было показано, что сульфуретин защищает р-клетки поджелудочной железы от повреждения стрептозотацином, используемым в этом эксперименте для инициации диабета. Защитное действие достигается благодаря подавлению активности ядерного фактора NF-kB.
Производные ауронов с прикрепленными к молекуле жирными кислотами (ауроновые эфиры жирных кислот) способны значительно снижать развитие жировых клеток адипоцитов. При этом, наблюдается снижение потребления глюкозы этими клетками, что предположительно может использоваться в предотвращении ожирения, хотя механизм этого действия пока не исследован.
1.10.6. Защита от одноклеточных паразитов
Способность ауронов защищать от возбудителей лейшманиоза и малярии была обнаружена в конце 90-х - начале 2000-х гг. Наиболее токсичными в отношении возбудителей лейшманиоза были гидрофобные ауроны с малым числом гидроксильных групп. Так, 4’,6’-дигидроксиаурон и 6-метоксиаурон были наиболее активны в нарушении дыхательных функций митохондрий возбудителей лейшманиоза (рис. 29). Внесение дополнительных гидроксильных групп в молекулу приводило
к существенному снижению активности этих веществ. Антипаразитарная активность ауронов может объясняться ингибированием митохондриального фермента фумарат-редуктазы, необходимого для обеспечения анаэробного метаболизма, при котором энергия извлекается путем восстановления фумарата в сукцинат. Ауроны способны снижать активность этого фермента более чем на 90 %, тогда как халконы снижали активность только на 46,6 %.
Рис. 29. Синтетические ауроны с наибольшей антипаразитарной активностью.
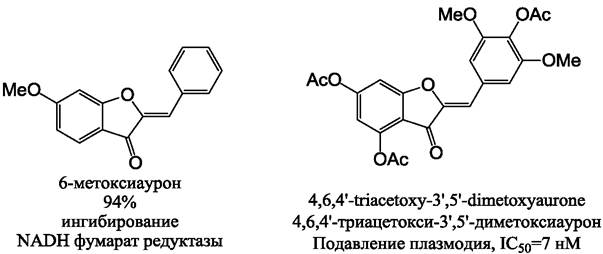
Ауроны также нарушали эритроцитарную стадиию развития малярийного плазмодия. Наиболее активные ауроны содержали много метокси- и ацетокси-заместителей. Например, высокую активность проявлял 4,6,4’-триацетокси-3’,5’-диметоксиаурон (рис. 29) в отношении как хлорохин-чувствительных, так и хлорохин-устойчивых штаммов паразита. Замена атома килорода, находящегося внутри цикла, на атом азота существенно повышала активность этих агентов. В исследовании 35 различных производных аурона было показано, что повышение активности наблюдалось при наличии 4,6-диметокси-группы, а также при наличии гидрофобных заместителей в положении 4’.
1.10.7. Антибактериальная активость
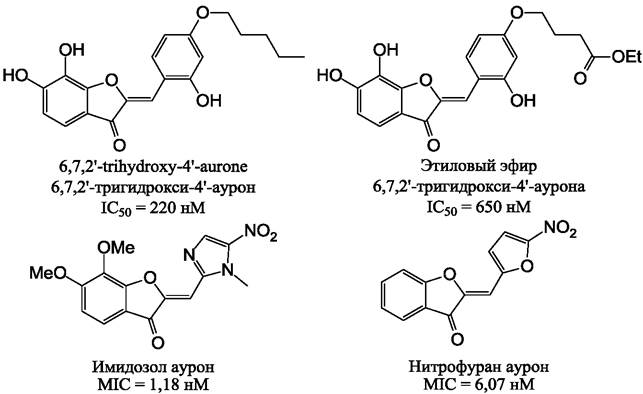
Как и многие флавоноиды, ауроны способны проявлять антибактериальную активность. Например, 6,7-дигидроксиауроны действуют на хоризмат-синтазу - фермент, участвующий в шикиматном пути синтеза незаменимых ароматических аминокислот (фенилаланина, тирозина, триптофана) у растений, грибов и бактерий, но отсутствующий у животных, что делает компоненты этого пути удобными мишенями в создании нетоксичных для человека антибиотиков. Присутствие в молекуле гидроксильной группы в положении 2’ и эфирной связи в положении 4’ (рис. 30) позволяет получать агенты с активностью IC50 <1 мкМ.
Было показано, что замена в ауроне кольца В на имидазольную или фурановую группы (рис. 30) позволяло получать мощные ингибиторы роста Staphylococcus aureus, Staphylococcus epidermidis, Bacillus subtilis, механизм действия которых пока не установлен. Наиболее важным элементом, определяющим активность этих соединений, было присутствие бензофуранового кольца, характерного для ауронов. Кроме того, предпочтительна 2-конфигурация молекулы аурона.
Рис. 30. Производные ауронов с антибактериальной активностью. В верхнем ряду представлены ингибиторы хоризмат-синтазы Streptococcus pneumoniae. Внизу представлены ингибиторы роста Staphylococcus epidermidis. Величина MIC является концентрацией вещества, необходимой для ингибирования роста микроорганизмов после инкубации в течение ночи.
1.10.8. Противовирусная активность
В настоящее время ауроны считаются наилучшей природной основой для создания синтетических агентов, действующих на нейраминидазу вируса гриппа - одного из главных белковых компонентов оболочки вирусной частицы, ответственного за проникновение частиц вируса в респираторный тракт, а также за высвобождение созревших вирусных частиц из инфицированных клеток, что способствует распространению инфекции. Благодаря этому, нейраминидаза является наиболее исследованной мишенью для создания антивирусных лекарственных препаратов. Ауроны сульфуретин (IС50 = 30-50 мкМ) и гиспидол (IС50 = 22 мкМ) проявляют большую активность в отношении вирусов гриппа А и В, чем флавоноиды других классов: флавоны, флаваноны, флавонолы или изофлавоны. Для высокой активности требуется присутствие в молекуле следующих групп: 4’-OH, 7-OH, 4-O.
Ауроны способны также проявлять активность в отношении ингибитора РНК-зависимой РНК-полимеразы (NS5B) вируса гепатита С. Этот фермент участвует в репликации молекул РНК вируса и считается наилучшей мишенью для антивирусной терапии. Гидрофобные молекулы ауронов способны проявлять активность в отношении NS5B в микромолярных концентрациях (рис. 31). Исследования в области мутагенеза и молекулярного докинга показали, что ауроны связываются не с активным центром фермента, а с аллостерическим карманом (Thumb Site I). Эти природные нетоксичные вещества обладают явным преимуществом в сравнении с полученными ранее полностью синтетическими и токсичными лекарственными агентами.
Рис. 31. Природный и синтетический ауроны - ингибиторы фермента NS5В вируса гепатита С.