ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 2. МЕХАНИЗМЫ ДЕЙСТВИЯ ФЛАВОНОИДОВ
2.3. Флавоноиды как хелаторы металлов
Флавоноиды хорошо связывают ионы металлов и образуют с ними комплексы. Поскольку многие металлы, прежде всего металлы переменной валентности, например, ионы железа и меди, являются инициаторами перекисного окисления и способствуют образованию свободных радикалов, связывание ионов этих металлов является важным вкладом флавоноидов в защиту организма от окислительного стресса. Таким образом, антиоксидантное действие флавоноидов определяется не только их способностью удалять свободные радикалы из среды путем непосредственного взаимодействия с ними, но также способностью связывать (хелатировать) и удалять из среды ионы металлов, инициирующих появление свободных радикалов.
По мнению многих исследователей, хелатирование металлов является наиболее эффективным путем подавления процессов перекисного окисления флавоноидами. Более того, при образовании комплексов с металлами переменной валентности, например, Fe(II), Fe(III), Cu(I), Cu(II) и др., способность флавоноидов нейтрализовать свободные радикалы возрастает. Этот эффект достигается благодаря тому, что комплексы флавоноидов с металлами обладают супероксиддисмутазной активностью. Указанные реакции комплекса флавоноида с металлом и супероксид-анион-радикалом можно записать следующим образом:
(1) Me(n+1)+- Флав + O2•- —> Men+Флав + O2,
(2) Men+- Флав + O2•- + 2H+—> Me(n+1)+- Флав + H2O2,
где Ме - металлы переменной валентности: Fe (n = 2); Cu (n = 1) и др.
Эти процессы были обнаружены не только in vitro, но также в экспериментах на животных. Так, комплексы Cu-рутин эффективно защищали от окисления легочную ткань животных, вдыхавших асбестовую пыль. Исследовались также антиоксидантные свойства флавоноидов с другими металлами, например, комплексов морина с Pd(II) и Pt(II). Было показано, что при образовании комплексов способность морина связывать супероксид-радикал и препятствовать окислению липидов возрастает. При этом, комплекс с Pt(II) обладал большей активностью, чем комплекс с Pd(II). Комплексы морина с ионами La(III), Gd(III), Lu(III) проявляют антибактериальную активность в отношении Escherichiacoli, Klebsiella pneumoniae, Staphylococcus aureus, сравнимую с действием пенициллина. Комплексы кверцетина с трехвалентными редкоземельными металлами (La, Nb, Eu, Gd, Tb, Dy, Tm, Y) обладают токсичностью в отношении клеток опухолей. Показана также их способность связываться с молекулой ДНК, что вероятно вносит определенный вклад в антиопухолевую активность этих комплексов. Высокая антиоксидантная активность и способность связываться с ДНК была обнаружена также у комплексов нарингенин-2-гидроксибензоил гидрозона с трехвалентными редкоземельными металлами Y и Eu или комплексов гесперетин-4- бензоил гидразона с трехвалентными лантаноидами, особенно с Nd. Высокую активность на животных, на клетках из различных органов или на субклеточных фракциях обнаруживали металлокомплексы рутина, кверцетина, катехина и других флавоноидов, что свидетельствует не только о большой общебиологической значимости этих комплексов, но также открывает перспективы их использования в медицине.
2.3.1. Взаимодействие флавоноидов с металлами
Потенциально молекулы флавоноидов могут иметь несколько сайтов связывания металлов, положение которых определяется наличием пар, расположенных рядом гидроксильных или карбонильных групп. Так, в связывании могут принимать участие пара 3’- и 4’-гидроксильных групп кольца В. Указанную пару гидроксилов часто называют катехольной группой, хотя эта группа присутствует не только в катехинах, но и в некоторых других флавоноидах, например, в кверцетине, таксифолине и др. Кроме того, в связывании металлов могут принимать участие 3-гидроксильная и 4-карбонильная группы кольца С или 5-гидроксильная и 4-карбонильная группы, принадлежащие кольцам А и С соответственно.
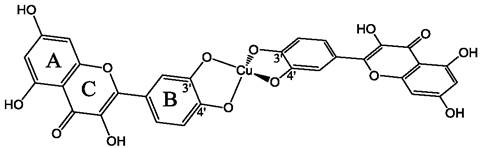
Катехольная группа рассматривается некоторыми исследователями как наиболее вероятный центр связывания металлов. Связывание металлов в этом положении может облегчаться в щелочных средах (рН 10) вследствие депротонирования гидроксилов. Этот сайт связывания был исследован на примере комплекса кверцетина с ионами Сu(II). При создании комплекса соотношение кверцетин: медь (II) составляло 2:1 (рис. 51).
Рис. 51. Комплекс кверцетина с двухвалентной медью. Соотношение кверцетин: медь = 2 : 1. Атом меди взаимодействует с гидроксилами катехольных групп, благодаря чему связывает две молекулы кверцетина. В предложенной схеме молекулы кверцетина располагаются в ортогональных плоскостях.
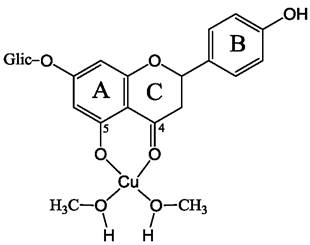
Не все флавоноиды имеют катехольную группу. Более того, количество гидроксильных групп в молекулах некоторых флавоноидов весьма ограничено, что облегчает анализ структуры комплексов. Например, в комплексе гликозида нарингенина с медью имеется лишь одно место связывания катиона металла в положении 5-гидроксильная и 4-карбонильная группы (рис. 52). Было обнаружено, что образование комплекса с медью повышает антиоксидантные свойства нарингенина. Кроме того, повышается токсичность этого вещества в отношении клеток злокачественных опухолей, усиливается антивоспалительное действие.
Рис. 52. Комплекс нарингенина с двухвалентной медью. Соотношение нарин- генин: Сu(II) = 1:1. Нарингенин растворен в этиловом спирте, поэтому в состав комплекса входят две молекулы этанола. Структура металлокомплекса определена с помощью спектроскопии в инфракрасной, ультрафиолетовой и видимой областях, а также на основании данных ЯМР.
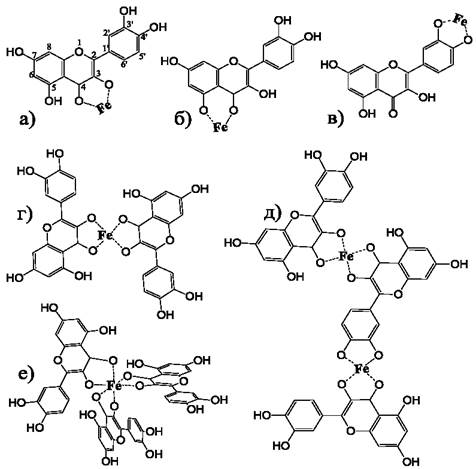
Однако в некоторых случаях положение атома металла, а также стехиометрию комплексов трудно определить и этот вопрос до сих пор является предметом дискуссий. При взаимодействии кверцетина с ионами железа различной валентности предполагается возможность образования комплексов с различной стехиометрией связывания. Расчеты показывают, что из трех возможных сайтов связывания (рис. 53, а-в) наибольшая энергия связывания ионов железа в молекуле кверцетина наблюдается в комплексе с 3-й гидроксильной и 4-й карбонильной группами (рис. 53 а). За ними следуют 4-я карбонильная и 5-я гидроксильная группы (рис. 53 б), а также 3’-я и 4’-я гидроксильные группы (рис.53 в).
Рис. 53. Предполагаемая структура комплексов кверцетина с атомами железа с различной стехиометрией связывания: (а-в) - стехиометрия кверцетин/железо 1:1;
(г) - 2:1; (д) - 3:2; (е) - 3:1.
Стехиометрия связывания зависит от валентности железа и может составлять величины 1:1, 1:2, 2:3 и 1:3 для Fe(II) и Fe(III) (рис. 53). Таким образом, теоретически возможно образование комплексов железа с одной, двумя и тремя молекулами кверцетина. Как упоминалось в предыдущих главах, благодаря реакции Фентона, переход между формами железа Fe(II) и Fe(III) значительно облегчается в присутствии перекиси водорода, которая образуется в клетке в процессе различных окислительновосстановительных реакций, протекающих в митохондриях и частично в эндоплазматическом ретикулуме. Поэтому в клетке потенциально могут присутствовать ионы железа с различной степенью окисленности. В то же время, необходимо учитывать, что благодаря наличию восстановительных агентов, таких как НАДН-редуктаза, аскорбиновая и лимонная кислоты, а также тиоредоксин, катионы железа in vivo присутствуют большей частью в восстановленной форме (Fe2+), тогда как окисленная форма железа (Fe3+) практически не встречается.
2.3.2. Липофильность металлокомплексов
Образование комплексов флавоноидов с катионами железа может оказывать существенное влияние на их липофильность и взаимодействие с фосфолипидным бислоем. Так, расчеты коэффициента распределения молекул в системе октанол/вода (C log P) показывают, что комплекс кверцетин-железо (1:1) менее гидрофобен, чем молекула свободного кверцетина, однако липофильность существенно возрастает в комплексах кверцетин-железо 2:1, 3:2, 3:1 (табл. 6).
Таблица 6. Расчетные величины коэффициента распределения кверцетина и его комплексов с железом в системе октанол/вода (C log P).
Вещество |
С log P |
Кверцетин |
1,30757 |
Кверцетин/железо (1:1) |
0,86626 |
Кверцетин/железо (2:1) |
3,47752 |
Кверцетин/железо (3:2) |
5,5498 |
Кверцетин/железо (3:1) |
6,08878 |
Примечание. Данные получены с использованием программы Chem3DUltra 9.0 (программный пакет Chemical Office, Cambridge Soft). Величина C log P> 1 свидетельствует о повышенной липофильности вещества.
Расчеты показывают, что образование комплекса кверцетина с железом не препятствует взаимодействию этого флавоноида с фосфолипидным бислоем. В соответствии с расчетами, данное взаимодействие может усиливаться в металлокомплексах с соотношением кверцетин-железо 2:1, 3:2 или 3:1, тогда как липофильность
металлокомплекса 1:1 ниже липофильности свободного кверцетина.
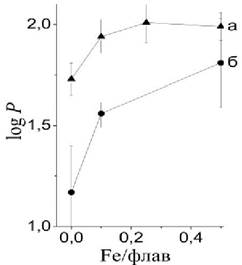
Экспериментальные измерения также показывают рост липофильности флавоноидов в присутствии железа, что выражается в росте величины коэффициента распределения этих веществ в системе октанол / вода (рис. 54). Однако получаемые величины log P существенно меньше расчетных величин C log P, полученных для комплексов кверцетин/железо> 1:1.
Рис. 54. Зависимость коэффициента распределения (log P) в системе октанол / вода от соотношения железо(II)/флавоноид для кверцетина (а) и таксифолина (б).
2.3.3. Стехиометрия металлокомплексов
Экспериментальные исследования взаимодействия различных комплексов флавоноидов с металлами показывают, что их стехиометрия сильно зависит от концентрации протонов. При слабокислых или нейтральных рН координационное число может быть выше, чем в щелочных средах. Для образования комплексов оптимальным является рН 6 (табл. 7).
Таблица 7. Стехиометрия комплексов флавоноидов с металлами.
Флавоноид |
Ион металла |
Флав/металл |
рН |
Сu(II) Zn(II) Рb(II) Ni(II) Со(II) |
1:2 1:1 1:2 1:2 1:1 |
6,1 6,2 4,5 6,2 5,0 |
|
Рутин |
СоO42- WO42- Еu(III) UO2(II) Pd(II) ТiO(С2O4)22- |
1:1 1:2 1:2 1:1 1:2 1:2 |
6.3 7.0 5.0 6,8 8,2 6.4 |
Кверцетин |
Ni(II) Со(II) Pd(II) ТiO(С2O4)22- Ba(II) |
1:1 1:1 1:1 1:2 1:1 |
5.0 5.0 6,2 6,4 4,2 |
Морин |
Сu(II) Zn(II) WO42- Pd(II) ТiO(С2O4)22- Ва(II) |
1:2 1:2 1:2 1:1 1:2 1:1 |
5,8 5.5 5.2 5.5 4.3 4,2 |
Гесперетин |
Сu(II) UO2(II) Аl(III) Zr(IV) |
1:2 1:2 1:1 1:1 |
5.7 3.7 3.7 3,6 |
При высоких концентрациях протонов (рН 3) гидроксильные группы не диссоциируют, что препятствует формированию комплексов с металлами. Образование комплексов кверцетина с железом можно анализировать по спектрам поглощения кверцетина в видимой и ультрафиолетовой областях. Известно, что кверцетин имеет два максимума поглощения: при 373 нм (полоса 1) и при 255 нм (полоса 2). Полоса 1 относится к электронным переходам В-кольца, тогда как полоса 2 связана с переходами А-кольца кверцетина. При титровании кверцетина возрастающими концентрациями железа максимум при 373 нм снижается, но при этом появляется и растет максимум при 425 нм, что связано с появлением металлокомплекса (рис. 55).
Рис. 55. Определение стехиометрии кверцетин: Fе(II) методом титрования. А - набор спектров кверцетина в концентрации 20 мкМ (1) и комплексов кверцетина с железом в концентрациях 2 мкМ, 4 мкМ, 6 мкМ, 8 мкМ, 10 мкМ (номера 2-6 соответственно). Б - зависимость величины абсорбции при 425 нм от концентрации железа. Излом кривой приходится на 10 мкМ железа, что соответствует стехиометрии квер- цетин/железо 2:1.
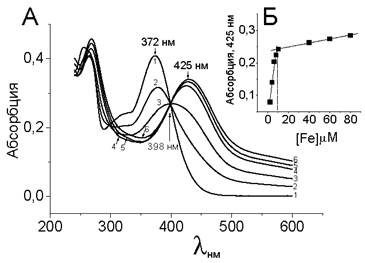
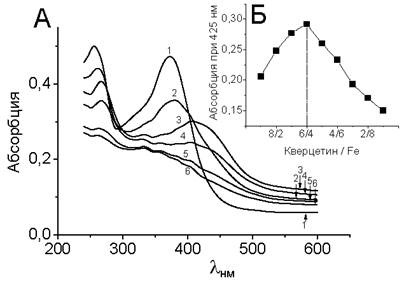
Полученный набор кривых имеет одну изоcбестическую точку при 398 нм, что свидетельствует о наличии единого равновесного и обратимого процесса формирования обоих хромофоров. Зависимость величины абсорбции при 425 нм от концентрации железа может быть аппроксимирована к прямой, имеющей излом при концентрации железа 10 мкМ. Учитывая, что в эксперименте концентрация кверцетина была 20 мкМ, мы получаем стехиометрию кверцетин: Fe = 2:1. Спектры комплексов кверцетина с железом (II), полученные при смешивании компонентов в различных молярных отношениях, не имеют изосбестической точки, что характерно для указанного способа смешивания компонентов (рис. 56). Полученная зависимость величины поглощения от молярных отношений компонентов имеет максимум при отношении 3:2.
Рис. 56. Определение стехиометрии кверцетин / Fе(II) методом молярных соотношений. А - спектры поглощения кверцетина (1) и комплексов кверцетина с железом, полученных путем смешивания кверцетина и железа в молярных соотношениях 8:2, 6:4, 4:6, 2:8; 1:9 (номера 2-6 соответственно). Б - зависимость абсорбции при 425 нм от соотношения кверце- тин/железо. Максимум кривой приходится на соотношение кверцетин/железо 6:4.
Коэффициент распределения полифенолов в системе вода-октанол (log P), определяющий их липофильность и способность погружаться в гидрофобную область фосфолипидного бислоя биологических мембран, коррелирует с их антиоксидантной активностью и способностью прерывать процессы окисления липидов как в полярной, так и в гидрофобной областях мембраны, в зависимости от степени погружения этих молекул в бислой.
Способность флавоноидов погружаться в гидрофобную область мембраны снижается для молекул с большим числом гидроксильных групп. На способность флавоноидов погружаться в бислой может влиять концентрация солей и присутствие отрицательно заряженных липидов в мембране. На примере катехинов было показано, что даже различные стериоизомеры этих молекул способны поразному влиять на физические свойства бислоя.
Многочисленные исследования показывают, что изофлавоны сои снижают риск развития рака молочной железы также благодаря защите от действия 4-HNE. В частности, было обнаружено, что генистеин способен влиять на экспрессию глютатион-S-трансферазы в клетках эпителия молочной железы человека, нарушенную токсическим действием продуктов перекисного окисления и, в частности, 4-HNЕ. При этом снижается возможность повреждения клеточной ДНК, наблюдающаяся в присутствии 4-HNE, что предотвращает возможность неопластического роста этих тканей и развития опухоли.