ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 2. МЕХАНИЗМЫ ДЕЙСТВИЯ ФЛАВОНОИДОВ
2.4. Действие флавоноидов на биологические мембраны
Цитоплазма любой клетки отделяется от окружающей среды клеточной мембраной, которую называют плазматической. Кроме того, у эукариотических клеток мембраны отделяют различные внутриклеточные компартменты, благодаря чему внутри клетки различают такие органеллы, как ядро, митохондрии, аппарат Гольджи, эндоплазматический ретикулум, вакуоли, хлоропласты, лизосомы.
Функции мембран разнообразны, но главная функция - барьерная. Мембраны разделяют две водные среды, например, клеточное окружение и цитоплазму, цитоплазму и кариоплазму (содержимое ядра), цитоплазму и внутренний просвет вакуоли и т. д. Для поддержания жизнедеятельности клетки важно то, что мембраны являются барьерами, обладающими избирательной (селективной) проницаемостью для различных веществ. Практически все жизненно важные вещества могут проникать через мембраны, но пути и механизмы их проникновения, а также направление их движения различны, и эти различия являются основой клеточного метаболизма. Барьерные свойства мембран позволяют клетке защищаться от проникновения патогенных агентов и направленно транспортировать компоненты метаболических процессов.
Являясь полупроницаемым барьером для веществ, мембраны также обладают способностью к рецепции и избирательному проведению сигналов с поверхности клетки в цитоплазму, что определяет сигнальную функцию мембран. Однако многие процессы жизнедеятельности непосредственно связаны с самой мембраной и протекают на ее поверхности или в глубине гидрофобной области. Мембрана высоко структурирована, и различные ее участки отличаются не только функционально, но также и по химическому составу. Две противоположные поверхности мембраны тоже существенно различаются, как функционально, так и по химическому составу, что придает векторную направленность процессам переноса веществ через мембраны.
Имея высокую структурированность, мембраны также являются динамичными жидкокристаллическими образованиями. В основе их организации лежит бислойная структура, образованная фосфолипидами. Известно, что фосфолипиды, как природного происхождения, так и их синтетические аналоги, способны спонтанно образовывать бислойные структуры при гидратации. Наиболее известным фосфолипидом, спонтанно образующим бислойные структуры, обычно в форме липосом, является фосфатидилхолин. Общая фракция фосфолипидов, полученных из некоторых природных источников, например, липиды из яичного желтка (яичный лецитин), липиды сои (соевый лецитин), липиды клеток мозга различных животных, тоже могут образовывать липосомы.
Кроме фосфолипидов, структурное разнообразие и функциональная специализация клеточных мембран в значительной степени определяется присутствием в них белков, а также других молекул, прежде всего холестерина. Представление о том, что мембранные белки, прикрепленные к поверхности или интегрированные в бислой фосфолипидов, могут диффундировать в плоскости бислоя как в жидкости, а в некоторых случаях могут собираться вместе виде «островов» в жидком «озере» липидов, нашло отражение в так называемой «жидкостно-мозаичной» модели мембраны, предложенной Сингером и Николсоном в 1972 г. Эта модель не потеряла актуальности и в наше время, несмотря на внесенные изменения и дополнения.
В основе структуры биологических мембран лежит бислой, образованный липидами. Именно липиды являются основным строительным элементом, определяющим многие физические свойства мембран и создающим специфические условия для функционирования мембранных белков. Термин «липиды» происходит от греческого «липос» - жир. Они представляют собой большую группу природных органических веществ, которые выделяют из тканей различных организмов с помощью органических растворителей (хлороформ, спирты, ацетон). В соответствии с современной классификацией, липиды разделяют на восемь больших классов: глицеролипиды, глицерофосфолипиды, жирные кислоты, сфинголипиды, стероидные липиды, пренольные липиды, гликолипиды и поликетиды. Большая часть липидов, входящих в состав мембран клеток, принадлежит к классу глицерофосфолипидов, которые часто называют просто фосфолипидами.
Молекулы липидов имеют полярную, способную взаимодействовать с водой (гидрофильную) часть и неполярную, не растворимую в воде (гидрофобную) часть, представленную углеводородными цепочками, которые часто являются остатками жирных кислот (рис. 57). В полярной части молекулы могут иметь одну или несколько фосфатных групп, несущих отрицательный заряд. Большинство липидов в полярной части молекулы имеют также дополнительные гидрофильные группы, несущие заряды, что определяет суммарный заряд молекулы, который обычно бывает отрицательным или нейтральным, хотя в природе встречаются также положительно заряженные липиды.
Рис. 57. Липиды, наиболее часто встречающиеся в мембранах эукариот. PC - фосфатидилхолин, LPC - лизофосфатидилхолин, PA - фосфатидная кислота, LPA - лизофосфатидная кислота, PE - фосфатидилэтаноламин, PG - фосфатидилглицерин, PS - фосфатидилсерин, CL - кардиолипин, Chol - холестерин, FA - жирная кислота,
PI - фосфатидилинозитол, PIP3 - фосфатидилинозитол-трифосфат, DAG - диацилглицерин, Sph - сфингозин, SphlP - сфингозин-1-фосфат, SphM - сфингомиелин, Cer - церамид,GlcCer - глюкозилцерамид. Остаток глицерина (глицериновый остов) выделен жирным.
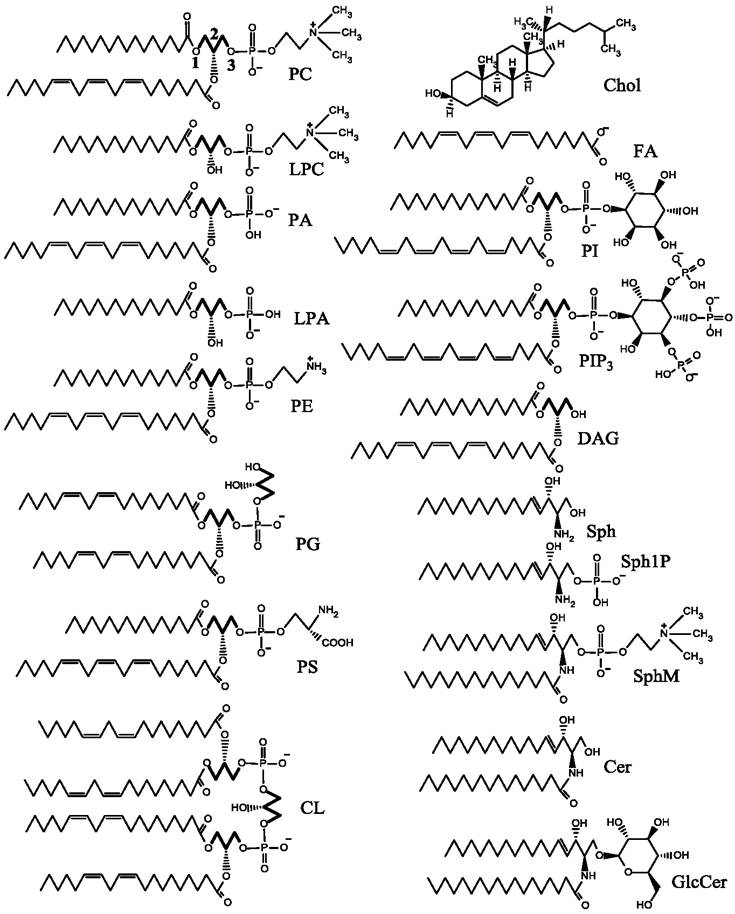
Многие из представленных липидов являются глицеролипидами. Часто они имеют также фосфатную группу и поэтому их относят к глицеро- фосфолипидам. В молекуле фосфатидилхолина (PC), как в большинстве глицерофосфолипидов, имеется глицериновый остов, к которому в положениях 1 и 2 присоединены сложноэфирной связью остатки жирных кислот. Следует заметить, что жирная кислота в положении 2 часто имеет одну или несколько двойных связей в цис-конформации. В молекулах сфинголипидов (SphM, GlcCer, PI, PIP3) в положении 2 углеводородная цепь прикрепляется посредством амидной связи. Полярная часть молекулы PC имеет две заряженные группы: фосфатную с зарядом (-) и холиновую группу с зарядом (+). Таким образом, суммарный заряд фосфатидилхолина равен нулю. Полярная группа молекулы является цвиттер-ионом и проявляет свойства диполя. Такую же полярную группу имеет LPC, который отличается от РС отсутствием остатка жирной кислоты в положении 2. Свойствами цвиттер-иона обладает также молекула SphM, полярная область которой не отличается от РС. Кроме того, имеется ряд нейтральных молекул, не имеющих заряда. К ним относятся Chol, DAG, Cer, GlcCer. Отрицательный заряд, присутствующий на фосфатной группе, часто не компенсируется наличием положительного заряда, вследствие чего общий заряд молекул отрицательный. К таким молекулам относятся PA, LPA, PG, PI, Sph1P. Два отрицательных и один положительный заряд присутствует в молекуле фосфатидилсерина (PS), тогда как кардиолипин (CL) имеет две фосфатных группы, и соответственно - два отрицательных заряда. Среди представленных липидов наибольшее число отрицательных зарядов (около пяти) несет молекула PIP3.
Таблица 8. Липидный состав различных органов крысы.
Липид |
Ткань |
||
Сердце |
Печень |
Эритроциты |
|
Chol - эфиры |
- |
2 |
- |
TAG |
4 |
7 |
- |
DAG |
1 |
- |
- |
Chol |
4 |
5 |
30 |
CL |
12 |
5 |
- |
PE |
33 |
20 |
21 |
PI |
4 |
4 |
3 |
PS |
- |
- |
3 |
PC |
39 |
55 |
32 |
SphM |
2 |
2 |
8 |
LPC |
- |
- |
1 |
Меньшая вариабельность характерна как для липидов, присутствующих в больших количествах (PC, PE), так и для некоторых минорных липидов, например, PI. Известно, что эритроциты содержат только плазматическую мембрану и поэтому представленные выше данные по эритроцитам интересно сравнить с данными о составе плазматичских мембран других клеток (рис. 58).
Рис. 58. Фосфолипидный состав и асимметрия распределения фосфолипидов в плазматической мембране клеток из различных тканей человека.
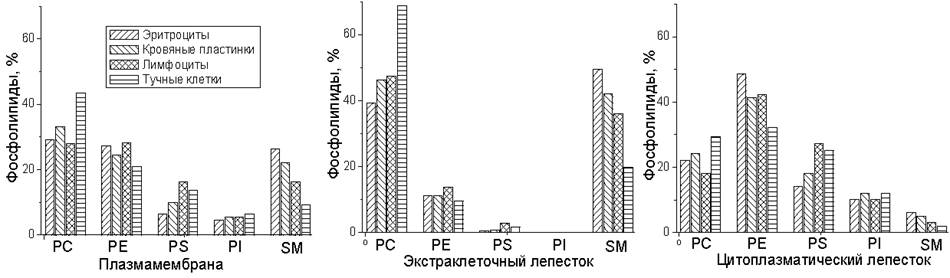
Анализ липидного состава мембран, полученных из различных источников, обнаруживает существенные вариации (табл. 8). Значительная вариабельность в содержании CL связана с различиями количества митохондрий в клетках разнообразных тканей. Наблюдается также большая вариабельность в содержании Chol и SphM.
В представленных данных на примере клеток из различных тканей человека видно, что большинстве случаев в составе плазматической мембраны доминирует фосфатидилхолин, хотя, как видно из предыдущей таблицы (табл. 9), это не является универсальным правилом для всех млекопитающих. При этом PC и SphM доминируют во внешнем монослое плазматических мембран всех клеток, тогда как во внутреннем монослое наблюдается значительное преобладание PE, PS и PI.
Таблица 9. Состав фосфолипидов в мембранах гепатоцитов крысы, полученных из разных субклеточных структур.
Липид |
Мембраны (моль % фосфора) |
||||
Все ткани |
Ядро |
Митохондрии |
Микросомы |
Плазмамембраны |
|
CL |
5 |
- |
15 |
2 |
- |
PE |
25 |
26 |
34 |
22 |
20 |
PI |
7 |
4 |
7 |
8 |
7 |
PS |
3 |
6 |
1 |
4 |
4 |
PC |
51 |
57 |
41 |
59 |
43 |
SphM |
4 |
6 |
2 |
4 |
23 |
LPC |
1 |
- |
1 |
2 |
2 |
Различия состава липидов во внешнем и внутреннем монослоях клеточной мембраны связаны с их биогенезом. Кроме того, различия поддерживаются с помощью ферментов флиппаз, участвующих в АТФ- зависимом процессе транслокации липидов между монослоями. Флиппазы располагаются не только в плазматической мембране, но и в мембранах аппарата Гольджи, где обеспечивают асимметричное расположение липидов и белков в бислоях, которые в форме везикул доставляются к плазматической мембране.
Асимметричное расположение PS в плазматической мембране клеток играет важную роль во многих биологических процессах. Например, при апоптозе асимметричное расположение PS нарушается и этот липид мигрирует из внутреннего монослоя во внешний. Это является сигналом «съешь меня» для активации фагоцитов, которые удаляют отмирающие клетки. Таким образом, асимметричное расположение PS в плазматических мембранах клеток участвует в регуляции иммунного ответа в отношении мертвых или умирающих клеток, включая клетки раковых опухолей.
Липидный состав клеточных органелл также различается. Главной причиной этих различий являются особенности синтеза липидов и их трафика в клетке. Большая часть липидов, включая главные структурные фосфолипиды, церамиды и холестерин, синтезируется в эндоплазматическом ретикулуме. Синтезированные липиды транспортируются в другие части клетки. Так, например, хотя холестерин синтезируется в эндоплазматическом ретикулуме (ЭР), здесь его содержание невелико, поскольку он доставляется к плазматической мембране. Зато ЭР богат такими нетипичными для плазматической мембраны липидами, как DAG, который служит предшественником в синтезе многих липидов. Здесь же присутствует долихол - липид полиизопреновой природы, участвующий в гликозилировании белков и липидов.
Аппарат Гольджи также участвует в синтезе липидов. Он специализируется в синтезе сфинголипидов и производит SM, глюкозилцерамид (GlcCer), лактозилцерамид (LacCer), которые в дальнейшем направляются к плазматической мембране.
Поток мембранного материала, а с ним и липидов, движется не только из цитоплазмы на поверхность клетки, но также и в обратном направлении. Плазматическая мембрана доставляет липиды в цитоплазму в процессе эндоцитоза. Ранние эндосомы мало отличаются от плазматической мембраны, но в дальнейшем они, по мере созревания, теряют холестерин и PS, но обогащаются бис-(моноацилглицеро)фосфатом (BMP), который участвует в процессах слияния эндосом и в гидролизе сфинго- липидов. В процессе созревания эндосом большую роль играют также фосфоинозитол-фосфаты, с одной или несколькими фосфатными группами, прикрепленными в различных положениях к инозитиду, которые играют важную роль в регуляции процессов эндосомального трафика везикул.
Липидный состав митохондрий, особенно внутренней мембраны, образующей кристы, резко отличается от состава остальных частей клетки, но близок к таковому у бактерий. Прежде всего необходимо упомянуть о присутствии в составе внутренней мембраны митохондрий СL, который характерен также для мембран бактериальных клеток. С метаболизмом СL связано также присутствие в мембране митохондрий РА и РG. В мембране практически отсутствуют SphМ и РS, но в них высоко содержание РЕ. Содержание холестерина во внутренней мембране митохондрий обычно мало, хотя исключение составляют клетки, участвующие в синтезе стероидов, у которых холестерин присутствует и в митохондриальных мембранах.
2.4.1. Взаимодействие флавоноидов с фосфолипидным бислоем
Для флавоноидов, так же, как и для многих других биологически- активных веществ, гидрофобность и, соответственно, способность взаимодействовать с биологическими мембранами является одним из необходимых условий проявления фармакологической активности. Однако молекулы флавоноидов, которые являются полифенолами, располагают значительным числом гидроксильных групп, определяющих полярность молекулы и ответственных за проявление слабых кислотных свойств. Обратная корреляция между числом гидроксильных групп и гидрофобностью флавоноидов была показана экспериментально. Кроме того, в исследованиях методом дифференциальной сканирующей микрокалориметрии (ДСК) были обнаружены существенные различия в способности флавоноидов влиять на процессы плавления липидов (рис. 59).
Рис. 59. А - Данные ДСК мультиламеллярных липосом из DMPC, содержащих флавоноиды (флавоноид: липид = 1:1 моль/моль): (а) - контроль DMPC, (б) - липосомы с рутином, (в) - с катехином, (г) - мирицетином, (д) - таксифолином, (е) - кверцетином, (ж) - флоретином. Б - формулы перечисленных флавоноидов.
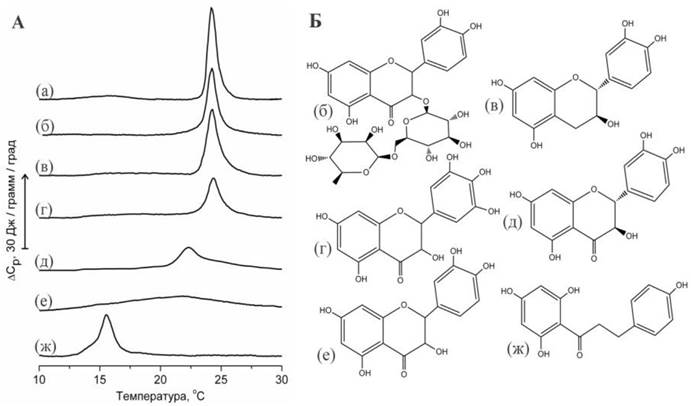
Так, действие гликозидов флавоноидов, например, рутина, на процессы плавления липидов практически не наблюдалось. Это связано с тем, что гликозиды лучше растворимы в воде, чем соответствующие агликоны, и поэтому способны взаимодействовать только с поверхностью липидного бислоя, тогда как их влияние на плавление гидрофобной области незначительно. Такое же незначительное влияние на плавление липидов оказывают катехин и мирицетин - флавоноиды, известные как сравнительно гидрофильные соединения, слабо взаимодействующие с фосфолипидным бислоем.
Влияние таксифолина и кверцетина на плавление липидов было существенно большим. Увеличивалась ширина перехода, в то время как максимум перехода снижался на несколько градусов. Исследования, проведенные с использованием флуоресцентных красителей, показывают, что влияние кверцетина на плавление липида можно охарактеризовать как увеличение вязкости мембраны. Предполагается, что кверцетин локализуется на границе между полярной и неполярной областями бислоя. Действие кверцетина на жидкостные свойства мембраны сопоставимы с действием холестерина, и предполагается возможность проникновения молекул кверцетина в гидрофобную область бислоя и взаимодействие с углеводородными цепями липида.
В соответствии с приведенными термограммами (рис. 59) можно заключить, что действие таксифолина на плавление липидов было меньшим по сравнению с кверцетином. Объяснение обнаруженных различий можно найти при сравнении формы молекул. Предполагается, что плоская молекула кверцетина должна преодолевать меньшие стерические препятствия при проникновении между плотно упакованными углеводородными цепями липида по сравнению с изогнутой молекулой таксифолина.
2.4.2. Локализация флавоноидов в бислое
Сведения о локализации флавоноидов в бислое весьма противоречивы. По мнению некоторых исследователей, они способны проникать глубоко в бислой, однако наличие большого числа гидроксильных групп позволяет молекулам полифенолов образовывать водородные связи с липидами, что способствует их взаимодействию с более полярными областями. В действительности, многое зависит от рН среды, что определяет величину зарядов флавоноидов и липида. Чем ниже величина рН, тем меньше степень депротонирования флавоноидов и тем глубже они способны проникать в бислой.
Катехины, имеющие группы галлата (ECG, EGCG), адсорбируются бислоем в большей степени, чем катехины, не имеющие галлатов (EC, EGC). Различные методы исследования взаимодействия катехинов с липосомами показывают следующий ряд изменения сродства этих веществ к бислою липидов: ECG> EGCG> EC> EGC. Указанный ряд коррелирует с липофильностью этих веществ, величина которой определяется как коэффициент распределения (log P) в системе октанол: вода.
Многие исследования взаимодействия флавоноидов с мембранами проведены с использованием катехинов. После адсорбции бислоем все катехины проникают в область, находящуюся глубже фосфатных групп, и распределяются в плоскости бислоя благодаря латеральной диффузии. Молекулярное моделирование показывает, что в результате проникновения в мембрану происходит возрастание площади бислоя на 0,374 нм2 на каждую молекулу EGCG. При этом с каждой молекулой EGCG взаимодействует в среднем 10,8 молекул липида. Липиды, примыкающие к молекуле EGCG, плотно упакованы и занимают площадь 0,51 нм2, что на 0,14 нм2 меньше, чем для остальных молекул. Все молекулы катехинов склонны к неравномерному распределению в плоскости бислоя и образованию агрегатов. Агрегация катехинов наблюдается как в молекулярных моделях липидного бислоя, так и в экспериментах с искусственными мембранами. Появление агрегатов флавоноидов в бислое может приводить к возникновению дефектов бислойной структуры, нарушению целостности гидрофобного барьера и росту проницаемости мембран.
Находясь в бислое, гидроксильные группы катехинов образуют водородные связи с атомами кислорода в молекулах липида. Чем больше гидроксильных групп, тем прочнее взаимодействие. При этом проницаемость мембран для флуоресцентных красителей, например, кальцеина, может возрастать. Образование водородных связей между катехольными гидроксильными группами флавоноидов и атомами кислорода пероксидов липидов определяет антиоксидантные свойства катехинов. В целом, предполагается, что образование указанных водородных связей может играть значительную роль в антиканцерогенном и антибактериальном действии катехинов.
Исследования ЯМР, проведенные с использованием наноразмерных, изотропно вращающихся фрагментов плоского бислоя фосфолипидов, называемых бицеллами, позволяют проследить процесс взаимодействия катехинов с бислоем. Было показано, что катехины взаимодействуют с бислоем фосфатидилхолина (рис. 60), при этом галлоильная группа ECG или EGCG располагаются в непосредственной близости от группы триметиламмония, принадлежащей молекуле фосфатидилхолина. Поскольку эта группа обладает положительным зарядом, ЯМР позволяет наблюдать ее взаимодействие с π-электронами галлоильной группы. Указанное взаимодействие между катехинами и катионным зарядом молекулы фосфатидилхолина (взаимодействие катион-п) имеет большое значение в стабилизации молекулы полифенола в интерфазной области фосфолипидного бислоя. Ранее аналогичные катион-π взаимодействия между атомами азота фосфатидилхолина и фосфатидилэтаноламина с остатками триптофана мембранных белков исследовались также на примере молекул грамицидина.
Рис. 60. Расположение различных флавоноидов в фосфолипидном бислое. Для простоты показан монослой DOPC. Положение фосфатных и карбонильных групп показано горизонтальными пунктирными линиями. Показано также предпочтительное расположение в монослое эпикатехин-галлата (ECg) из работы, даидзеина (Dai) и генистеина (Gen) из работы, а также кверцетина (Que) и протонированной формы сульфата кверцетина (QueS) из работы. Данные получены на основе рентгеновского рассеяния, ЯМР-спектроскопии и молекулярного моделирования.
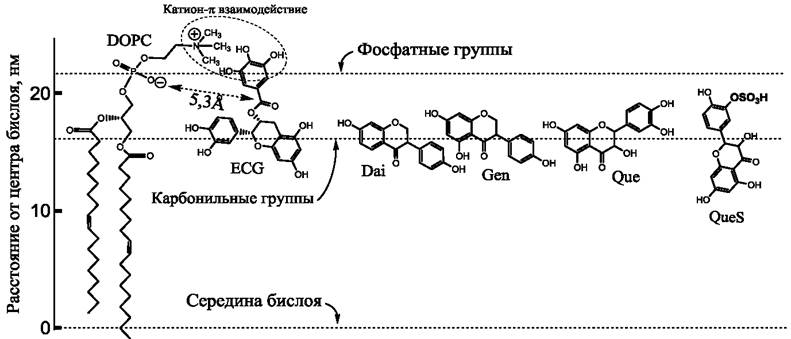
ЯМР-исследования показали также, что молекулы катехинов способны вращаться в бислое вокруг оси, наклоненной к плоскости бислоя под углом приблизительно 55°, при этом расстояние от ближайшей фосфатной группы липида до карбонильного углерода катехина составляет 5,3 ± 0,1 А (рис. 60). Флавоноиды кверцетин, генистеин и даидзеин также располагаются ближе к полярным группам, чем к гидрофобному центру бислоя. При этом, в соответствии с данными недавно проведенных исследований, предполагается, что длинная ось молекулы ориентирована предпочтительно параллельно плоскости бислоя, а плоскость колец перпендикулярна плоскости бислоя. Действие флавоноидов на бислой иногда сравнивают с холестерином, но при этом известно, что длинная ось молекулы холестерина располагается преимущественно перпендикулярно плоскости бислоя.
Присутствие флавоноидов изменяет механические свойства бислоя. Так, при максимальной концентрации генистеина 20 % и даидзеина 14 %, являющейся пределом растворимости этих веществ в липиде, величина модуля сжимаемости бислоя РОРС снижается на 40 %. При этом площадь бислоя возрастает на 8 % и 12 % соответственно. Возрастает способность бислоя к деформации.
Изменения физических параметров бислоя могут быть существенны в объяснении способности генистеина и даидзеина увеличивать продолжительность открытого состояния трансмембранных белковых каналов благодаря снижению энергетического барьера, необходимого для увеличения размеров молекулы при открывании канала. Недавно проведенные исследования влияния флавоноидов на вязкостные свойства мембран клеток нескольких типов лейкоцитов, измеряемые с использованием мембранотропных флуоресцентных красителей, показали способность кверцетина и EGCG увеличивать анизотропию бислоя и рост трансмембранного потенциала, что предположительно, может быть существенно в проявлении антиоксидантных и регуляторных свойств этих флавоноидов.
Известно, что в организме человека и животных флавоноиды могут подвергаться существенным химическим модификациям. В частности, как это более подробно обсуждается в разделе книги, посвященном метаболическим превращениям флавоноидов, молекулы могут метилироваться, сульфатироваться и гликозилироваться. Метилирование одной из гидроксильных групп кверцетина мало влияет на взаимодействие этого флаво- ноида с фосфолипидным бислоем. Значительно большие изменения наблюдаются при сульфатировании и гликозилировании молекул. Так, в нейтральной среде сульфатированная форма кверцетина менее липофильна, чем кверцетин, и располагается ближе к водной поверхности. Однако в кислых средах наблюдается протонирование сульфогруппы, что способствует проникновению молекулы в бислой. Молекула может также развернуться длинной осью поперек бислоя, если она сульфатирована в 3’ или 4’ положении (рис. 60). Присоединение глюкуроновой кислоты значительно сдвигает молекулу к периферии бислоя таким образом, что глюкуроновый остаток располагается в водной фазе. Эти изменения могут снижать антиоксидантные свойства флавоноидов в отношении радикалов, располагающихся в глубине бислоя.
2.4.3. Проникновение флавоноидов через фосфолипидный бислой
Взаимодействие флавоноидов с биологическими мембранами является важным процессом, определяющим их действие на живую клетку. Флавоноиды способны воздействовать на физические свойства фосфолипидного бислоя, изменять термодинамические параметры плавления липидов, а также влиять на процессы перекисного окисления липидов. Большое значение имеет также способность флавоноидов проникать через мембраны клеток и специфически связываться с рецепторами в цитоплазме. Исследование взаимодействия флавоноидов с мембранами актуально также в связи с возможностью использования липосом в медицине для хранения и доставки этих веществ.
Возникает вопрос, способны ли флавоноиды проникать через фосфолипидный бислой, или для их проникновения через мембраны требуются специализированные транспортеры белкового происхождения, которые, как известно, во многих случаях необходимы для проникновения различных веществ в цитоплазму? Для ответа на этот вопрос можно исследовать проникновение флавоноидов через множество бислоев мультиламеллярных липосом, образованных фосфатидилхолином. Можно предположить, что действие флавоноидов на плавление фосфолипидных мембран будет существенно различаться, если флавоноид был добавлен в раствор липидов в хлороформе, т. е. до формирования липосом (добавка изнутри), в сравнении с экспериментом, в котором флавоноид был добавлен к суспензии предварительно сформированных мультиламеллярных липосом (добавка извне). В последнем случае флавоноид будет беспрепятственно взаимодействовать только с наружной мембраной, тогда как для взаимодействия с остальной (большей) частью липида флавоноид должен проникнуть через гидрофобный барьер многочисленных бислоев. Однако было обнаружено, что флавоноид, добавленный к липосомам извне, оказывал примерно такое же действие на плавление липида (рис. 61), как и в случае, когда он был добавлен в хлороформ перед приготовлением липосом, то есть введен в них изнутри.
Рис. 61. Термограмма ДСК, показывающая влияние флавоноида таксифолина (дигидрокверцетина) на плавление липосом из DMPC. А - таксифолин добавлен в раствор липида в хлороформе перед приготовлением липосом («изнутри»). Б - таксифолин добавлен к водной суспензии готовых липосом («извне»). Цифрами указано количество добавленного флавоноида в моль %.
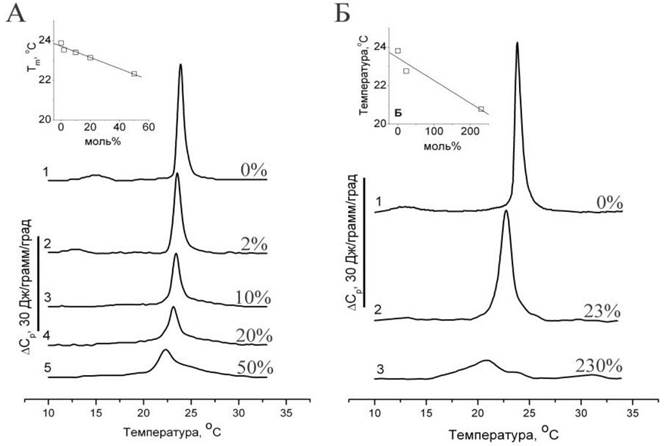
Приведенные выше данные микрокалориметрических измерений свидетельствуют о том, что таксифолин, добавленный в водный раствор, окружающий мультиламеллярные липосомы, способен оказывать влияние на процесс плавления всего липида, независимо от того, входит ли этот липид в состав внешней мембраны липосомы или находится внутри липосомы. Для объяснения наблюдаемого феномена мы можем предложить две гипотезы: 1). Таксифолин разрушает мультиламеллярные липосомы, в результате чего доступность липидов действию таксифолина существенно возрастает. 2). Липосомы сохраняют целостность, но при этом таксифолин способен проникать через бислойные структуры фосфолипидов, благодаря чему он может оказывать влияние на плавление многочисленных мембран, находящихся внутри мультиламеллярных липосом.
Электронная микроскопия замораживания-скалывания (рис. 62) показывает, что в условиях нашего эксперимента в суспензии присутствовали гигантские мультиламеллярные липосомы, как в исходном препарате, так и в присутствии таксифолина. Это свидетельствует о том, что таксифолин в исследуемых концентрациях, добавленный к предварительно сформированным липосомам, не оказывает разрушающего действия на фосфолипидный бислой. В то же время нами было обнаружено, что морфология поверхности скола мембран существенно изменялась.
Рис. 62. Электронные микрофотографии DMPC липосом, полученные методом замораживания-скалывания. Все препараты выдерживали при 37°С в течении 1 ч, после чего охлаждали до 18°С перед криофиксацией. (а) - Поперечный скол мультиламеллярных липосом. (б) - Тот же препарат, показаны гидрофобные поверхности скола, содержащие риппл-фазу. Стрелками указана ступенька, отделяющая скол самого внешнего бислоя от поверхности скола, следующего бислоя, находящегося ближе к центру. (в) - К суспензии липосом добавлен таксифолин 23 моль %. (г) и (д) - Участки поверхности сколов из (б) и (с) соответственно (выделено рамками), представленные с большим увеличением.

Известно, что метод замораживания-скалывания позволяет изучать гидрофобную область фосфолипидного бислоя, поскольку плоскость скола проходит в центре гидрофобной области мембраны между двумя монослоями липидов. При криофиксации от 18-20°С гидрофобная поверхность скола мембран DМРС содержит характерные периодические структуры риппл-фазы. Структуру риппл-фазы можно было наблюдать как на поверхности сколов периферического бислоя, так и на гидрофобной поверхности скола всех бислоев, находящихся внутри везикул (рис. 62).
В присутствии таксифолина, добавленного снаружи к предварительно сформированным липосомам, периодические структуры риппл-фазы не наблюдались, а гидрофобные поверхности скола мембран выглядели гладкими. Такие изменения в равной степени были характерны как для бислоев, находящихся на поверхности, так и для бислоев, находящихся в центральной части мультиламеллярных липосом. Известно, что возникновение риппл-фазы непосредственно связано с физическим состоянием липидов при определенных температурах. Так, в DМРС-липосомах риппл- фаза возникает в интервале температур между предпереходом (13-16°С) и главным фазовым переходом (23-25°С) этого липида.
Различные агенты, влияющие на процесс плавления липида, такие как холестерин или токоферол, могут модифицировать структуру риппл- фазы, изменять температурные границы ее существования. Представленные данные микроскопии, демонстрирующие исчезновение риппл-структур во всех слоях мультиламеллярных липосом, свидетельствуют о том, что таксифолин действительно может проникать через многочисленные бислойные структуры фосфолипида и влиять на фазовое состояние и морфологию мембран. При этом, данные микроскопии свидетельствуют о сохранении мультиламеллярной структуры липосом при всех концентрациях таксифолина, используемых в эксперименте. Проникновение таксифолина через мембраны может объясняться хорошей растворимостью этого вещества в органических растворителях и, следовательно, способностью проникать вглубь гидрофобной области бислоя. Об этом свидетельствует также изменение процессов плавления липидов, регистрируемое ДСК, а также изменения морфологии гидрофобной поверхности скола липосом, наблюдаемые под электронным микроскопом.
2.4.4. Влияние на фазовое поведение липидов
Несмотря на то, что флавоноиды обладают значительным числом гидроксильных групп, их растворимость в воде весьма ограничена. Напротив, как упоминалось выше, имеются многочисленные свидетельства их способности взаимодействовать с биологическими мембранами и проникать в фосфолипидный бислой. С помощью дифференциальной сканирующей микрокалориметрии было показано, что флавоноиды способны также существенно влиять на процесс плавления фосфолипидного бислоя и, предположительно, способны влиять на фазовое поведение и структурную организацию биологических мембран. Недавно нами было обнаружено, что комплексы кверцетина с железом (II) оказывают наибольшее влияние на фазовый переход бислой-гексагональная НII-фаза, характерный для фосфатидилэтаноламина. При этом наблюдается повышение температуры перехода на несколько градусов. Кроме того, комплексы, также, как и свободные флавоноиды, снижают температуру плавления и увеличивают ширину перехода фосфатидилхолина и фосфатидилэтаноламина (рис. 63).
Рис. 63. Действие кверцетина и его комплексов с Fe(II) на фазовые переходы фосфолипидов: димиристоилфосфатидилхолина (DMPC) - А, и пальмитоил-олеоил фосфатидилэтаноламина (POPE) - Б. Исходные липиды (а) плавятся при 24-25°С. Кроме того, при ~ 69°C POPE имеет переход из бислойной структуры в гексагональную НII-фазу. Показаны изменения кривых плавления липидов при действии кверцетина (б), железа (в), последовательной добавки сначала кверцетина, а затем (через 30 мин) железа (г), или готового комплекса кверцетина с железом (д). В экспериментах соотношение липид/кверцетин/Fe = 100:10:1. Среда: 10 мМ Трис-HCl, рН 7,4.
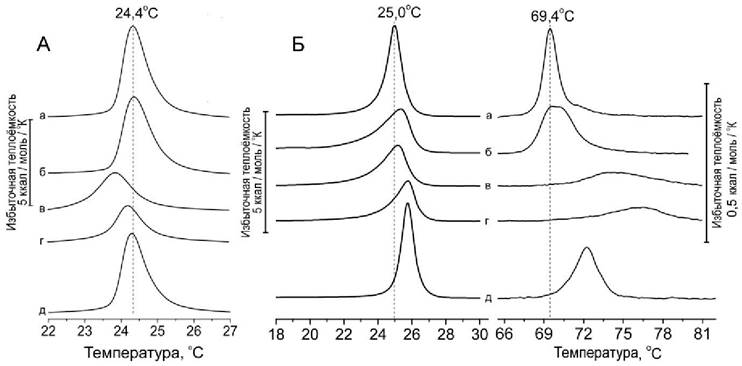
Примечательно, что готовый комплекс кверцетина с железом (II) оказывал слабое влияние на фазовые переходы липидов, что свидетельствует о слабом взаимодействии с фосфолипидным бислоем. Напротив, если вначале к липосомам был добавлен кверцетин, а затем через некоторое время добавлено железо (II), то образующийся комплекс оказывал большее действие, чем кверцетин, что особенно хорошо видно на примере влияния этого комплекса на фазовый переход РОРЕ из бислойной структуры в гексагональную HII-фазу, наблюдаемый исходно при 69°С (рис. 64, б-г). При этом наблюдалось повышение температуры перехода на несколько градусов. Увеличивалась ширина перехода и снижалась его высота.
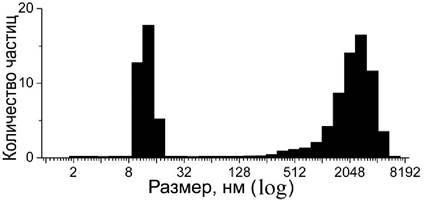
Неспособность готовых комплексов кверцетин-железо взаимодействовать с фосфолипидным бислоем связана с формированием нерастворимых в воде частиц. Фотонно-корреляционная спектроскопия показывает, что при смешивании кверцетина с железом (II) в среде присутствуют частицы двух размеров: малые частицы в области 10-15 нм, и более крупные частицы в области 1-5 мкм (рис. 64).
Рис. 64. Анализ размеров частиц комплексов кверцетин / Fе (II) = 10:1 с помощью фотоннокорреляционной спектроскопии.
2.4.5. Агрегация и слияние мембран
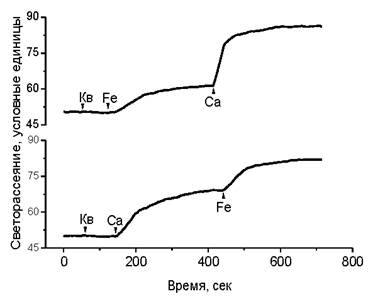
Было обнаружено также явление, связанное с действием комплексов флавоноидов и железа на кальций-зависимые процессы агрегации и слияния мембран. Известно, что в присутствии катионов кальция наблюдается агрегация липосом. В присутствии флавоноидов агрегация липосом наблюдается также под действием катионов двухвалентного железа. Последовательные добавки железа и кальция показывают, что эффекты агрегации суммируются, как это можно наблюдать по светорассеянию суспензии липосом (рис. 65).
Рис. 65. Влияние кверцетина (Кв), двухвалентного железа (Fе) и катионов кальция (Са) на светорассеяние суспензии липосом из фосфатидилхолина. Светорассеяние измеряли под углом 90° на спектрофлуориметре. Концентрация фосфатидилхолина 2 • 10-4 М, кверцетина и железа 1 • 10-5 М, кальция 1 • 10-4 М. Исходный диаметр липосом составлял 100 нм.
Анализ показывает (рис. 66), что при добавлении к липосомам флавоноидов с железом (II) наблюдается лишь незначительное увеличение размеров частиц, исходный диаметр которых составлял 100 нм, тогда как при добавлении флавоноидов, железа и кальция появляется новая фракция значительно более крупных частиц. Электронная микроскопия замораживания-скалывания обнаруживает, что после добавления флавоноидов, железа и кальция между липосомами возникают контакты, а также появляются гигантские липосомы, что свидетельствует о процессах слияния мембран (рис. 67).
Рис. 66. Анализ размеров липосом с помощью фотонно-корреляционнойспектроскопии. К суспензии липосом, диаметром 100 нм, были добавлены флавоноиды: кверцетин (Кв), таксифолин (Такс), катехин (Кат), а также катионы железа (Fе) и кальция (Са). Концентрация фосфатидилхолина 2 • 10-4 М, флавоноидов и железа 1 • 10-5 М, кальция 1 • 10-4М.
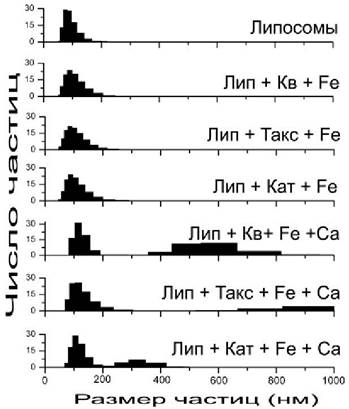
Рис. 67. Электронная микроскопия замораживания-скалывания липосом из фосфатидил- холина (диаметр 100 нм) перед (А) и после (В, С) добавления кверцетина, двухвалентного железа и кальция. Контакты межу липосомами указаны стрелками.
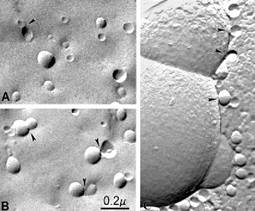
Способности липосом из фосфатидилхолина образовывать агрегаты, обмениваться липидом и сливаться интенсивно исследуются в течение многих лет, поскольку эти явления имеют непосредственное отношение к процессам доставки лекарственных препаратов и генетического материала с помощью липосом. Было обнаружено, что после агрегации липосом под действием различных агентов может активироваться процесс их слияния, что зависит от размера липосом и физического состояния липидов. Однако липосомы из фосфатидилхолина диаметром 100 нм, используемые в данном эксперименте, обычно не обладают способностью спонтанно сливаться, тогда как липосомы меньшего диаметра могут агрегировать и сливаться при температуре выше точки плавления липида, хотя этот процесс занимает многие часы и сутки.
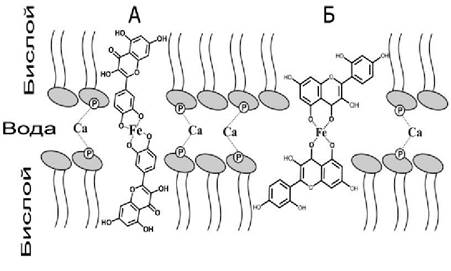
Комплексы флавоноидов с железом обладают большей липофильностью, чем молекулы свободных флавоноидов. Это связано с тем, что полярность гидроксильных групп в молекулах флавоноидов снижается, но при этом наиболее полярной частью молекулы становится атом железа. В соответствии с предложенной нами схемой, комплекс флавоноида с железом 2:1 может образовывать мостик между соседними мембранами липосом. При этом молекулы флавоноидов погружаются в гидрофобную область липидов, а полярная часть комплекса, содержащая атом железа, образует мостик (скрепку) между соседними мембранами. Катионы кальция также могут образовывать мостики между мембранами, но посредством взаимодействия с фосфатными группами. Поскольку эти механизмы взаимодействия между мембранами различны и независимы, их действие суммируется. Необходимо отметить, что для достижения сходной величины агрегации в указанных экспериментах концентрация кальция была в десять раз выше, чем железа и флавоноидов.
Способность полифенольных соединений, например, таннинов, инициировать адгезию мембран хорошо известна. Было показано, что молекулы таннинов способны взаимодействовать с двумя соседними мембранами и образовывать между ними мостики. Эффективность адгезии мембран в присутствии таннинов связана с тем, что эти молекулы достаточно велики, чтобы погружаться в гидрофобные области соседних мембран и образовывать мостик между ними. Напротив, молекулы флавоноидов существенно меньше, и образовывать мостик может только димер флавоноидов, образующийся при формировании комплексов с металлами (рис. 68).
Рис. 68. Модель «металлической скрепки», образуемой комплексом флавоноидов кверцетина (А), морина (Б) и железа (Fe), расположенных между поверхностями двух соседних мембран. Для простоты показано только два соседних монослоя липидов. Показаны также кальциевые мостики между фосфатными группами липидов.
2.4.6. Структурная гетерогенность биологических мембран
2.4.6.1. Липидные рафты
Клеточные мембраны являются сложными мозаичными структурами, обеспечивающими работу многих клеточных систем и реагирующими на изменения окружающей среды. Размеры мозаичных элементов могут находиться в пределах 2-200 нм, что часто затрудняет их непосредственное наблюдение в клетке. Различия в составе липидов наблюдаются в мембранах различного происхождения, как это обсуждалось выше. Даже соседние, рядом расположенные участки одной и той же мембраны могут различаться по составу. Это означает существование латеральной гетерогенности мембран и образование липидных доменов (кластеров) в бислое. Гетерогенность мембран может наблюдаться даже в искусственных бислойных мембранах, образованных из нескольких липидов, отличающихся температурой плавления, или обладающих способностью предпочтительно взаимодействовать друг с другом. Можно ожидать, что в мембранах живой клетки, имеющих сложный состав белков и липидов, а также разнообразную функциональную специализацию, латеральная гетерогенность липидов еще более выражена, чем в модельных системах. Однако исследование липидных доменов в живой клетке чрезвычайно затруднено в связи с проблемами технического характера.
Одними из наиболее интенсивно исследуемых элементов мозаики являются мембранные рафты, которые впервые наблюдали в апикальных мембранах эпителиальных клеток, обогащенных сфингомиелином и холестерином. В последние годы проведено много исследований гетерогенности плазматической мембраны в поисках структурных доменов, называемых рафтами. Липидные рафты образованы плотно упакованными упорядоченными доменами липида, состоящими из холестерина и насыщенных сфинголипидов, которые плавают в «озере» ненасыщенных и более рыхло упакованных липидов. Углеводородные цепи сфинголипидов, входящих в состав рафтов, несколько длиннее цепочек жирных кислот остальных глицерофосфолипидов. Они имеют более высокую температуру плавления, плотно упакованы и находятся в вытянутом состоянии, образуя твердый гель (sо-фаза), из-за чего толщина образованного ими монослоя больше, чем в остальной мембране.
Первоначально существование таких структур было обнаружено в связи с их повышенной устойчивостью к действию неионных детергентов, например, Тритона-Х100, хотя впоследствии стало очевидно, что существующие в мембранах комплексы холестерина, сфинголипидов и специфических белков нельзя однозначно сравнивать с фрагментами мембран, полученными после обработки детергентами. Недавно был достигнут некоторый прогресс в методах получения рафтов при использовании более мягкого детергента Вrij-96, позволяющего, по мнению некоторых исследователей, лучше сохранять нативную гетерогенность бислоя клеточных мембран. Большое значение имеет также присутствие в среде миллимолярных концентраций Мg2+ и К+, а также наномолярных концентраций Са2+. Окончательное определение рафтов как особых областей клеточных мембран, обогащенных холестерином и сфинголипидами, было дано на симпозиуме в Кейстоне. В настоящее время мембранные рафты определяют, как «динамические наноразмерные ансамбли мембранных белков и липидов, обогащенных холестерином и сфингомиелином, которые, благодаря слаженным белок-белковым и белок-липидным взаимодействиям, могут переходить из метастабильного состояния покоя в состояние активного функционирования».
Было показано, что липидные рафты могут участвовать в регуляции различных процессов функционирования клеток, включая защиту от инфицирования вирусами, бактериями и паразитическими организмами. Кроме того, рафты участвуют в процессах апоптоза, инициации иммунного ответа, клеточной сигнализации, транспорта веществ и межклеточной коммуникации. Липидные рафты ответственны за многочисленные патологии, связанные с мембранами, включая процессы воспаления, нарушения иммунного ответа, патологии клеток печени и сердечно-сосудистой системы, атеросклероза и нейродегенерации, развитие вирусной и бактериальной инфекции, инвазии паразитами, например, малярийным плазмодием.
Неспособность липидов смешиваться друг с другом является одной из важнейших причин гетерогенности мембран и образования рафтов. Простейшее объяснение этого явления связано со способностью липидов подвергаться температуро-зависимому фазовому переходу, называемому плавлением. Этот процесс может быть описан как фазовый переход фосфолипидного бислоя из твердого упорядоченного состояния (So) в состояние жидкое и неупорядоченное (Ld). Холестерин способен влиять на процесс плавления фосфолипидов и инициировать формирование промежуточного состояния, известного как жидкое упорядоченное состояние (Lo). Предполагается, что плоская молекула холестерина способна внедряться между молекулами липида, нарушать кристаллическую упаковку углеводородных цепей и инициировать возникновение состояния Lo, в котором латеральная подвижность молекул липида близка к жидкому состоянию, тогда как конформационная подвижность углеводородных цепей липида ограничена и близка к подвижности, характерной для упорядоченного состояния. Этот эффект зависит от молярной концентрации холестерина и от химической природы липида. В присутствии 25-30 моль % холестерина бислойные структуры липидов, образованные из фосфатидилхолина, фосфатидилсерина или фосфатидилэтаноламина, могут образовывать состояние Lo, особенно если углеводородые цепи липида насыщены и достаточно длинны (18-22 атомов углерода). Однако сфингомиелин взаимодействует с холестерином существенно сильнее, чем другие липиды, и обладает способностью сегрегировать в плоскости бислоя и образовывать домены липида (рис. 69), находящегося в состоянии Lo, которые окружены липидом в состоянии Ld. Такая способность липидов к латеральной сегрегации, зависящая от температуры плавления и избирательности взаимодействия, является теоретической и экспериментальной основой для объяснения формирования рафтов.
Рис. 69. Структура рафтов. А - организация липидов в рафте. На внешней поверхности плазматической мембраны рафт изображен как комплекс сфингомиелина (полярные головы черные) и холестерина. Состав монослоя со стороны цитоплазмы, возможно, также отличается от окружающих липидов. Б - организация белков в рафте. Показан тот же участок мембраны. Трансмембранные белки «а» и «б» образуют олигомер и проникают в область рафта. Периферические белки «г» и «д» прикрепляются к молекулам холестерина и гликофосфолипидов (гликофосфатидил- инозитола или гликосфинголипидов), находящихся в рафте. На цитоплазматической стороне белки присоединяются к рафту благодаря прикреплению пальмитиновой кислоты «в».
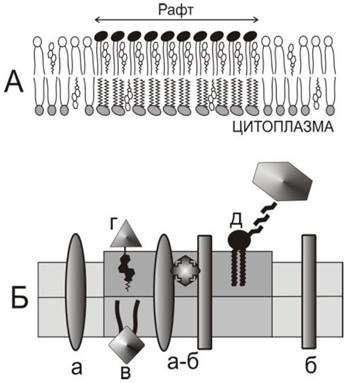
Рафты представляют собой области бислоя, богатые различными мембранными белками. Характерной особенностью этих структур является присутствие белков, заякоренных на молекулах гликосфинголипидов или гликофосфатидилинозитолов, находящихся во внешнем монослое плазматической мембраны. Их обозначают как GPI-AP(Glycophosphatidylinositol anchored proteins). Находясь в бислое, содержащем холестерин, эти белки склонны образовывать короткоживущие димеры, время существования которых составляет около 200 мсек. При повышении концентрации молекулы GPI-AP олигомеризуются в более крупные структуры и обособляются в рафты. Кроме того, многие белки, входящие в состав рафтов, ковалентно связаны с пальмитиновой кислотой (пальмитилированы). Экспериментально показано, что именно пальмитилирование может быть причиной скопления некоторых белков в рафтах, хотя в клетке далеко не все пальмитилированные мембранные белки входят в состав рафтов. Кроме того, в составе рафтов находятся белки, прикрепленные к мембране (заякоренные) через холестерин.
В состав рафтов входят разнообразные белки, участвующие в клеточной регуляции. Среди них можно назвать рецепторы различных веществ и каналообразующие белки. Важным компонентом рафтов может быть также сигнальный белок Hh (Hedgehog - ежик), прикрепляющийся к мембране благодаря пальмитилированию или холестеринированию. Кластеры этого белка в мембране являются элементами клеточной сигнализации, особенно важной в эмбриогенезе. Одна из форм этого белка, SHh (SonicHedgehog), может служить мишенью для терапевтического воздействия при повреждениях тканей мозга, в лечении различных форм рака, сердечно-сосудистых заболеваний.
Компонентом рафтов может быть также рецептор фактора некроза опухолей, TNF-рецептор, обозначаемый как FasR (или как CD95 - cluster of differentiation 95), являющийся частью системы клеточного апоптоза DISC (death-including signaling complex). Показано, что олигомеры этого белка скапливаются в рафтах.
2.4.6.2. Кавеолы и кавеолярный эндоцитоз
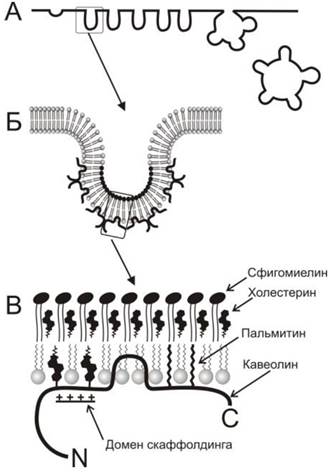
Кавеолы являются особой группой мембранных рафтов, широко распространенных в плазматической мембране клеток эндотелия, гладкой мускулатуры, фибробластов и адипоцитов. Кавеолы участвуют в процессе захвата клетками различных веществ, называемом кавеолин-зависимым эндоцитозом. Кавеолы выглядят как углубления плазматической мембраны диаметром 60-80 нм (рис. 70). Они образуются благодаря полимеризации белков кавеолинов, прикрепленных к мембранным рафтам. Соответственно, в липидном составе кавеол наблюдается повышенное содержание холестерина и сфинголипидов, характерное для рафтов. Кроме кавеолина, эти структуры содержат также белок кавин (называемый также PTRF-Cavin или Cav-p60), присутствующий в зрелых кавеолах и необходимый для их функционирования. Предполагается, что кавин необходим для интеграции кавеолина в кавеолах.
Рис. 70. Схематическое изображение кавеол и их структурной организации. А - на поперечном срезе плазматической мембраны кавеолы выглядят как одиночные углубления или более сложные собрания углублений, образующих грозди, которые проникают в цитоплазму посредством кавеолин-зависимого эндоцитоза. Б - на цитоплазматической поверхности кавеолы прикреплены молекулы кавео- лина. В - более детальное изображение показывает, что экстраклеточная поверхность мембраны кавеолы образована комплексом сфинго- миелина и холестерина как липидный рафт. Молекула кавеолина, прикрепленная с внутренней стороны, имеет гидрофобный домен, который погружается в бислой в форме шпильки. Кроме того, этот белок крепится к мембране благодаря ковалентно связанным остаткам пальмитиновой кислоты и холестерина. Последние крепятся к белку в специализированном участке, называемом доменом скаффолдинга (scaffolding domain), который имеет избыточный положительный заряд.
2.4.7. Регуляторные процессы в рафтах и кавеолах
Попадая в кровь, флавоноиды взаимодействуют с клетками эндотелия, обладающими наиболее высоким содержанием кавеол, через которые происходит регуляция не только метаболизма отдельных клеток, но также различных органов и всего организма. Имеется несколько механизмов осуществления такой регуляции. Так, в кавеолах содержится фермент эндотелиальная синтаза окиси азота (eNOS - endothelial nitric oxide synthase), продуцирующая окись азота из аргинина. Образующийся NO является важной сигнальной молекулой, регулирующей секрецию инсулина, работу гладкой мускулатуры, и соответственно, перистальтику органов пищеварительного тракта, желчевыводящих и мочевыводящих путей, поддерживающей тонус кровеносных сосудов и кровяное давление. Избыточная продукция окиси азота может вызывать развитие воспалительных процессов. Показано, что eNOS может непосредственно взаимодействовать с кавеолином-1, при этом наблюдается ингибирование ферментативной активности eNOS. Таким же действием обладает синтетический пептид, соответствующий участку молекулы кавеолина, называемому «домен скаффолдинга». Недавно совместная локализация eNOS и кавеолина-1 в плазматической мембране и мембранах аппарата Гольджи была показана с помощью конфокальной микроскопии эндотелиальных клеток, что является прямым свидетельством существования связи между этими белками в живой клетке.
С кавеолином взаимодействует также белок теплового шока Hsp70 (70 kilodalton heat shock protein). Было показано, что eNOS также может связываться с Hsp70. При этом ферментативная активность eNOS повышается и уровень окиси азота растет. Таким образом, в кавеолах существует баланс комплексов eNOS/кавеолин-1 и eNOS/Hsp70, определяющий уровень окиси азота в тканях. Этот баланс можно регулировать, используя лекарственные препараты статины, которые восстанавливают нормальный уровень окиси азота, повышая содержание комплексов eNOS/Hsp70 путем повышения экспрессии eNOS и Hsp70 и снижения экспрессии кавео- лина-1. Напротив, при патологиях, связанных со значительным снижением экспрессии кавеолина-1, происходит активация eNOS, повышается уровень окиси азота, что вызывает повышение кровяного давления.
В кавеолах находится также рецептор эстрогена ERα (Estrogen receptor alpha). Его локализация совпадает с кавеолином-1. Именно кавеолин способствует доставке ERα на плазматическую мембрану. Показано, что при активации рецептора ERα посредством 17β-эстрадиола сигнал передается на кавеолин, который активирует регуляторный путь фосфатидилинозитол-3-киназы (PI3 kinase), что приводит к активации eNOS и повышению производства NO.
Активация eNOS, наблюдающаяся при недостатке кавеолина-1, может приводить к разобщению окислительного фосфорилирования в митохондриях и повышению уровня перекиси водорода. При этом кавеолин инициирует образование кластеров цитохром-b5-редуктазы, которая образует комплексы с молекулами кавеолина, что можно отнести к наиболее ранним проявлениям окислительного стресса, приводящего к апоптозу. Было также обнаружено, что гиперпродукция кавеолина, наблюдающаяся в раковых клетках, может служить защитой от окислительного стресса в процессе канцерогенеза.
В кавеолах могут находиться также другие ферменты и сигнальные белки, которые во многих случаях взаимодействуют с доменом скаффол- динга кавеолина-1. К ним относятся G-белки, аденилатциклаза, фосфатидилинозитол-3-киназа, протеинкиназы А, С, Src, H-Rac. В кавеолах присутствует также множество рецепторов, связанных с G-белком (GPCRs - G protein coupled receptors). Среди них следует назвать рецептор эндотелина ETB, рецептор ангиотензина II.
В кавеолах присутствует также рецептор фактора некроза опухолей TRAF-2 (TNF-receptor associated factor). TRAF-2 активируется фактором некроза опухолей TNF-α, связывается с кавеолином-1, после чего происходит активация ядерного фактора NF-kB, регулирующего транскрипцию ДНК и участвующего в развитии воспалительных процессов, инфекции вирусами и бактериями.
Кавеолы участвуют также в регуляторных процессах с участием продуктов метаболизма арахидоновой кислоты. Так, в кавеолах присутствует фосфолипаза А2, высвобождающая арахидоновую кислоту из соответствующих фосфолипидов. Этот процесс может участвовать в продукции фактора гиперполяризации эндотелия EDHF(endothelial-derived hyperpolarizing factor), малоизученного агента, участвующего в релаксации гладкой мускулатуры. В кавеолах присутствует также циклооксигеназа-2 (COX-2), пробразующая арахидоновую кислоту в простагландины (PG), также находящиеся в кавеолах. Кроме того, COX-2 участвует в канцерогенезе и процессах воспаления. Содержание COX-2 в кавеолах может существенно повышаться в раковых клетках. Было также показано, что в клетках рака прямой кишки снижение содержания кавеолина сопровождается повышением содержания COX-2. Предполагается, что кавеолин связывает COX-2 и способствует эндоцитозу и деградации этого фермента в цитоплазме.
В исследовании кератиноцитов было обнаружено, что в кавеолах присутствуют фосфолипаза D2 и аквапорин. Предполагается, что комплекс аквапорина и фосфолипазы D2 может участвовать в работе кератиноцитов. При недостатке содержания аквапорина в мембранах кератиноцитов может наблюдаться нарушение целостности кожных покровов, повышение их проницаемости для токсических веществ. Комплекс аквапорина и фосфолипазы D2 может участвовать в метаболизме биоактивного липида фосфатидилглицерина, необходимого для нормального функционирования кератиноцитов.
Кавеолы и липидные рафты участвуют в регуляции содержания Са2+ в цитоплазме. Предполагается, что в рафтах происходит образование кластеров кальциевых каналов, позволяющих регулировать их проводимость и, благодаря этому, контролировать содержание кальция в цитоплазме. В кавеолах находится целый ряд белков, участвующих в регуляции транспорта кальция через мембрану. К ним относятся кальциевые каналы L-типа, Na+/Ca2+-обменник (NCX1), Ca2+-насос плазматической мембраны. Регуляция этих белков, возможно, осуществляется с участием кавеолина. В скелетных мышцах комплекс, ответственный за высвобождение кальция из саркоплазматического ретикулума ассоциирован с кавеолином-3. В гладких мышцах регуляция входа кальция осуществляется с участием кавеолина-1. В гладких мышцах дыхательных путей внутриклеточный кальций участвует в процессах мышечного сокращения. Повышенная реактивность гладких мышц может приводить к развитию астмы. Развитие патологических процессов связано с нарушением регуляции уровня кальция в клетках с участием кавеолина-1, содержание которого в мембранах регулируется цитокином TNF-α причем рецептор TNF-αтакже находится в кавеолах. В кардиомиоцитах содержание внутриклеточного кальция регулируется с участием фосфолипазы Сβ-Gα, которая находится в кавеолах, где присутствует комплекс кавеолин-3Gα(g). Эксперимент показывает, что наблюдающиеся в кардиомиоцитах волны кальция подавляются при разрушении этого комплекса, что свидетельствует о его роли в регуляции содержания кальция в кардиомиоцитах.
2.4.8. Взаимодействие флавоноидов с рафтами и кавеолами
В крови флавоноиды транспортируются альбуминами и липопротеинами, которые взаимодействуют с плазматической мембраной клеток эндотелия и могут попадать в рафты, а также образующиеся из рафтов кавеолы. Действительно, в литературе имеется много свидетельств участия кавеол в эндоцитозе и трансцитозе липопротеинов низкой плотности (LDL) и альбуминов, что свидетельствует о возможности доставки флавоноидов непосредственно в эти области мембраны. Попав в область липидных рафтов или кавеол, флавоноиды могут влиять на функционирование регуляторных систем, находящихся в этих мембранах, о которых упоминалось выше. В последние несколько лет было выдвинуто много предположений относительно того, что именно делают флавоноиды в мембранах. Большинство работ было сделано с использованием катехинов зеленого чая, влияние которых на клетку наиболее выражено. Это прежде всего относится к эпигаллокатехин-галлату (EGCG).
Способность EGCG взаимодействовать с мембранными рафтами и влиять на клеточную сигнализацию с участием кавеол исследовалась во многих лабораториях, поскольку указанные процессы могут участвовать в подавлении воспалительных процессов в клетках эндотелия. В частности, снижая экспрессию кавеолина-1 и циклооксигеназы COX-2, EGCG подавляет активность клеток эндотелия, вызванную действием линолиевой кисоты. Этот эффект связан с ингибированием киназы ERK1/2 сигнальной системы MAPK и киназы Akt. Способностью ингибировать экспрессию кавеолина-1 и активировать в кавеолах сигнализацию через киназы PI3K и Akt, ответственные за развитие апоптоза и различные формы канцерогенеза, обладает также флавоноид даидзеин.
Рафты содержат рецептор ламинина - гликопротеина, присутствующего в составе структурного каркаса, окружающего клетки большинства тканей. В клетках раковых опухолей содержание рецептора ламинина повышено, что способствует росту метастазирования и инвазивной активности этих клеток. Было обнаружено, что EGCG зеленого чая влияет на структуру мембранных рафтов, препятствуя связыванию фактора роста эпителия (EGF) с рецептором этого белка (EGRF), находящегося в мембранных рафтах. Избыточная активность последнего может вызывать рак. Влияние флавоноидов на рафты может иметь огромное значение, поскольку в этих доменах мембраны содержатся киназы семейства MAP, ответственные за регуляцию клеточного апоптоза и развитие канцерогенных процессов.
На клетках множественной миеломы было показано, что EGCG может вызывать апоптоз раковых клеток, не влияя на жизнедеятельность здоровых клеток, благодаря взаимодействию с рецептором ламинина 67RL, количество которого существенно возрастает в клетках миеломы в сравнении с нормальными мононуклеарными клетками крови. В результате взаимодействия с 67RL происходила кластеризация липидных рафтов. Кроме того, EGCG инициировал перенос на плазматическую мембрану кислой сфингомиелинидазы (aSMase) и фосфорилирование протеинкиназы С∆ (РКС∆) в области Ser664. Благодаря этому включался специфический механизм внутриклеточной сигнализации, что впоследствии приводило к апоптозу клеток миеломы.
Процесс кластеризации белков рафтов под действием EGCG или суммарного экстракта флавоноидов зеленого чая наблюдался также в клетках аденокарциномы прямой кишки человека. Однако в этом случае исследователи с удивлением обнаружили рост жизнеспособности клеток. Указанный эффект исчезал при удалении холестерина из мембран, что свидетельствует о роли рафтов в этом процессе. Экспериментальные данные свидетельствуют о том, что в данном случае наблюдалась активация сигнального пути через митоген-активируемые протеинкиназы MEK и ERK1/2, ответственные за пролиферацию и дифференциацию клеток.
Защитное действие EGCG против атеросклероза связано с подавлением процессов воспаления клеток эндотелия. Ключевую роль в этом процессе играет гемоксигеназа-1 (HO-1), которая концентрируется в кавеолах эндотелия. Было обнаружено, что EGCG способен накапливаться в кавеолах, что приводит к вытеснению кавеолина с внутренней поверхности мембраны в цитоплазму. Это может приводить к увеличению продукции ядерного фактора транскрипции Nrf2 (Nuclear factor 2), который известен как компонент первичной защиты клетки от окислительного стресса. В результате была обнаружена экспрессия факторов защиты от окислительного стресса, таких как гемоксигеназа (НО-1) и билирубин, что свидетельствует об активации защитных механизмов и снижении интенсивности воспалительных процессов в клетках эндотелия.
Белковые агенты: фактор роста гепатоцитов (HGF - hepatocyte growth factor) и его рецептор c-Met, обладающий активностью тирозинкиназы, являются элементами регуляторной системы, участвующей в инвазии и метастазировании большинства видов рака человека. Было обнаружено, что EGCG способен предотвращать фосфорилирование тирозинов рецептора c-Met. Аналогичной активностью обладал также эпикатехин-галлат (ECG), но не эпигалакатехин (EGC) или эпикатехин (EC) зеленого чая. Было показано, что в клетках рака простаты c-Met попадает в рафты только после фосфорилирования. Таким образом, катехины, обладающие галлоиловой группой, предотвращают активацию рецептора c-Met, что приводит к нарушению структуры и функционирования липидных рафтов. Активностью в отношении c-Met обладает также флавоноид лютеолин, который блокирует HGF-зависимое фосфорилирование c-Met в рафтах.
Желчные кислоты образуются из холестерина путем окисления с участием цитохрома Р450. Вместе с желчью они попадают в двенадцатиперстную кишку, а затем реадсорбируются в подвздошной кишке с участием транспортера ASBT (apical sodium bile acid transporter). EGCG, но не другие катехины зеленого чая, ингибирует работу ASBT, что приводит к снижению содержания холестерина в организме в результате нарушения его реадсорбции в кишечнике. Происходит снижение скорости процесса транспорта желчных кислот (Vmax) и снижение содержания ASBT во фракции липидных рафтов, тогда как общее содержание ASBT в мембранах кишечного эпителия (клеток Coco) не изменялось. Таким образом, было показано, что гипохолестеринемический эффект EGCG зеленого чая связан с действием этого агента на липидные рафты, приводящим к нарушению функционирования транспортера ASBT.
В условиях ишемии мозга важна доступность лекарственных веществ к пораженному участку. Этому препятствует гематоэнцефалический барьер (BBB), образованный эндотелием сосудов мозга. Было показано, что полифенолы зеленого чая повышают проницаемость BBB в области поражения, вследствие чего существенно улучшается состояние пораженных тканей. Исследования показали, что причиной повышения проницаемости BBB является снижение экспрессии кавеолина-1, приводящее к уменьшению содержания этого белка в плазматической мембране клеток эндотелия. Наблюдается также повышенная экспрессия и рост уровеня фосфорилирования присутствующих в рафтах киназ ERK1/2, регулирующих пролиферацию клеток.
Угнетающее действие полифенолов зеленого чая на экспрессию кавеолина-1 может защищать клетки аорты от патологических изменений, связанных с потреблением жирной пищи. Указанное действие можно объяснить влиянием этих флавоноидов на мембранные рафты, сопровождающимся активацией киназы ERK1/2 и ингибированием митоген-активируемой протеинкиназы p38 MAPK, что свидетельствует о подавлении аутоиммунных и воспалительных процессов.
Кверцетин также может влиять на регуляторные системы, расположенные в кавеолах. Противовоспалительное действие кверцетина связано не только с его антиоксидантной активностью и ингибированием продукции окиси азота, но также со способностью разрушать рафты и вследствие этого подавлять регуляторные функции различных киназ, среди которых можно назвать c-Jun, p38, Akt, Src, JAK-1, Tyk2, NF-kB. Кроме того, кверцетин оказывает ингибирующее действие на серин / треониновые и тирозиновые фосфатазы. Так, кверцетин блокирует способность токсичных полихлорированных дифенилов (ПХД) стимулировать кавеолин-зависимые сигнальные системы, инициирующие воспалительные процессы и развитие атеросклероза. Известно, что в кавеолах присутствует рецептор ПДХ (рецептор ариловых гидрокарбонов AHR), активация которого инициирует экспрессию кавеолина, окислительный стресс и экспрессию цитохрома Р450 1А1 (или CYP1A1). Кверцетин способен блокировать эти изменения и приводить к снижению экспрессии кавеолина и цитохрома Р450. Наблюдается также блокирование индукции молекул клеточной адгезии (VCAM-1), селектинов Е и С. Таким образом, защитное действие кверцетина непосредственно связано с его влиянием на кавеолы. Однако действие кверцетина нельзя сводить только к процессам разрушения рафтов. Так, на клетках рака прямой кишки было показано, что кверцетин способен перемещать в рафты рецепторы клеточной смерти DR4 и DR5, что способствует их взаимодействию с цитокином TRAIL (tumor necrosis factor-related apoptosis-inducing ligand) и активирует апоптоз клеток рака. Способность восстанавливать экспрессию кавеолина-1 и рецепторов ангиотензина AT-1 была обнаружена также при действии флавоноидного фитоэстрогена генистеина на организм крыс с экспериментально вызванной гипертензией после овариоэктомии.