Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Разветвление пептидных цепей
Цистин является единственной аминокислотой, обладающей двумя d-аминогруппа ми и двумя d-карбоксильными группами. В связи с этим он способен образовывать мостики между двумя параллельными пептидными цепями (формула I) и таким образом соединять их друг с другом (формула II) или же обусловливать возникновение петель (формула III):
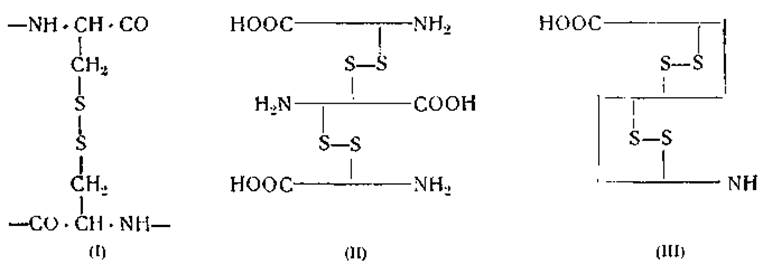
Дезагрегацию молекулы кератина при воздействии восстанавливающих агентов, например сульфита, приписывают тому, что эти агенты разрывают мостики, образованные дисульфидными группами цистина (формула II). Однако при окислении входящих в состав яичного альбумина сульфгидрильных групп цистеина с образованием дисульфидных групп цистина молекулярный вес яичного альбумина не меняется [79]. Заметно не меняется и вязкость растворов яичного или сывороточного альбумина после обработки их перйодатом, обусловливающим полное окисление дисульфидных мостиков цистина [80, 81]. Эти данные свидетельствуют о том, что структура указанных белков скорее соответствует формуле (III), чем формуле (II). Такое заключение вытекает и из того, что окисление дисульфидиых связей не ведет к дезагрегации яичного или сывороточного альбумина.
1 Это возражение автора против признания наличия циклических структур в белках основано на данных его работы, выполненной в 1938 г. Однако после этого было показано, что при расщеплении амидинных связей ферментами одновременно происходит полный разрыв кольца (Л. Н. Акимова, Успехи xимии, XIX, 714, 1950), в связи с чем указанное возражение отпадает.— Прим. ред.
До сравнительно недавнего времени считалось, что в глутаминовой кислоте, которая представляет собой дикарбоновую кислоту, только d-карбоксильная группа может служить для образования пептидной связи. Установление структуры глутатиона, являющегося трипептидом глутамилцистеилглицином, показало, однако, что у-карбоксильная группа глутаминовой кислоты может образовывать пептидную связь, так как в глутатионе глутаминовая кислота соединена с цистеином именно за счет у-карбоксильной группы. Подобного рода связи были также найдены в полимерах глутаминовой кислоты, входящих в состав соединений, образующих капсулу бацилл сибирской язвы [82]. На основании этих данных было высказано предположение, что карбоксильная группа в боковой цепи глутаминовой кислоты и амидная группа в боковой цепи глутамина могут образовывать связи с функционально активными группами других аминокислот, обусловливая таким образом разветвление пептидных цепей [5, 37]. По имеющимся данным, образование разветвленных пептидных цепей за счет связей дикарбоновых и диаминокислот определяет характерные свойства коллагена и желатины [83]. При расщеплении трипсином! казеина и других белков образуются небольшие количества у-глутамилпептидов, наличие которых может быть обнаружено при окислении их NaOBr или хлорамином Т; в результате окисления образуются пептиды, содержащие янтарную кислоту [37, 84]. Необходимо, однако, еще показать, что у-карбоксильные группы глутаминовой кислоты действительно образуют разветвления пептидных цепей в белках, как это показано в формуле (IV), а не образуют соединений, подобных тем, которые обозначены формулой (V).
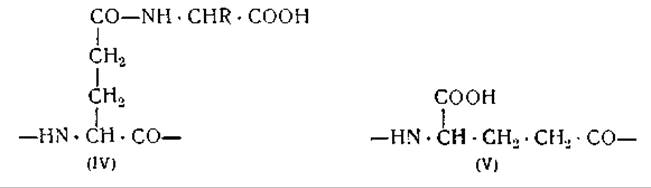
Для того чтобы закончить рассмотрение вопроса о разветвлениях пептидных цепей, нужно еще указать на то, что, по мнению некоторых авторов [69, 85], разветвление может быть обусловлено уреидными остатками. Уреидные остатки могут образовывать мостики при соединении карбоксильной группы с двумя соседними аминогруппами по типу R ∙ NH ∙ СО ∙ NH ∙ R'.
Предположение о наличии уреидных группировок в белках было высказано на том основании, что при гидролизе белков образуется небольшое количество углекислоты. Карбаминовые кислоты, как правило, легко образуются при взаимодействии аминокислот и углекислоты, а пептиды, содержащие карбаминовые кислоты, при гидролизе дают углекислоту и аммиак, согласно следующему уравнению [86]:
R ∙ СО ∙ NH ∙ СО ∙ NH ∙ R' → RCOOH + NH3 + СO2 + HaNR'.
Надо, однако, указать, что значительная часть углекислоты, образующейся при гидролизе белков, может происходить из ионов НСО3-, адсорбированных положительно заряженными группами белков [87].