Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Солевые и водородные связи в белках
Из данных, приведенных в предыдущих разделах, ясно, что разветвление пептидных цепей и циклизация играют лишь второстепенную роль в структуре глобулярных белков. Складчатость длинных пептидных цепей обусловлена, по всей вероятности, не прочными химическими связями, а более слабыми связями, возникающими при взаимном притяжении ионных и полярных групп. Ранее уже подчеркивалось, что белки содержат положительно и отрицательно заряженные группы. Противоположно заряженные группы притягиваются друг к другу под действием электростатических сил. Подобным же образом, в результате дипольной ассоциации, будут притягиваться друг к другу диполи (см. фиг. 22). Взаимное притяжение ионных групп изменяется пропорционально r2 (где r — расстояние между ионными группами), способность же диполей связываться друг с другом изменяется пропорционально r6 или г7. Это обозначает, что силы, действующие между диполями, эффективны только в том случае, если расстояния между ними очень невелики. Соединение за счет диполей может происходить, таким образом, только тогда, когда они тесно прилегают друг к другу [95].
Электростатические силы, обусловливающие связь между ионами и диполями, определяют также образование так называемых водородных связей [96, 97]. Большинство водородных связей в белках возникает между иминогруппами, входящими в состав пептидных связей одной цепи, и карбонильными группами пептидных связей другой цепи:
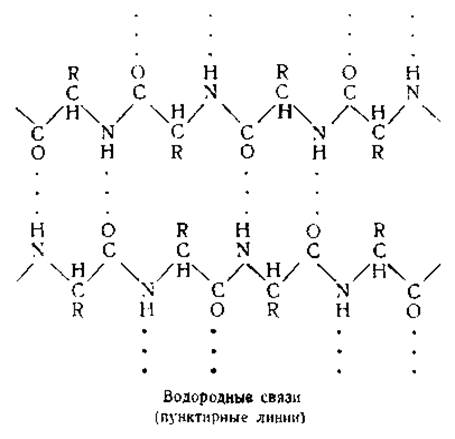
Структура водородной связи видна из следующей электронной формулы:
![]()