Химия и биология белков - Ф. Гауровитц 1953
Сложные белки
Гемоглобин
Простетической группой гемоглобина и других подобных белков является гем, представляющий собой комплекс порфирина с железом. Интенсивное и тщательное изучение гемоглобина было обусловлено, с одной стороны, его биологической ролью в качестве переносчика кислорода, с другой — тем, что он очень легко может быть получен в кристаллическом виде и имеет интенсивную окраску, дающую возможность проводить колориметрические определения. Очень важное значение имеет и то обстоятельство, что изменения в нативном состоянии гемоглобина могут быть легко уловлены по изменению его окраски и спектра поглощения. В нашу задачу не входит рассмотрение структуры гема и различных порфиринов; дальнейшее изложение будет посвящено поэтому только тем вопросам, которые касаются структуры и свойств белка, входящего в состав гемоглобина.
Для получения препаратов гемоглобина центрифугируют цельную кровь, удаляют плазму и промывают кровяные тельца изотоническим раствором соли. Затем их гемолизируют прибавлением воды, диэтилового эфира или толуола [118—120] и центрифугируют для осаждения стромы. Если для гемолиза красных кровяных телец был применен эфир или толуол, то значительная часть стромы остается взвешенной между водным слоем и слоем органического растворителя. В этих случаях раствор гемоглобина может быть отделен при помощи сифона. Осаждение гемоглобина из его растворов производится путем осторожного прибавления спирта при низкой температуре. Некоторые гемоглобины почти нерастворимы в не содержащей солей воде и осаждаются в кристаллическом виде при диализе; другие можно осадить, пропуская через их растворы ток кислорода и углекислоты (углекислота служит для поддержания слегка кислой реакции раствора). Простетическая группа гемоглобина, отщепляющаяся при действии на гемоглобин кислот, одинакова у всех гемоглобинов и миоглобинов. Она носит название протогема и представляет собой соединение протопорфирина с железом.
Белковым компонентом гемоглобина является белок глобин. Хотя чистый гемоглобин был выделен еще в 1867 г., нативный глобин был получен только в 1926 г. Все ранее полученные препараты глобина, как это показали Хилл и Холдэн [121], представляли собой денатурированный глобин.
Нативный глобин получается при осторожном прибавлении разведенной соляной кислоты [121] или щавелевой кислоты [122] к раствору гемоглобина. Отщепляющийся при этом гемин извлекается диэтиловым эфиром; возможно также осадить нативный глобин в избытке ацетона [122—124].
Денатурированный глобин, получаемый старыми методами, соединяется с восстановленным протогемином, образуя гемохромоген; при смешении же нативного глобина с протогемином и восстановителем при pH 8—9 вновь образуется гемоглобин [121]. Глобин отличается от большинства других белков высоким содержанием гистидина (см. табл. 1), количество которого в разных препаратах глобина достигает 6-—10% по сравнению с2—3% в большинстве других белков. В связи с высоким содержанием гистидина изоэлектрическая точка глобина лежит при pH 6,8—7,0; изоэлектрическая точка денатурированного глобина лежит выше, вблизи pH 8,0. Нативный глобин растворим в широких пределах pH, денатурированный же глобин выпадает в осадок при слабой щелочной реакции; этим можно воспользоваться для отделения денатурированного глобина от нативного.
Хотя гем сам по себе является очень нестойким соединением и тотчас же окисляется кислородом воздуха с образованием гемина, соединение гемоглобина с кислородом не влечет за собой окисления железа, которое в образовавшемся оксигемоглобине также является двухвалентным. В связи с этим присоединившийся к гемоглобину кислород легко отщепляется в вакууме. Из этих данных ясно, что глобин предохраняет железо гема от перехода из закисной формы в окисную [125], делая возможным образование соединения типа НbО2. Поскольку никакой другой белок не может заменить глобин в указанном отношении, следует допустить, что глобин содержит, вероятно, специальную «гемаффиновую» группу или же обладает особым расположением молекулярных групп, соединяющихся с гемом [126, 127].
«Синтетический» гемоглобин, приготовленный путем соединения нативного глобина с гемом, отличается от природного гемоглобина большей чувствительностью к нагреванию [128] и к действию растворов едкого натра [129]. В других же отношениях, в частности по способности соединяться с кислородом, он не отличается от нативного гемоглобина.
Молекулярный вес гемоглобина крови млекопитающих животных равен 66 000—68 000. Поскольку все гемоглобины содержат 0,34% железа, количество последнего в 1 моле гемоглобина равно 230 г и, следовательно, на 1 молекулу гемоглобина приходится 4 атома железа. Так как каждая молекула гема содержит 1 атом железа, то, следовательно, в молекулу гемоглобина входят 4 молекулы гема, представляющие его простетическую группу [130, 131].
При действии на гемоглобин мочевины [132], разведенной соляной кислоты [133] или солей [134] молекула гемоглобина дезагрегируется с образованием частиц, имеющих молекулярный вес 34 000. Дезагрегация происходит также при получении нативного глобина из гемоглобина под действием соляной кислоты [135]. Все эти данные дают полное основание считать, что молекула гемоглобина состоит из четырех более мелких субъединиц, каждая из которых содержит 1 молекулу гема в качестве простетической группы. Реакция этих субъединиц с такими большими ионами, как ионы железосинеродистого калия, указывает на то, что гем расположен на их поверхности [136].
Исследование спектров поглощения кристаллов гемоглобина при различном положении оптических осей кристаллов дало возможность заключить, что в молекуле гемоглобина все четыре группировки гема расположены параллельно [137]. Молекула гемоглобина имеет форму цилиндра высотой 33,5 и диаметром 57 Å; молекулы гема расположены, повидимому, на поверхности цилиндра. Красные кровяные тельца содержат около 34% гемоглобина, т. е. максимально возможное количество, при котором гидратированные цилиндры гемоглобина еще способны свободно вращаться вокруг трех своих осей [139].
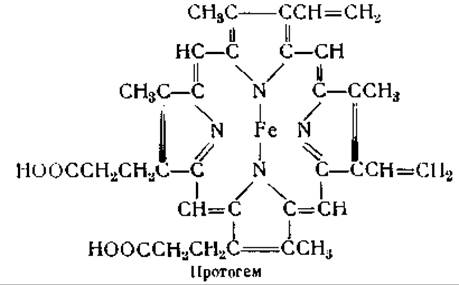
Структура гемоглобина и его производных может быть выражена следующими формулами, в которых 4 атома азота представляют соответствующие кольца порфирина:

Боковые цепи протогема не имеют значения для образования гемоглобинов, так как последний может быть получен и в том случае, когда глобин соединяется не с протогемом, а с диметиловым эфиром мезогема, в котором ненасыщенные винильные группы протогема замещены насыщенными группами, а карбоксильные группы — метальными [128]. Хотя это нельзя еще считать окончательно установленным, все же большинство авторов придерживается того мнения, что в гемоглобине железо гема соединено с имидазольной группировкой гистидина. Это мнение подтверждается следующими данными: 1) гемин легко образует соединения с имидазольными группировками; 2) соединения гистидина с кобальтом могут обратимо присоединять кислород; 3) сродство гемоглобина к кислороду заметно меняется при изменении pH от 5 до 8, т. е. в той области pH, в которой титруются имидазольные группировки [116]. Способность гемоглобина соединяться с основаниями в указанных пределах pH также значительно меняется после присоединения кислорода [116, 142]. При образовании оксигемоглобина значения pH сдвигаются с 7,93 до 6,68 и с 5,25 до 5,75 [116]. Это означает, что в нейтральных растворах оксигемоглобин может присоединять больше оснований, чем гемоглобин, тогда как в кислых растворах отношения будут обратные [143].
Все указанные факты, как уже упоминалось выше, подтверждают предположение о том, что железо гема соединено с имидазольной группой гистидина. Известно, однако, что спектры поглощения гемоглобина и оксигемоглобина, легко смещающиеся при воздействии разведенных кислот, устойчивы к действию концентрированных растворов щелочей [144]. Эти последние данные свидетельствуют, скорее, в пользу того, что железо гема соединено с кислотной группой, например с карбоксильной [126] или сульфгидрильной. Сульфгидрильные группы не обнаруживаются в нативном глобине при нейтральной реакции раствора; они появляются, однако, при подщелачивании растворов глобина [145] или при денатурации его [146].
Характер связей атомов железа в молекуле гемоглобина был в известной степени выяснен путем определения их магнитных моментов. Ион двухвалентного железа имеет 4 непарных электрона, ион же трехвалентного железа имеет 5 таких электронов. Каждый из этих электронов обладает спином, и, следовательно, мы можем измерить результирующий магнитный момент. Если число непарных электронов в молекуле или ионе равно и, то величина магнитного момента, выраженная в магнетонах Бора, будет равна:
![]()
Из приведенного равенства легко определить, что магнитный момент двухвалентного иона железа равен 4,9 магнетона, а трехвалентного иона — 5,9 магнетона. При определении магнитных моментов гемина и гема были найдены величины, равные соответственно 6 и 4,7 магнетона [147, 148]. Отсюда следует, что как в гемине, так и в геме, железо присутствует в виде соответствующих ионов. То же верно и в отношении гемоглобина [148]. Оксигемоглобин и карбоксигемоглобин являются, однако, диамагнетиками, т. е. не обнаруживают никакого магнитного момента [148]. Это свидетельствует о том, что электронные орбиты иона железа при присоединении кислорода или окиси углерода подвергаются глубокому изменению. Можно думать, что все непарные электроны железа гемоглобина принимают участие в образовании оксигемоглобина или карбоксигемоглобина, в связи с чем последние и не имеют магнитных свойств. Необходимо принять также, что при этом не только происходит образование связей между железом и кислородом или окисью углерода, но и связи железа с глобином и порфирином теряют свой ионный характер и становятся настоящими ковалентными связями. Оксигемоглобин и карбоксигемоглобин сходны в этом отношении с теми диамагнитными соединениями железа, типичным представителем которых служит железистосинеродистый комплекс.
Как уже указывалось выше, вычисленный максимальный магнитный момент гемоглобина равен 4,9 магнетона. Между тем, измерения дали заметно большую величину, равную 5,43 магнетона [148]. Причина этого довольно значительного расхождения еще неясна. Она не может быть связана с взаимодействием группировки гема, так как такое же расхождение найдено и для миоглобина, молекулярный вес которого равен 17 000 [149] и молекула которого содержит, следовательно, только один протогем [149].
Все изменения в состоянии атома железа и в его связях с глобином сопровождаются изменениями спектров поглощения гемоглобинов. Как известно, для диамагнитных соединений — оксигемоглобина, карбоксигемоглобина и гемохромогена — характерными являются две полосы поглощения в зеленой части видимой области спектра [150].
При частичном гидролизе гемоглобина трипсином получается соединение, в котором весь входивший в молекулу гемоглобина гемин оказывается прочно связанным с продуктом расщепления глобина [151]. При частичном же гидролизе глобина 70-процентной серной кислотой при 37° получается полипептид, обладающий щелочными свойствами и содержащий значительное количество гистидина [152]. Это указывает на то, что остатки гистидина составляют наиболее устойчивую часть молекулы глобина.
При соединении гемоглобина с кислородом меняются не только свойства простетической группы, но и физические и химические свойства молекулы в целом. Ранее уже указывалось, что способность гемоглобина присоединять основания увеличивается при переходе гемоглобина в оксигемоглобин. Следствием этого является то, что артериальная и венозная кровь имеет почти одинаковую реакцию. Более высокое содержание угольной кислоты в венозной крови компенсируется более высокой кислотностью оксигемоглобина артериальной крови. Кривая образования оксигемоглобина в зависимости от давления кислорода [153] характеризуется особой, необычной для подобных процессов, сигмообразной формой (фиг. 41). Поскольку миоглобин, молекула которого содержит только один атом железа, не дает такой кривой, можно думать, что ее сигмообразная форма обусловлена взаимодействием четырех группировок гема в молекуле гемоглобина. Кислород всегда соединяется со всеми 4 гемами молекулы гемоглобина. Образование промежуточных соединений, содержащих 1, 2 или 3 молекулы кислорода на 1 молекулу гемоглобина, характеризуется кривой, имеющей форму гиперболы [155]. Когда первая молекула кислорода присоединяется к одному из гемов, сродство остальных к кислороду увеличивается, в связи с чем они насыщаются кислородом быстрее, чем гемы другой молекулы гемоглобина.
Термодинамика и кинетика этих весьма сложных реакций была исследована Райтоном, который предложил следующее уравнение [156]:

В этом уравнении у — процент насыщения кислородом, р — давление кислорода, K1 — постоянная равновесия первичной реакции
Нb4 + O2 = Нb4O2,
а λ приближенно равна величине К13(К4/4), где K4 — постоянная равновесия конечной реакции
Нb4(O2)3 + O2 = Нb4(O2)4.
Было принято также, что постоянные равновесия K1, К2 и К3 уменьшаются в указанном порядке, а K4 значительно больше, чем K1 [156]. Высокое значение K4 свидетельствует о взаимодействии между всеми группировками гема в каждой молекуле гемоглобина. Это предположение достаточно вероятно, так как трудно представить себе, чтобы четыре группировки гема, связанные с одной и той же молекулой глобина, не реагировали между собой тем или иным образом [157]. Группировки гема, вероятно, расположены попарно, в связи с чем гемы одной пары могут легче реагировать друг с другом, чем гемы, принадлежащие к различным парам [116].
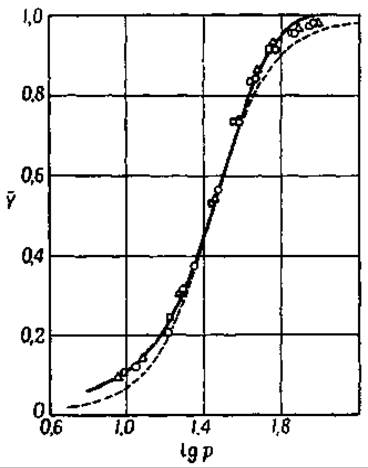
Фиг. 41. Состояние равновесия между гемоглобином и кислородом [116]. Сплошная линия — гемоглобин овцы [153]. Знаки на сплошной линии — гемоглобин человека [154]. Пунктирная линия— кривая, рассчитанная по уравнению Паулинга для константы взаимодействия, равной 12.
Различие форм кристаллов гемоглобина и оксигемоглобина также свидетельствует о том, что при соединении с кислородом меняются не только свойства гема, но и свойства молекулы гемоглобина в целом [158] (фиг. 42).
На фиг. 42, в верхней части микрофотограммы, видно превращение шестигранных кристаллов пластинок гемоглобина в длинные иглы оксигемоглобина, происходящее под действием диффундирующего кислорода. Резкое изменение формы кристаллов, происходящее при переходе гемоглобина в оксигемоглобин, заставляет предположить, что форма и поверхность молекул гемоглобина и оксигемоглобина очень различны. Это различие, очевидно, играет какую-то роль в образовании «серповидных» эритроцитов. Такие эритроциты, как известно, находятся в крови у больных, страдающих этой своеобразной формой анемии, причем серповидные формы эритроцитов появляются в крови при понижении давления кислорода [159].

Фиг. 42. Кристаллы гемоглобина и оксигемоглобина лошади [158].
Равновесие между гемоглобином и кислородом обычно выражают следующим уравнением:
![]()
Принимая, однако, во внимание, что гемоглобин является гидратированным соединением, было предложено писать это уравнение следующим образом [160]:
Нb(Н2О) + О2 ⇄ HbO2 + H2O.
Если гемоглобин тщательно высушить в вакууме, то широкая полоса поглощения гидратированного гемоглобина заменяется двумя узкими полосами безводного гемоглобина, которые аналогичны полосам поглощения гемохромогена. При гидратации безводного гемоглобина вновь восстанавливается прежняя полоса поглощения [160, 161].
Сродство гемоглобина к кислороду уменьшается в присутствии солей [162]. Это сродство, однако, возрастает в концентрированных растворах мочевины, в которых молекулы гемоглобина подвергаются дезагрегации [116, 163]. Подкисление растворов гемоглобина углекислотой или другими кислотами уменьшает сродство гемоглобина к кислороду. Это явление представляет собой процесс, обратный описанному выше эффекту Бора, — увеличению кислотности (способности связывать основания) при переходе гемоглобина в оксигемоглобин [116]. Указанные явления объясняют наличием в глобине ионной группы, находящейся рядом с группой, связывающей железо и влияющей на сродство железа к кислороду.
Хорошо известно, что окись углерода вытесняет кислород из соединения с гемоглобином. Спектр поглощения, форма кристаллов и некоторые другие свойства карбоксигемоглобина напоминают свойства оксигемоглобина. Главное различие между этими двумя соединениями состоит в том, что карбоксигемоглобин представляет собой гораздо более стойкое соединение, чем оксигемоглобин, и его диссоциация на гемоглобин и окись углерода происходит значительно медленнее [164]. Кроме того, карбоксигемоглобин расщепляется на свои компоненты на свету [165], причем каждая молекула карбоксигемоглобина поглощает 1 квант [166]. В отличие от гемоглобина и оксигемоглобина карбоксигемоглобин не имеет полосы поглощения в области, близкой к инфракрасной (λ = 900—1 000 mμ) [167]. Карбоксигемоглобин легко отличить от оксигемоглобина по яркокрасной окраске его растворов, которая сохраняется даже после обработки растворов сульфатом меди, едким натром или таннином. Оксигемоглобин после такой обработки превращается в соединение, имеющее коричневый цвет. Устойчивость карбоксигемоглобина к действию указанных выше веществ также свидетельствует о большей стабильности молекулы карбоксигемоглобина по сравнению с молекулой оксигемоглобина, которая, расщепляясь при этих условиях, образует производные гемина, имеющие коричневый цвет.
В то время как кислород и окись углерода соединяются с железом гема, углекислота присоединяется к глобину. Значительная часть углекислоты крови в норме находится в соединении с гемоглобином в виде карбгемоглобина [168]. Природа этого соединения еще не совсем ясна. Известно, что углекислота, связанная с белком, не осаждается в виде углекислого бария. На этом основании было высказано предположение о том, что карбгемоглобин представляет собой карбаминовое соединение, в котором углекислота связана следующим образом [169]:
![]()
Надо, однако, указать, что карбаминовые соединения образуются только при щелочной реакции и не являются стойкими при pH нормальной крови [116, 162, 170]. Возможно, что ионы бикарбоната так прочно соединены с группами ![]() гемоглобина, что они инактивируются, подобно тому как ионы кальция или фосфата инактивируются при соединении с казеином, и что именно по этой причине они и неспособны осаждаться баритом (см. гл. V).
гемоглобина, что они инактивируются, подобно тому как ионы кальция или фосфата инактивируются при соединении с казеином, и что именно по этой причине они и неспособны осаждаться баритом (см. гл. V).
Под действием окислителей двухвалентное железо гемоглобина переходит в трехвалентное и образуется метгемоглобин. Свойства метгемоглобина напоминают свойства индикатора, так как он дает коричневую окраску в кислых растворах и красную — в щелочных [171]. Обе эти формы метгемоглобина соответствуют двум находящимся в равновесии формам железа: гидроокиси железа и ее катионной форме [172]:
![]()
Метгемоглобин соединяется с цианидами, фторидами, сульфидами и перекисями, с образованием сложных комплексов, имеющих типичные спектры поглощения и полученных в кристаллическом виде [173, 174]. Нормальная кровь человека содержит около 0,1% метгемоглобина [175].
Когда растворы гемоглобина подвергаются одновременно действию сероводорода и кислорода или перекиси водорода, то образуется сульфгемоглобин — соединение, имеющее зеленую окраску [176, 177]. Сульфгемоглобин может образовываться также при гниении гемоглобина.
Гемоглобины различных животных обладают видовой специфичностью. Специфичность отдельных гемоглобинов может быть установлена не только иммунологически [178] (как устанавливается специфичность многих белков), но и по различиям в форме их кристаллов [179, 180], в растворимости и аминокислотном составе (табл. 14) [181 — 183]. Концевые группы пептидных цепей разных типов гемоглобинов также различны. В гемоглобине человека эти концевые группы образованы 5 молекулами валина, в гемоглобине лошади — 6 молекулами валина, в гемоглобине коровы, овцы и козы — 2 молекулами валина и 2 молекулами метионина [184].
Таблица 14 Аминокислотный состав гемоглобина различных животных
|
Гемоглобин |
Число молекул аминокислот на 1 (мол. вес 66 700) молекулу белка |
||
|
гистидин |
аргинин |
изолейцин |
|
|
Человека |
35 |
16 |
0 |
|
Лошади |
33 |
14 |
— |
|
Овцы |
32 |
15 |
— |
|
Собаки |
— |
— |
6 |
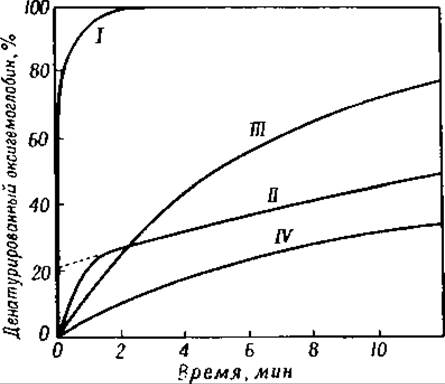
Фнг. 43. Денатурация различных гемоглобинов 0,25 н. раствором едкого натра [193].
I — мать; II — новорожденный ребенок; III — кролик; IV— лошадь.
Гемоглобины различных видов животных денатурируются 0,25 н. едким натром с разной скоростью. Гемоглобин человека денатурируется на 90% в течение 1 мин., гемоглобин же быка подвергается такой же денатурации только в течение 24 час. (фиг. 43) [185]. Благодаря этим различиям удалось обнаружить специфический гемоглобин в крови зародыша человека [186]; время денатурации этого гемоглобина равно 60 мин. [186]. Кристаллы гемоглобина взрослого человека [187] и гемоглобина новорожденного ребенка имеют различную форму (фиг. 44 и 45) [186]. Концевые аминогруппы гемоглобина зародыша человека образованы валином, причем число их равно 2,6 на каждые 4 атома железа [184]. Отношение 2,6 : 4 указывает на то, что упомянутый гемоглобин не является однородным соединением.

Фиг. 44. Гемоглобин взрослого человека [189].
В последнее время, действительно, было показано, что как гемоглобин взрослых людей, так и гемоглобин зародыша представляют собой смесь, по крайней мере, 3—5 различных гемоглобинов [188]. Гемоглобин взрослого человека и гемоглобин зародыша отличаются друг от друга не только по форме кристаллов, но и по периодам идентичности на их рентгенограммах [189]. Молекулярный вес этих обоих гемоглобинов, однако, одинаков [190]. В крови детей старше 3 лет был найден еще третий тип гемоглобина, отличающийся от нормального гемоглобина взрослого человека своей устойчивостью к действию едкого натра [191].
Хотя спектр поглощения и сродство гемоглобина к кислороду являются функцией простетической группы, оба эти свойства до определенной степени зависят и от глобина. Так, например, расстояние между максимумами поглощения оксигемоглобина и карбоксигемоглобиня колеблется у отдельных видов животных в пределах 53—62 А. Такне же различия были обнаружены и в сродстве к кислороду [192]. Сродство эритроцитов зародыша к кислороду выше, чем сродство эритроцитов взрослого организма. После гемолиза сродство гемоглобина зародыша к кислороду не меняется, сродство же гемоглобина взрослого человека повышается [193, 194]. Из этих данных ясно, что сродство гемоглобина к кислороду определяется не только его простетической группой и глобином, но и какими-то факторами, присутствующими в красных кровяных тельцах. Значительные различия между гемоглобином зародыша и гемоглобином матери найдены только у человека; менее же значительные различия, в частности в отношении сродства к кислороду, были обнаружены и у других видов животных, например у коров и коз [195].

Фиг. 45. Оксигемоглобин новорожденного ребенка [189].
Интересно отметить, что у больных пернициозной анемией, у которых регенерация гемоглобина усилена, образуется тот тип гемоглобина, который мы находим у взрослого человека, а не гемоглобин зародышевого типа [171]. При анемии же, характеризующейся образованием эритроцитов1 серповидной формы, найден другой тип гемоглобина, электрофоретически отличающийся от гемоглобина взрослого человека. Гемоглобин, входящий в состав серповидных эритроцитов, отличается от нормального гемоглобина взрослого человека также по своему заряду: при pH 6,9 этот заряд имеет положительный знак, тогда как при том же pH нормальный гемоглобин взрослого человека заряжен отрицательно [159].
Выше уже указывалось, что гемоглобины различных животных обладают видовой специфичностью. Трудно, однако, утверждать, что они представляют собой однородные соединения. Так, например, электрофоретические и спектрометрические исследования гемоглобинов быка и лошади показали, что эти гемоглобины состоят из нескольких различных соединений.
Кроме крови животных, гемоглобин был обнаружен в узелках корешков бобовых растений [199—201]. В настоящее время неизвестно, играет ли он там какую-либо роль в ассимиляции азота.
Миоглобин, пигмент красных мышц, содержит в качестве своей простетической группы тот же протогем, что и гемоглобин [202]; белковый же его компонент отличается от глобина.
Кристаллический миоглобин был получен при диализе мышечного экстракта против концентрированного раствора сернокислого аммония [203]. Его можно получить также путем ресинтеза из его составных частей [204]. Сродство миоглобина к кислороду выше, чем сродство гемоглобина [205]. Он отличается от гемоглобина также своим спектром поглощения, аминокислотным составом и более высокой устойчивостью к действию едкого натра [206]. Молекулярный вес миоглобина 17 000, и молекула его содержит лишь 1 атом железа [203]. Концевая а-аминогруппа миоглобина образована глицином [184]. Миоглобин был обнаружен также в моче людей, мышцы которых были размож- жены [207]. Большой интерес представляет тот факт, что филогенетически миоглобин соответствует гемоглобину беспозвоночных животных [208].
Количественное определение гемоглобина и его производных проводится большей частью колориметрически, в особенности в клинических лабораториях. Так как ни гемоглобин, ни оксигемоглобин не являются стойкими соединениями, они не могут быть использованы в качестве стандартов. Часто в качестве стандарта применяют раствор кислого гематина, имеющий коричневую окраску. Исследуемая кровь при этом методе предварительно смешивается с разведенной соляной кислотой. Необходимо, однако, отметить, что указанный метод дает часто ошибочные данные в связи с помутнением растворов вследствие постепенной флокуляции пигмента. Это помутнение означает, что падающий на раствор свет не только поглощается, но и рассеивается [209]. Помутнение растворов может быть обусловлено также липидами крови [210] или флокуляцией белков плазмы [211]. Более надежные результаты получаются при колориметрировании щелочных растворов, наилучшим же методом является колориметрическое или фотометрическое определение цианида метгемоглобина [212], образующегося при прибавлении к крови соляной кислоты и цианистого калия [213]. Этот метод был испытан в различных лабораториях, и полученные результаты оказались очень хорошими [214]. Большим преимуществом этого метода является также то, что можно использовать в качестве стандарта циангематин, который имеет такую же окраску и такой же спектр поглощения, как и цианид метгемоглобина. Хорошие результаты при определении гемоглобина дает также газовый метод Ван-Слайка. Содержание гемоглобина в крови нормальных людей при определении указанными методами оказалось равным 15,7—16,1% [215]. Метгемоглобин в присутствии гемоглобина может быть определен путем насыщения крови кислородом или окисью углерода до и после восстановления крови дитионитом (Na2S2O4) [216]. Эта соль является одним из немногих восстановителей, которые могут быть использованы для превращения оксигемоглобина или метгемоглобина в гемоглобин, так как большинство других восстановителей одновременно необратимо денатурируют глобин. Однако некоторым недочетом этого метода является то, что небольшие количества «неактивного пигмента», не способного присоединять кислород, также превращаются при действии Na2S2O4 в гемоглобин [217]. Очень малые количества кислорода и оксигемоглобина могут быть определены полярографическим методом [218]. Карбоксигемоглобин и метгемоглобин можно определять также путем спектрофотометрии в инфракрасном свете [219]. Спектрофотометрические методы применяются и тогда, когда необходимо определить какое-либо производное гемоглобина, находящееся в смеси с другими его производными [171, 220].
Если при патологических условиях происходит распад гемоглобина и образуются значительные количества гематина, то часть гематина соединяется с сывороточным альбумином. Это соединение получило название метгемальбумина1 [221].
К числу содержащих группировку гема белков относятся также каталаза, пероксидаза, дитохромы и цитохромоксидаза. Свойства этих соединений будут рассмотрены в следующей главе.
В крови некоторых беспозвоночных содержится настоящий гемоглобин (Sabella spallanzanii, Daphnia magna), в крови же других находятся гемоглобиноподобные вещества [222]. Одним из таких веществ является эритрокруорин, имеющий такую же красную окраску, как и гемоглобин. Другой же пигмент — хлорокруорин — имеет зеленый цвет. В состав эритрокруорина входит тот же протогем, что и в состав гемоглобина. Белковый компонент эритрокруорина, однако, значительно отличается от глобина. Он содержит меньше гистидина, и его изоэлектрическая точка лежит около pH 5,0 [223]. Эритрокруорин был найден как в эритроцитах беспозвоночных, так и в их плазме. Эритрокруорины, входящие в состав эритроцитов Dasybranchus, Glycera, Thione briareus, Area pescata и Petromyzon fluvtalis, имеют молекулярный вес от 16 700 до 56 500 [224, 225]. Внеклеточные эритрокруорины, растворенные в плазме крови Arenicola, Planorbis, Lumbricus и других беспозвоночных, имеют молекулярный вес от 350 000 до 2 800 000 [225, 226].
Хлорокруорин был найден Фоксом [227] в крови Spirographis и Serpula. Этот кристаллический белок содержит 1,2% железа [228]. Его молекулярный вес очень высок, а изоэлектрическая точка лежит при pH 4,3 [229]. Каждый атом железа эритрокруорина (так же, как и хлорокруорина) соединяется с 1 молекулой кислорода.
1 В работе А. М. Чарного и Л. А. Блюменфельда (ДЛЯ СССР, 73, 1001, 1950) было показано, что при метгемальбуминемии может происходить «перескок» гема с гемоглобина на альбумин плазмы, что указывает на ослабление связи гема с белком в гемоглобине. — Прим. ред.