Гликопротеины - Хьюз Р. 1985
Функции
Катаболизм и клиренс
Растворимые гликопротеины
Распад белков в клетке в ходе нормального роста и дифференцировки находится под определенным контролем (69]. Частично деградация и обновление белков определяются свойственными им характерными наследуемыми признаками, например конформацией полипептидной цепи. Имеются, однако, убедительные данные о том, что углеводные компоненты также участвуют в регуляции катаболизма гликопротеинов. Например, в печени гликопротеины плазматических мембран обновляются быстрее, чем негликозилированные белки, а в культивируемых линиях клеток гликопротеины плазматических мембран почти полностью обновляются за несколько часов в условиях, почти полностью предотвращающих рост [18].
Обнаружен сигнал углеводного типа для катаболизма гликопротеинов, который, вероятно, имеет отношение к обсуждаемым процессам. Так, гликопротеины, находящиеся в кровотоке, захватываются печенью, где и происходит их катаболизм.
Описываемая ниже система была обнаружена случайно. Гилберт Эшвелл, Анатоль Морелл (Ashwell, Moreli) и их сотрудники были намерены проследить судьбу церулоплазмина, введенного в кровоток. Вначале этот гликопротеин обрабатывали нейраминидазой, чтобы обнажить остатки галактозы, имеющиеся в составе N-гликанов (рис. 2.5). Теперь можно было пометить остатки галактозы радиоактивным изотопом, вначале обрабатывая галактозооксидазой для образования альдегидной группы при С-6, а затем проводя восстановление тритированным боргидридом натрия. Неожиданно обнаружилось, что меченый гликопротеин уже за несколько минут исчезал из крови и появлялся в печени крыс, тогда как необработанный гликопротеин циркулировал в течение нескольких дней. При последующем анализе этого интересного феномена было установлено, что поверхность гепатоцитов обладает лектиноподобной активностью, позволяющей им связывать концевые галактозные остатки различных асиалогликопротеинов и тем самым способствовать попаданию галактопротеинов в лизосомы, где они гидролизуются кислыми гидролазами [70]. Эти данные позволяют также объяснить ранее сделанные наблюдения, согласно которым орозомукоиды крови человека почти полностью сиалированы, и у них экспонировано лишь очень немного остатков галактозы, если вообще таковые имеются.
Лектин, связывающий галактозу, представляет собой гликопротеин, состоящий из нескольких субъединиц (скорее всего из двух). Он прочно «вмурован» в мембрану гепатоцитов и солюбилизируется лишь при обработке детергентами. Молекулярная масса одной субъединицы равна 45000 и отличается от таковой для других галактозоспецифических лектинов, вероятно участвующих в клеточной адгезии (разд. 4.5.1). Лектин гепатоцитов агглютинирует клетки, обработанные нейраминидазой, и служит митогеном для лимфоцитов, т. е. стимулирует у покоящихся периферических лимфоцитов синтез ДНК. Оба этих свойства указывают на наличие у одной активной молекулы лектина нескольких связывающих центров. На способности ко множественному взаимодействию с лектином также основываются связывание и захват гликопротеинов гепатоцитами [71]. Гликопротеины или очищенные гликопептиды со многими концевыми остатками галактозы связываются с высоким сродством и быстро поглощаются клеткой. Однако гликопротеины со сложными гликанами, содержащими только два концевых остатка, связываются слабо и не вызывают эндоцитоза (рис. 4.10). Например, асиалоорозомукоид с четырехантенными N-гликанами (рис. 2.11) служит очень хорошим субстратом для гепатотического эндоцитоза, тогда как сывороточный асиалотрансферрин, имеющий лишь две антенны, наоборот, очень плохо подвергается эндоцитозу [72]. Следует, однако, отметить очень высокое сродство связывания и способность к эндоцитозу у О-гликанов, содержащих остатки N-ацетилгалактозамина (рис. 4.10).
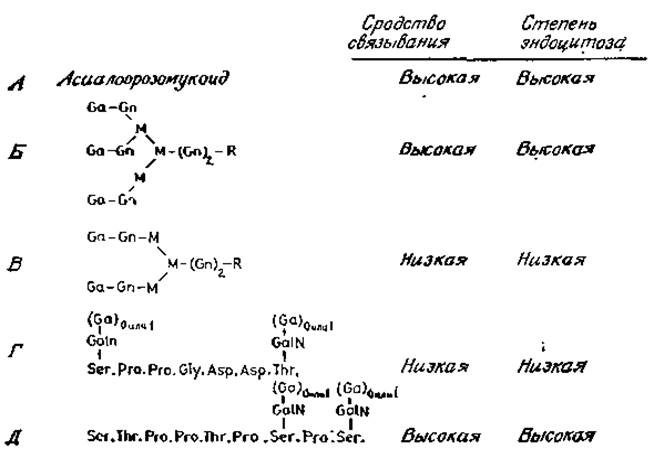
Рис. 4.10. Связывание и эндоцитоз гликопротеинов гепатоцитами. О-гликаны, содержащие концевые остатки галактозы, ведут себя так же, как и гликопептиды, у которых удалена галактоза. R — остатки аспарагина.
Подобно тому как для хорошего связывания и запуска эндоцитоза N-гликанами требуется множество близко расположенных антенн, на концах которых находятся остатки галактозы, О-гликаны должны иметь близко расположенные антенны, в состав которых входят остатки N-ацетилгалактозамина. К тому же для связывания с рецепторами не требуется, чтобы концевые остатки N-ацетилгалактозамина были замещены остатками галактозы.
Высокое сродство некоторых гликопротеинов к гепатоцитам можно использовать для удаления белков из кровотока в печень. Например, гликолипид Б (рис. 4.10), присоединенный к альбумину, вызывает быстрый клиренс этого белка, в норме негликозилированного и стабильного [70].
Для связывания гликопротеинов с гепатоцитами необходимо присутствие ионов Са2+, причем данный процесс полностью ингибируется обработкой гепатоцитов или очищенного лектина нейраминидазой. Это происходит потому, что удаление сиаловой кислоты у гликановых цепей лектина вызывает самоагрегацию рецепторов, обусловленную взаимодействием обнажившихся галактозильных концевых остатков.
Присутствие лектина, видимо, ограничивается печенью, где он расположен па поверхности гепатоцитов в прямом контакте с током крови. Такая специфическая локализация указывает на важную роль лектина в удалении частично деградированных или модифицированных гликопротеинов из крови, а возможно, и на участие во внутриклеточном переносе в кровоток сывороточных гликопротеинов, образуемых в печени.
Прямые доказательства участия лектинов гепатоцитов в клиренсе in vivo были получены следующим образом. Было показано, что одновременное введение асиалопротеинов в кровь вместе с антителами против очищенного рецептора значительно увеличивает время нахождения этих гликопротеинов в кровотоке [73]. Далее было установлено, что в крови больных циррозом печени имеется больше, чем в норме, гликопротеинов с концевыми остатками галактозы. Однако на клеточной поверхности в любой отрезок времени имеется лишь около 10% всех рецепторов, большинство же рецепторов связано с гладкими мембранами аппарата Гольджи. Возможно, что эти мембраны служат предшественниками тех пузырьков, которые несут рецепторы к клеточной поверхности. Это необходимо для постоянного восполнения клеточных рецепторов, теряющихся в ходе эндоцитоза [74]. Было подсчитано, например, что вся популяция поверхностных рецепторов удаляется с клетки примерно через каждые 5—10 мин. Очевидно, что необходимо иметь значительное количество рецепторов внутри клетки для восполнения этих потерь. Восполнение рецепторов, вероятно, облегчается и тем обстоятельством, что рецепторы лизосом могут использоваться повторно. Это указывает на их устойчивость к действию лизосомных ферментов. Механизм защиты активных участков рецепторов, видимо, заключается в том, что в лизосомах они обращены внутрь, в сторону цитозоля. Вероятно, после слияния лизосом происходит изменение положения молекул рецептора в мембране. Для того чтобы рецепторы появились опять на поверхности клетки в правильном положении, необходимо новое изменение их ориентации в той мембранной системе, которая выводит их на поверхность. Механизм всего этого процесса в настоящее время еще не известен.
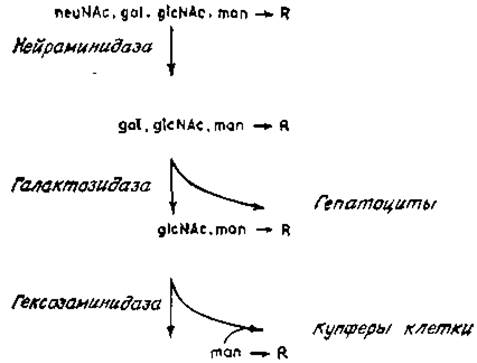
Рис. 4.11. Поглощение модифицированных гликопротеинов печенью млекопитающих. R — коровая область N-гликанов.
В печени млекопитающих гликопротеины крови в норме соприкасаются с поверхностными мембранами как гепатоцитов, так и непаренхиматозных клеток, выстилающих синусы. К последнему типу клеток относятся купферовы клетки, причем они играют важную роль в клиренсе гликопротеинов. Если орозомукоид обработать нейраминидазой, а затем ß-галактозидазой для обнажения концевых остатков N-ацетилглюкозамина, то обработанный таким образом гликопротеин будет быстро поглощаться ретикулоэндотелиальной системой (рис. 4.11). Подобным образом удаляются гликопротеины с концевой маннозой, например многие ферменты лизосом крысы том числе ß-глюкуронидаза и ß-N-ацетилглюкозаминидаза, причем одновременное введение асиалоагалактоорозомукоида блокирует процесс выведения [75]. Необходимо при этом иметь в виду, что N-гликаны ферментов лизосом богаты олигоманнозидными цепями. Следовательно, эти опыты дают основание думать, что распознающие молекулы на поверхности купферовых клеток связывают гликопротеины, имеющие в качестве концевых остатков N-ацетилглюкозамин или маннозу. Лектин широко распространен среди фагоцитирующих клеток, например альвеолярных макрофагов; он участвует во втором главном механизме катаболизма углеводов в тканях животных, Выделены компоненты, связывающие N-ацетилглюкозамин и маннозу, являющиеся, возможно, поверхностными лектинами непаренхиматозных клеток. В частности, подобный лектин был изолирован из печени крыс. Он оказался олигомерным гликопротеином, связанным с мембранами. Молекулярная масса одной его субъединицы равна 32 000. Антигенного родства с лектином гепатоцитов не обнаружено, но в обоих случаях для проявления активности необходимо присутствие ионов Са2+. Гликопротеины с концевой маннозой связывались несколько лучше, чем гликопротеины с концевым N-ацетилглюкозамином, что указывает на сходство специфичности лектина с таковой для конканавалина А [76]. Следует напомнить, что конканавалин А связывается с внутренними остатками маннозы, даже если они замещены другими сахарами, например N-ацетилглюкозамином при С-2, хотя сродство связывания выше с гликопротеинами, у которых концевые остатки маннозы не замещены (рис. 4.1).
Функция лектинов гепатоцитов и купферовых клеток может включать в себя и удаление из кровотока частично деградированных сывороточных гликопротеинов или лизосомных гидролаз. В частности, представляется очень важным выведение лизосомных ферментов, предотвращающих повреждение поверхности клеток, соприкасающихся с кровью. Однако лектины могут выполнять еще одну существенную задачу, а именно способствовать разрушению микроорганизмов, таких, как дрожжи, которые обладают большим количеством олигоманнозидных цепей. Переваривание дрожжей альвеолярными макрофагами, например, подавляется маннозой и гликопротеинами с концевыми остатками маннозы [77].
Гликопротеины крови птиц в отличие от таковых у млекопитающих имеют много обнаженных остатков галактозы. Поэтому следует ожидать, что рецепторная система в клетках печени птиц должна отличаться от таковой в гепатоцитах млекопитающих. Действительно, узнаваемым остатком у птиц является N-ацетилглюкозамин, и обработка гликопротеинов с концевыми остатками галактозы ß-галактозидазой вызывает быстрое удаление таких модифицированных гликопротеинов из кровотока. Такой специфический лектин был выделен из печени кур. Он оказался гликопротеином, молекулярная масса субъединицы которого равна 26 000. Определение его полной аминокислотной последовательности показало, что ей присущи некоторые необычные характерные особенности, N-концевой остаток цепи ацетилирован. Участок, следующий за ним, т. е. участок цепи, включающий остатки 25—48, оказался богатым незаряженными аминокислотами, имеющими в основном гидрофобные боковые цепи. Возможно, что он участвует в прикреплении лектина к клеточной мембране. Противоположный конец пептидной цепи (карбоксильный), вероятно, обращен в межклеточное пространство и содержит один N-гликан, присоединенный к аспарагину-67. В этом же длинном участке пептидной цепи имеется семь остатков цистеина, и поэтому он, вероятно, сильно свернут. По-видимому, ориентация лектина печени кур в мембране противоположна той, которая имеется в случае гликофорина, и более сходна с гликопротеином «полосы 3», за тем лишь исключением, что полипептидная цепь лектина проходит через мембрану лишь один раз [78]. Пока локализация лектина у птиц еще неизвестна, однако маловероятно, что она аналогична локализации рецептора купферовых клеток млекопитающих, поскольку два этих белка различаются по молекулярной массе, потребности в катионах и углеводной специфичности. Так, после удаления сиаловой кислоты, галактозы и N-ацетилглюкозамина орозомукоид, имеющий после модификации высокое содержание концевых остатков маннозы, не связывается лектином птиц и не захватывается клетками. Из этого следует, что лектин птиц не распознает концевых остатков маннозы.