Гликопротеины - Хьюз Р. 1985
Функции
Адгезия клеток
Прикрепление клеток к субстрату
Все клетки, за исключением свободно циркулирующих (например, эритроцитов или циркулирующих, периферических лимфоцитов), окружены или погружены в слой вещества, богатого углеводами. Этот слой обозначают как гликокалис, оболочка клеток, или внеклеточный матрикс. Соединительные ткани, например кoстные хрящи или сухожилия, являются как бы крайним случаем такого высокодифференцированного бесклеточного матрикса, который откладывается в некоторых областях специализированными клетками, расположенными внутри его или в тесном с ним контакте. Внеклеточный матрикс защищает поверхность клеток (например, от повреждающих веществ), сохраняет буферный слой, компенсирующий внезапные изменения состава жидкости, омывающей клетки, и служит относительно жесткой структурой, поддерживающей форму тела. Кроме того, он играет важную роль в контроле клеточного роста и организации клеточных масс в ткани. Внеклеточный матрикс различается по своей тонкой структуре в зависимости от типа образующей его клетки. Однако главным компонентом является коллаген с варьирующим количеством протеогликанов и различных гликопротеинов. Гликопротеиновый компонент, по-видимому, играет важную роль в качестве посредника при адгезии клеток и межклеточного матрикса, в частности коллагена, и тем самым участвует в регуляции клеточного метаболизма и роста.
Всего насчитывается по крайней мере пять генетически детерминируемых коллагенов, которые имеют свою характерную локализацию. Было обнаружено, что с каждым из них ассоциирован определенный тип клеток (табл. 4,2). К настоящему времени идентифицировано несколько гликопротеинов, определяющих прилипание клеток к коллагену (табл. 4.2). Эти факторы адгезии секретируются клетками, и по крайней мере некоторые из них, вероятно, имеют отдельные участки связывания для коллагена и для клеточной поверхности. Предпочтительная комбинация разных типов клеток и определенного коллагена, по-видимому, как раз и объясняется специфичностью участков связывания. Ряд обсуждаемых факторов присутствует также и в сыворотке, которую обычно добавляют в среду для культивирования клеток in vitro. Факторы эти могут пассивно адсорбироваться на пластиковой посуде для культур ткани, что способствует прикреплению к ней клеток без подстилающего слоя коллагена.
Таблица 4.2. Коллагены b гликопротеины, способствующие адгезии клеток к коллагену
|
Тип коллагена |
Локализация |
Адгезивный гликопротеин |
|
|
Интерстициальный коллаген |
І ІІ |
Кожа, кости, сухожилия, дентин Хрящи, межпозвоночные диски |
Фиброкектин Хондропектии |
|
ІІІ |
Кожа плода, кровеносные сосуды, синовиальные мембраны |
Фиброкектик |
|
|
Коллагены базальных мембран |
IV АВ или V |
Базальные мембраны Гладкие мышцы, плацента, легкие |
Ламинин, энтактки ? |

Рис. 4.15. Адгезия клетки к субстрату. А — гликопротеиновый фактор связывается с субстратом. Б — прикрепление клетки. В — распластывание клетки.
Адгезия клеток к коллагеновому субстрату или поверхности пластика включает три четко выраженных этапа: 1) связывание гликопротеинового фактора с поверхностью пластика или коллагена, 2) прикрепление клеток к фактору, присоединившемуся к поверхности, и 3) умножение взаимодействий между поверхностью клеток и гликопротеиновыми молекулами и реорганизация внутриклеточного цитоскелета, в частности микрофиламентов, с распластыванием клеточной цитоплазмы по субстрату (рис. 4.15). Митотические клетки или клетки, освобожденные из монослойной культуры с помощью трипсина, представляют собой сферические частицы, поверхность которых покрыта многими складками, пузырьками и микроворсинками различной длины. Наиболее длинные ворсинки или филоподии первыми контактируют с субстратом и, очевидно, имеют на своих наружных концах поверхностно расположенные молекулы, которые способны обследовать соответствующий адгезивный субстрат, а затем с ним и взаимодействовать [93]. Филоподии богаты цитоплазматическими микрофиламентами, которые образуют пучки и плоские тяжи при растяжении клеток и затем взаимодействуют с другими компонентами цитоскелета, фиксируя стабильную структуру, характерную для прочно прикрепленной клетки.
Все этапы прикрепления клетки к субстрату проходят быстро (в течение 1—2 ч). Для этого процесса не требуется синтеза белка или нуклеиновых кислот de novo, однако необходимо присутствие двухвалентных катионов (Ca3+ и Mg2+). При длительном культивировании добавление экзогенного фактора адгезии может оказаться ненужным, если сами клетки способны его образовывать и секретировать. Например, для прикрепления фибробластов к поверхности пластика или коллагена необходимо часа за два добавить фибронектин, однако уже через 12—16 ч эти клетки образуют достаточно фибронектина для собственной адгезии и в отсутствие экзогенного фибронектина. Добавление цитохалазина В, препятствующего полимеризации актина, тормозит прикрепление клеток, что указывает на определенную роль микрофиламентов в этом процессе.
а) Фибронектин. Из факторов, способствующих адгезии к коллагену, первым был обнаружен фибронектин (табл. 4.3) (94, 95]. Джон Эдсолл (Edsoll) и его сотрудники в 40-х годах выделили из крови белок, названный холодным нерастворимым глобулином, или Cig, так как он является основным компонентом в осадке, образующемся при свертывании крови на холоду. Позднее было показано, что фибронектин обладает сродством связывания фибриногена и фибрина. Именно этим и объясняется его присутствие в сгустке фибрина. В дальнейшем удалось выделить фибронектин из крови и тканей многих позвоночных, а также из культуральной среды и разных клеток млекопитающих и птиц, которые культивировались в монослое, в особенности из культур фибробластов. В интактных тканях фибронектин содержится прежде всего в фибриллах и в тесном контакте с коллагеном. Он присутствует в базальной пластинке, прилегающей как к слоям эпителиальных клеток, так и к рядом расположенной соединительной ткани, в строме лимфатической ткани и вокруг гладких мышечных клеток и поперечнополосатых мышечных волокон. В каких именно клетках этих тканей образуется фибронектин, еще не совсем ясно. Однако кроме фибробластов в культуре ткани фибронектин синтезируется также миобластами, астроглиальными клетками, эндотелиальными клетками, макрофагами, тучными и эпителиальными клетками, причем он часто накапливается в больших количествах в клеточном матриксе.
Таблица 4.3. Свойства фибронектинов
|
Молекулярная масса |
Примерно 450 000 |
|
Субъединичная структура |
Димер (плазма) Димер и полимер (клетки) |
|
Структура углеводов |
4—5 N-гликаны |
|
Электрофоретическая подвижность |
а2—ß |
|
Иммунохимически сходные формы |
Плазма или клетки |
|
Полипептидная структура |
Имеются некоторые межвидовые различия |
|
Продукт одного к того же гена в плазме и клетках? |
Скорее всего продукты разных генов |
|
Место синтеза |
Фибробласты, астроглиальные клетки (источник плазматических форм?), ранние мезенхимальные клетки, макрофаги, тучные клетки |
|
Связывающие домены |
Коллагены, фибрин(оген), гепарин, актин, ДНК Рецепторы клеточной поверхности? |
|
Поперечное связывание |
Дисульфидные связи Трансглутаминаза (фактор XIII) |
|
Функции |
Способствуют адгезии и распластыванию клеток на коллагене, способствуют подвижности клеток, предотвращают диффереицировку хондроцитов, действуют как неспецифический опсонин в крови, стабилизируют свертывание крови |
Циркулирующая форма молекулы фибронектина представляет собой димер, построенный из двух сходных, но не идентичных по размеру (одна несколько больше другой) и по строению субъединиц, связанных между собой дисульфидными мостиками. Молекулы, связанные с клетками, состоят из двух субъединиц, очень похожих по молекулярной массе (около 225 000) и могут быть полимеризованы путем образования множества дисульфидных связей. Димерную форму удается экстрагировать из клеток и клеточных секретов. Все эти разные формы фибронектина, по-видимому, очень сходны по своим генетическим, химическим и функциональным свойствам, но все же неидентичны. Упрощенная схема строения молекул фибронектина показана на рис. 4.16. Этот белок является гликопротеином, содержащим около четырех N-гликанов, которые по своей структуре сходны с таковыми у сывороточных гликопротеинов, например у орозомукоида. Углеводный компонент, вероятно, лишь косвенно влияет на биологическую активность; возможно, он предохраняет молекулу от наружного протеолиза в ходе синтеза и секреции. Как было четко показано с помощью электронных микрофотографий [96], а также путем химического расщепления, димерные молекулы фибронектина состоят из функционально различных доменов, разделенных гибкими неглобулярными участками пептидной цепи, которые особенно чувствительны к протеолизу. Таким образом были получены активные фрагменты и показано, что они имеют различную биологическую активность. Так, фрагмент с молекулярной массой 40 000 (40К), связывающийся с коллагеном, расположен внутри молекулы, но вблизи от N-концевой части полипептидной цепи. Этот фрагмент, подобно молекуле интактного фибронектина, связывается с нативным фибриллярным коллагеном, в частности в ходе преципитации коллагеновых волокон [97]. Данная реакция лучше проходит с денатурированными коллагенами типа I—IV. Установлена определенная предпочтительность по отношению к интерстициальным коллагенам типа I и III при адгезии фибробластов. Участок полипептидной цепи коллагенов, к которому присоединяется 40К-домен фибронектина, представляет собой очень консервативную область, узнаваемую также коллагеназой млекопитающих. Еще в ранних исследованиях Стефен Хаушка (Haushka) показал, что дифференцировке миобластов в мышцу способствует этот же фрагмент коллагена. Поскольку фибронектин синтезируется миобластами и в свою очередь способствует адгезии миобластов к коллагену, механизм данного процесса можно считать установленным.
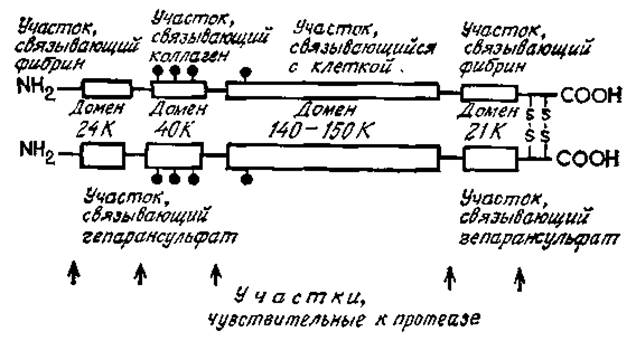
Рис. 4.16. Упрощенная схема строения фибронектина. Показаны участки ограниченного протеолиза и активные домены. ? — гликаны.
Связь между фибронектином и коллагеном является относительно слабой и стабилизируется большим числом взаимодействий между каждой клеткой и субстратом. Так, например, клетки линии ВНК образуют около 50 000 таких контактов [86]. Кроме того, эти взаимодействия могут стабилизироваться секрецией прикрепленными клетками гепарансульфата — протеогликана, который обычно обнаруживается с нижней стороны клеток, связанных с субстратом. Основной участок фибронектина, ответственный за присоединение гепарансульфата, расположен вблизи коллагенсвязывающей области, но не перекрывается с ней.
Существует предположение, что компоненты плазматической мембраны участвуют в реакции присоединения к поверхности, покрытой фибронектином, и эта информация прямо или косвенно передается снаружи клетки в цитоплазму, вызывая реорганизацию микрофиламентов. С внутренней части плазматической мембраны расположены цитоплазматические белки, которые осаждают микрофиламенты или образуют «якорные» места для их прикрепления. В этом процессе принимают участие два белка: винкулин (молекулярная масса 130000) и а-актинин (молекулярная масса 94000). Антитела против винкулина окрашивают области нижней части прикрепленных к субстрату клеток, которые не всегда содержат фибронектин, тогда как а-актинин располагается вместе с молекулами фибронектина и, по-видимому, наиболее активно участвует в процессе распластывания клеток, который стимулируется поверхностью, покрытой фибронектином [98]. Однако пока еще истинная природа компонента (компонентов) плазматических мембран, взаимодействующих непосредственно с фибронектином, не установлена. Возможно, что в этом участвуют углеводные компоненты гликолипидов [94] или гликопротеинов [86, 99], при этом вполне возможно участие не одного, а нескольких факторов (рис. 4.17).
б) Ламинин, хотя фибронектин может опосредовать прикрепление и распластывание многих типов клеток, он все же не во всех случаях эффективен. Одним из убедительных примеров может служить тот факт, что различные эпителиальные клетки способны прикрепляться и распределяться по слою коллагена и в отсутствие фибронектина [94]. Еще один гликопротеин — ламинин ускоряет прикрепление таких клеток и, очевидно, является партнером фибронектина по действию на клетки эпителиального происхождения. Ламинин — это мультимерный гликопротеин с молекулярной массой 800 000, построенный из субъединиц с молекулярной массой 200 000 и 400 000. В отличие от фибронектина он обладает высокой специфичностью к клеткам, прикрепляющимся к коллагену типа IV, который присутствует в базальных мембранах и, как правило, в контакте с эпителиальными клетками организма. Ламинин образуется лишь клетками эпителиального происхождения. Однако и фибронектин может продуцироваться этими же клетками, и, по-видимому, он опосредует прикрепление in vitro некоторых эпителиальных клеток к интерстициальным коллагенам, тогда как ламинин участвует в их прикреплении к коллагену базальных мембран. Ламинин, подобно фибронектину, связывается с гепараном и гепарансульфатом [100]. Поскольку последний присутствует во многих базальных мембранах, такие взаимодействия могут играть определенную роль в организации матрикса и в адгезии к нему.
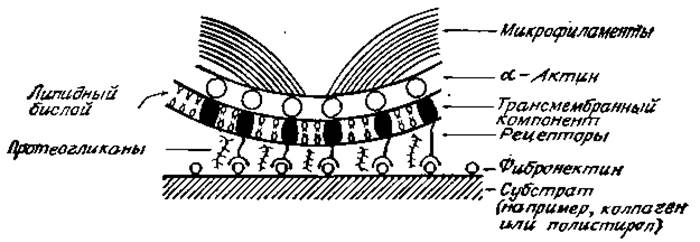
Рас. 4.17. Молекулы, участвующие в распластывании клеток.
Недавно выделенные из базальных пластинок другие факторы, возможно, также участвуют в прикреплении клеток к коллагенам базальных мембран. Одним из них является энтактин, сульфатированный гликопротеин с молекулярной массой 158 000, который секретируется эндодермальными клетками в культуре и локализуется на основании клеток, обращенном в тканях к базальной мембране [101].
в) Хондронектин. Высокоспециализированные клетки — хондроциты также нуждаются в особом гликопротеиновом факторе для адгезии к коллагену (в данном случае к хрящевому коллагену типа II) [94], Молекулярная масса хондронектина равна 180 000; подобно фибронектину, он присутствует в сыворотке, которая, следовательно, сама по себе может способствовать адгезии хондроцитов. Хондронектин специфически связывается с коллагеном типа II, содержащимся в хрящах. Интересно отметить, что хондроциты могут реагировать как с фиброектином, так и с хондронектином. Так, округлые клетки, прикрепленные хондронектином к коллагену типа II, могут быть с помощью фибронектина превращены в фибробластоподобную форму. Клетки затем прекращают образовывать коллаген, специфичный для хряща, а также протеогликаны и возвращаются к фибробластному фенотипу [102]. Поэтому в такой системе фибронектин подавляет специфическую дифференцировку клеток в культуре. Из этого, очевидно, следует, что образование фибронектина хондроцитами или другими клетками модулирует процесс развития ткани. Такая модуляция может иметь важное значение в образовании миогенных областей в хрящевых тканях и указывает на регулирующую роль поддерживающего матрикса в направлении роста клеток и их дифференцировки.
Из этого краткого обзора интенсивно развивающихся областей исследований можно представить себе, в чем состоят самые главные нерешенные проблемы, касающиеся функций гликопротеинов: 1) Какова роль гликопротеинов в регуляции организации межклеточного матрикса? 2) Способствует ли специфическая адгезия клеток, опосредуемая гликопротеинами, особым взаимоотношениям между дифференцированными типами клеток и специализированными внеклеточными матриксами? 3) Какие гликопротеины, гликолипиды или протеогликаны, связанные с клеточными поверхностями, участвуют в тесных контактах клеток и внеклеточного матрикса? 4) Каким путем такие взаимодействия способствуют, например, движению клеток по адгезивному матриксу или же миграции злокачественных клеток из первичного очага с последующей инфильтрацией и колонизацией в других областях межклеточного матрикса?
Как эти, так и другие вопросы, касающиеся гликопротеинов, подвергаются сейчас активному изучению и наряду с другими проблемами, обсуждаемыми в этой книге, свидетельствуют об очень большом интересе к строению и биосинтезу этих важных биологических макромолекул [103].