Гликопротеины - Хьюз Р. 1985
Функции
Адгезия клеток
Адгезия клетки к клетке
Адгезия клеток играет очень важную роль в формировании тканей и органов в процессе эмбриогенеза. При эмбриональном развитии происходит дифференцировка тотипотентных клеток, их сортировка в организованные скопления сходных клеток, транслокация клеток и окончательное формирование специализированных органов. Эти процессы зависят от специфического межклеточного узнавания н избирательной адгезии клеток. Классические опыты с клетками, взятыми от эмбрионов или дифференцированных органов (например, сердца, почек, печени и т. д.), указывают на то, что специфичность адгезии определяется самими дифференцированными клетками. Клетки, взятые из различных органов и суспендированные затем вместе, обладают способностью снова формировать агрегаты по тканеспецифическому принципу; так, клетки из ткани сердца в ходе агрегации исключают клетки печени.
Как уже указывалось, нарушение нормального процесса гликозилирования часто предотвращает развитие, в частности, у эмбрионов морского ежа или же у некоторых систем млекопитающих (например, почки). Поэтому гликопротеинам приписывается важная роль во многих взаимодействиях клеток, обусловливающих нормальное развитие.
Скорее всего адгезия клеток обусловлена реакцией между комплементарными молекулами. Такие взаимодействия могут быть следующих двух типов, если в них действительно участвуют углеводные компоненты гликопротеинов: 1) реакция между углеводными цепями, аналогичная взаимодействиям цепей многих линейных полисахаридов [4], и 2) реакция между углеводным компонентом и углеводсвязывающим белком, т. е. лектином. В последнее время второй возможности (рис. 4.12) отдается предпочтение, поскольку прямых взаимодействий между гликанами гликопротеинов не обнаружено. С другой стороны, сейчас обнаружены углеводсвязывающие белки необходимой специфичности и установлена их локализация на поверхности клетки. В ряде случаев эти белки появляются именно в то время, когда в ходе развития происходят определенные изменения, что подтверждает гипотезу о наличии белок-углеводных взаимодействий. Последнее, видимо, происходит между молекулами, интегрированными в мембраны клеточной поверхности реагирующих клеток (рис. 4.12, а). С другой стороны, возможно также участие в этих процессах факторов агрегации (рис. 4.12, 6, в). Таковыми могут быть вещества, секретируемые в межклеточное пространство одной из взаимодействующих клеток или же клеткой, удаленной от места, где происходит адгезия клеток. Такая клетка, очевидно, может оказывать индуктивный ответ на агрегацию других клеток — явление, часто встречающееся в ходе дифференцировки.
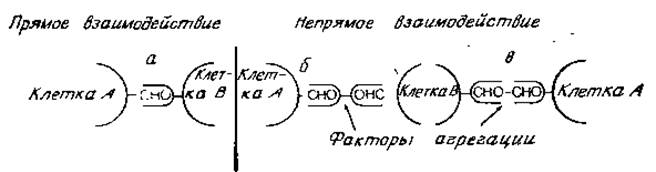
Рис. 4.12. Углевод-белковые взаимодействия при клеточной адгезии. СНО — углеводный компонент, з - участок, связывающий углевод.
Факторы агрегации были выделены из ряда тканей, в частности из морских губок — организма, у которого впервые были изучены специфические механизмы адгезии клеток. Еще в начале этого столетия Эдвард Уилсон (Wilson) показал, что губки диссоциируют на отдельные клетки, если их поместить в пресную воду, и вновь агрегируют после переноса в морскую воду. Этот эффект регулируется составом солей, в частности количеством кальция в морской воде. Если диссоциировать клетки двух разных губок, смешать их и проинкубировать в морской воде, то клетки каждой из них образуют отдельные агрегаты, в которых отсутствуют клетки другой губки. Данный феномен очень легко можно наблюдать, если смешать губки, имеющие различную окраску, обусловленную эндогенными хромафорами (например, губки с красными и зелеными клетками). При этом образуются красные или зеленые агрегаты, но не смешанные (рис. 4.13).
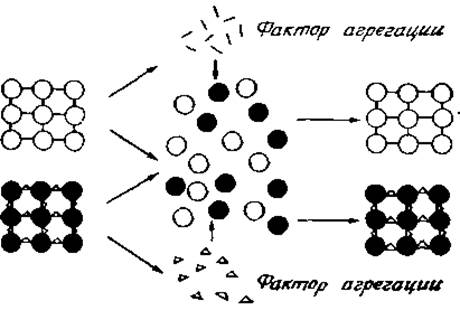
Рис. 4.13. Диссоциация и специфическая реагрегация клеток.
Факторы агрегации, высвобождаемые клетками губок при диссоциации, могут быть легко отделены от самих клеток методом центрифугирования. Они представляют собой гликопротеины с высокой молекулярной массой и имеют необычный состав [82]. Помимо галактозы, маннозы и N-ацетилгексозамина они содержат серную и уроновую кислоты. Последняя является важным компонентом, поскольку добавление свободной глюкуроновой кислоты подавляет агрегацию клеток в присутствии фактора агрегации. Установлено, что факторы агрегации обладают необходимой специфичностью; так, например, фактор губок Microciona partkena не способен вызывать агрегацию клеток у других, неродственных видов губок, например у Haliclona.
Сходная система обнаружена также у губок Geodia cyndonium. Интересно, что частично очищенный фактор агрегации обладает глюкуронилтрансферазной активностью. Из этого вытекает, что превращение неагрегирующей системы в агрегирующую может происходить путем внеклеточного добавления остатков глюкуроновой кислоты, если, конечно, при этом будет иметься необходимое активированное производное сахара [83]. Из инкубационных сред культивируемых клеток высших организмов также были выделены факторы агрегации, например из первичных культур клеток сетчатки куриного эмбриона [84]. Этот фактор вызывает агрегацию клеток сетчатки, но не действует на клетки других тканей. Он представляет собой гликопротеин, содержащий моносахариды, характерные для N-гликанов. Другой фактор агрегации клеток секретируется культивируемыми асцитными клетками мышиной тератомы, причем его агрегирующая активность подавляется воздействием ß-галактозидазой или добавлением свободной галактозы [85]. Очевидно, что остатки галактозы, содержащиеся в факторе агрегации, имеют весьма важное значение для инициирования клеточных взаимодействий в этой системе (рис. 4.12, в).
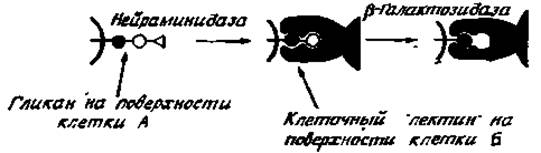
Рис. 4.14. Взаимодействие углеводов клеточной поверхности и белковых рецепторов при клеточной адгезии. Адгезия усиливается при обработке клеток нейраминидаэой, которая обнажает дополнительный концевой остаток галактозы. Обработка ß-галактозидазой снижает адгезию.
Другие доказательства участия гликопротеинов и галактозных остатков, в частности в клеточной адгезии, являются хотя и косвенными, но тем не менее весьма существенными. Отдельные клетки почек детенышей хомячков (линия ВНК) легко образуют в суспензии агрегаты при наличии ионов кальция. Этот процесс стимулируется предварительной обработкой клеток нейраминидазой и блокируется обработкой галактозооксидазой, которая превращает гидроксильную группу при С-6 галактозы в альдегидную группу. Сходные результаты были получены и в опытах с другими клетками, причем в одном случае ß-галактозидаза обусловливала значительное снижение скорости агрегации. Эти результаты указывают на существенную роль для адгезии сложных N-гликанов, имеющих следующую концевую последовательность; neuNAc, gal. glcNAc→R, где R обозначает коровую область (рис. 4.14). Другие непрямые указания были получены при изучении адгезивных свойств уже упоминавшихся раньше рицин-резистентных мутантов (разд. 4.2.4) клеток почек детенышей хомячка (линия ВНК). Многие из резистентных линий клеток агрегируют плохо. Показано, что это явление связано с блокированием гликозилирования и со снижением количества поверхностных углеводов, связывающих рицин. Наконец, клетки способны прикрепляться к частицам агарозы, к которым присоединены ковалентно остатки галактозы, причем остатки других сахаров оказываются неэффективными [86].
Все эти данные, вместе взятые, указывают на наличие прямых взаимодействий (рис. 4.12, а) между углеводными цепями, богатыми галактозой и углеводсвязывающими белками, расположенными на поверхности находящихся рядом клеток (рис. 4.14). Первое предположение о природе белков, связывающих углеводы и участвующих в процессах адгезии, было выдвинуто Роземаном [87]. Он указал на очень высокую специфичность гликозилтрансфераз, которые поэтому являются очень вероятными кандидатами на участие в адгезивных взаимодействиях, идущих также с высокой степенью специфичности. Маловероятно, чтобы при нормальных условиях в межклеточном пространстве присутствовали активированные предшественники сахаров. Поэтому гликозилтрансферазы, будучи расположенными на клеточной поверхности, могли бы участвовать в стабильных взаимодействиях с соответствующими углеводными цепями, выполняющими роль акцепторов в реакциях, катализируемых этими ферментами. Такая модель имеет определенные преимущества, так как указывает, каким образом осуществляется контроль диссоциирования слипшихся клеток. Если активированные сахара достигают участков контакта между клетками, то перенос остатков сахара будет происходить с диссоциацией комплекса трансфераза — углевод. Первоначальные попытки обнаружить на поверхности клеток гликозилтрансферазы дали неоднозначные результаты и поэтому подверглись суровой критике. Однако недавно проведенные эксперименты подтверждают предположение о том, что поверхность некоторых клеток обладает сиалилтрансферазной активностью. Разумеется, еще предстоит доказать, что эти трансферазы действительно принимают участие в адгезии. Еще одна возможность основывается на том, что гликозидазы клеточной поверхности способны взаимодействовать с углеводными цепями прилегающих клеток не гидролитически. Лизосомные ферменты, имеющие относительно низкий оптимум pH, могут образовывать стабильные связи, поскольку pH среды вокруг клетки, видимо, значительно выше, чем значения pH в лизосомах, т. е. чем те, которые необходимы для оптимальной каталитической активности. Прямым доводом в пользу этой гипотезы служит обнаружение больших количеств лизосомных ферментов на поверхности клеток, а также тот факт, что такие клетки способны прилипать к инертной стеклянной поверхности, к которой прикреплены нейраминидаза, ß-галактозидаза и а-маннозидаза. Эти опыты еще нуждаются в дальнейшем подтверждении и обсуждении.
Наиболее вероятными кандидатами на роль углевод- связывающих молекул являются лектины, лишенные по имеющимся данным какой-либо ферментативной активности. Удалось выделить несколько таких лектинов. Например, у Dictyostelium discoideutn появляется лектин в то время, когда одноклеточная амебовидная форма этого слизевика страдает от недостатка пищи. В этом случае клетки становятся способными образовывать агрегаты, которые затем дифференцируются в многоклеточные организмы, состоящие из стебелька и плодового тела с множеством спор. Выделенный лектин ингибируется N-ацетилглюкозамином, галактозой и D-фукозой, т. е, сахарами D-галактотина. По-видимому, слизевик имеет по крайней мере два таких лектина, называемых дискоидинами (I и II). Сходные лектины (пурпурины, наллидины) обнаружены у других слизевиков — Dictyosteiium purpureum и Potyspondylium pallidum. Все эти лектины имеют определенную специфичность по отношению к гомологичным организмам. В процессе агрегации, вероятно, участвуют углеводные цепи, последовательности которых специфичны для каждого данного слизевика, и различные лектины обладают соответствующей способностью их узнавать, хотя простые галактозиды при высоких концентрациях могут тормозить агрегацию клеток. Очевидно, что именно эти сахара служат во всех случаях основной детерминантой. Дискоидины I и II и пурпурины появляются в различные периоды эмбрионального развития, свидетельствуя, очевидно, о том, что процесс развития сопровождается небольшими изменениями в строении углеводов поверхности, каждое из которых узнается соответствующим лектином, возникающим в определенном регулируемом порядке на поверхности клеток. Каждый из лектинов, возможно, необходим для нормального процесса развития, поскольку мутантные клетки Dictyostelium discoideum, не способные к агрегации, не имеют активных молекул дискоидина I, но в то же время обладают поверхностными рецепторами для дискоидинов, выделенных из нормальных организмов. Лектины слизевиков являются олигомерными белками с субъединицами, молекулярная масса которых равна примерно 25 000 [89].
Из различных тканей млекопитающих и птиц выделены лектины другого класса. Молекулярная масса их ниже - около 13 000, а способность вызывать агглютинацию клеток подавляется галактозидами. В отсутствие восстанавливающих агентов субъединицы лектинов агрегируют, возможно, в результате образования дисульфидных связей и теряют при этом активность. Лектины не являются интегральными компонентами клеточных мембран, так как они солюбилизируются при выдерживании тканей в растворах простых галактозидов, например в растворе лактозы. Следовательно, лектины — это такие факторы агрегации, которые действуют вне клетки, вызывая слипание последних путем реакции с соответствующими интегральными гликопротеинами мембран (рис. 4.12, б).
Существует несколько линий данных, свидетельствующих об участии этих галактозидсвязывающих лектинов в процессе дифференцировки. Лектин грудной мышцы цыпленка появляется между 8-м и 16-м днями эмбриональной жизни — в период активной дифференцировки мышц. В клетках миобластической линии (L6) активность лектина возрастает в ходе Слияния миобластов в миотрубочки. Слиянию всегда предшествует адгезия клеток, и на поверхности миобластов с помощью иммунофлуоресценции был обнаружен лектин. Парадоксально, однако, что большая часть лектина находится внутри клеток. Возможно, что такая внутриклеточная локализация необходима для постоянного пополнения поверхностного лектина в ходе процесса слияния. С другой стороны, не исключено, что лектин может иметь несколько разных функций, причем некоторые из них связаны с транспортом гликопротеинов внутри клеток. В любом случае, однако, можно считать установленным факт специфического взаимодействия лектина с поверхностными остатками галактозы на начальных этапах дифференцировки мышц [89].
Еще один лектин имеется в эмбриональных поперечнополосатых мышцах цыпленка, причем его активность также меняется в ходе мышечного развития. Способность агглютинировать клетки сильно тормозится гепараном и гепарансульфатом, который является важной составной частью межклеточного матрикса. Лектин секретируется дифференцированными мышечными клетками в культуре во внеклеточное пространство и, возможно, играет более важную роль в прилипании клеток к поддерживающему матриксу (разд. 4.5.2), чем в адгезии клеток (89].
Процесс развития эритроцитов является другой интересной системой, в которой галактозоспецифические лектины также играют важную роль. Эритробласты имеют на своей поверхности типичный лектин с молекулярной массой 13 000, Который способен склеивать эти клетки в «эритробластические островки», окружающие кормящий макрофаг. Количество лектина на клеточной поверхности снижается по мере созревания эритробластов и освобождения из агрегатов ретикулоцитов — прямых предшественников эритроцитов [90], В ходе эритроидной дифференцировки происходят значительные изменения в галактозосодержащих углеводных цепях. По крайней мере это наблюдается в клетках человека — согласно данным, полученным с использованием реагентов, связывающихся с антигенными детерминантами Ii (гл. 3). Лектины, сходные с теми, которые расположены на поверхности эритробластов, способны реагировать с Іі-детерминантами [91]. Весьма интересно было бы обнаружить параллелизм между появлением лектина, связывающего галактозу, и модуляциями Іі-детерминант в развивающихся системах.
Наконец, следует упомянуть о галактозосвязывающем лектине, который освобождается из клеток мозга новорожденных крысят при добавлении лактозы. Он, очевидно, аналогичен другим упомянутым выше лектинам, также связывающим галактозу. Лектин из мозга появляется у 10-дневных крысят во время максимального образования синапсов, и возможно, что он играет важную роль, например в процессе синаптогенеза при развитии кортикального слоя [92].