Гликопротеины - Хьюз Р. 1985
Строение
Строение N-гликанов
Иммуноглобулины
Все пять классов иммуноглобулинов человека и, вероятно, все другие иммуноглобулины содержат углеводы [11]. Хотя количество и состав углеводов может быть различным в разных классах иммуноглобулинов, молекулы всех этих белков содержат N-гликаны, расположенные в константной (Fc) области тяжелых цепей. Заслуживает внимания тот факт, что между участками Fc-области, к которым прикрепляются углеводные компоненты (рис. 2.7), обнаруживается значительная степень гомологии.
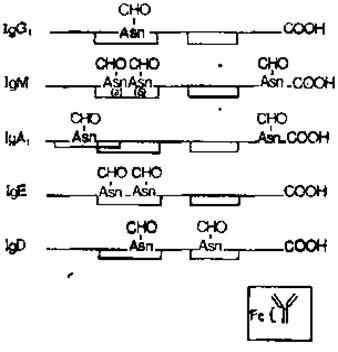
Рис. 2.7. Участки гликозилирования и внутрицепочечные дисульфидные мостики тяжелых цепей иммуноглобулинов. На врезке схематически показана интактная молекула иммуноглобулина кролика. СНО — углеводные цепи. Углеводные компоненты (а) и (б) иммуноглобулина М обсуждаются в тексте.
Сам факт локализации гомологичных углеводных цепей в сходных участках Fc-области у всех иммуноглобулинов дает все основания думать, что необходимая последовательность аминокислот вокруг остатков аспарагина варьирует очень мало и, по-видимому, имеет весьма важное структурное и функциональное значение скорее всего как точка прикрепления функционально важных гликанов.
Сейчас уже имеются детальные данные о строении двух углеводных цепей иммуноглобулина М человека и одной цепи — иммуноглобулина G человека. В качестве объекта исследования были использованы иммуноглобулины, выделенные из сыворотки двух больных с миеломой. Эти белки следует рассматривать как продукты секреции клеточных клонов, кодируемые в каждом случае определенными генами. Тем не менее и в этих случаях была найдена значительная гетерогенность в строении углеводов, сходная с указанной выше гетерогенностью гликанов овальбумина.
В молекуле иммуноглобулина М миеломы человека при каждом остатке аспарагина имеются углеводные цепи двух основных типов: цепи, содержащие только маннозу и N-ацетилглюкозамин, и цепи, содержащие, кроме того, сиаловую кислоту, галактозу и фукозу. Структура цепей второго типа еще не выяснена. Строение олигомаинозидных цепей показано на рис. 2.8. Необходимо сделать два замечания. Во-первых, все последовательности строятся путем добавления остатков а-маннозы к трисахариду коровой области manß1→HglcNAcß1→4HglcNAc, причем вначале происходит присоединение одного остатка маннозы к С-3, а затем трех остатков маннозы по С-6 центрального ß-маннозильного остатка. Такая последовательность (man)5R идентична по своему строению гликопептиду овальбумина (рис. 2,6). Структуры, идентичные гликопептидам IIIВ и IV овальбумина, были обнаружены среди углеводных цепей иммуноглобулинов (минорный компонент (б) и главный компонент (б) соответственно). Кроме того, у иммуноглобулина М обнаружены и крупные структуры с более высоким содержанием а-маннозильных звеньев, чем у гликопептидов овальбумина. Это — два изомера (man)8R и одна последовательность (man)9R. Во-вторых, очень важно подчеркнуть наличие асимметрии гликозилирования в участках (а) и (б) тяжелой цепи иммуноглобулина М. Лучше всего это объясняется тем, что в участках (а) и (б) имеются углеводные компоненты, содержащие по 6 остатков маниозы. Пять из этих остатков расположены в обоих случаях идентично, а еще один (а1→2) присоединен к разным остаткам углеводных цепей участков (а) и (б). Сходная асимметрия отмечается в цепях, содержащих 7 и 8 остатков маннозы; они также различаются по расположению одного а-маннозильного остатка. Сейчас еще не совсем ясны причины этих тонких различий в строении гликанов, имеющих сходную общую структуру и прикрепляющихся к остаткам аспарагина, расположенных рядом в одной полипептидной цепи. Однако, как будет подробно обсуждаться в следующей главе, описанное строение олигоманнозидных цепей этого иммуноглобулина человека объяснимо с точки зрения механизма биосинтеза N-гликанов.
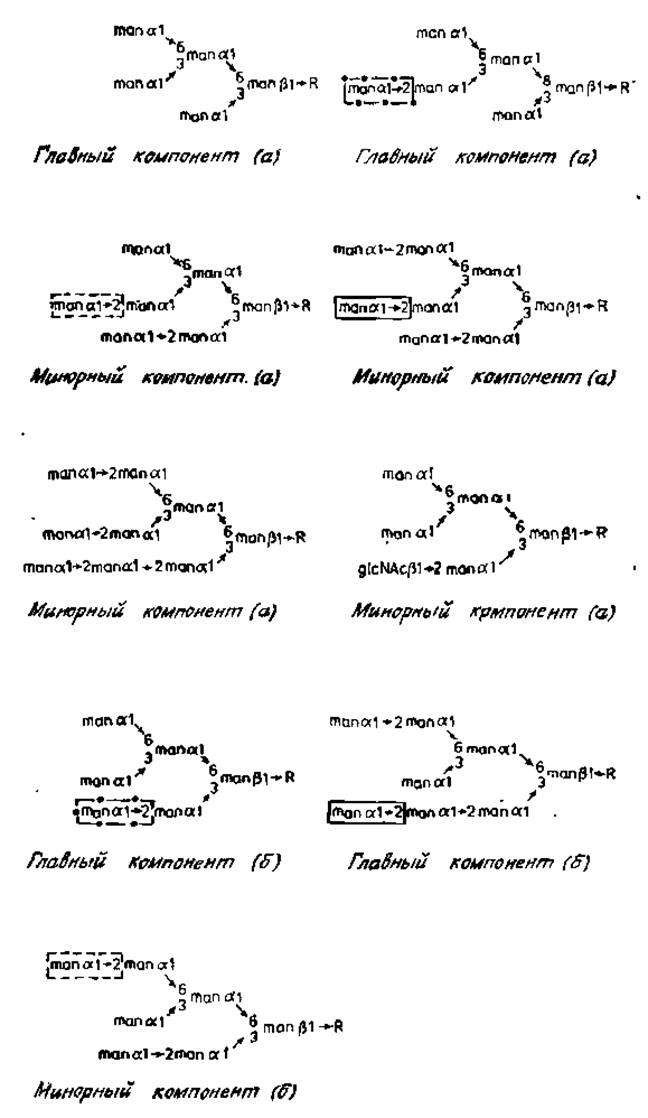
Рис. 2.8. Строение N-гликанов иммуноглобулина М человека. R — glсNAcß1→4glcNAc. Asn; (а) и (б) —два участка гликозилирования Fс-области, показанной на рис. 2.7. Вариабельные остатки с-маннозы обведены прямоугольниками [13].
Наконец, следует отметить минорный компонент участка (а), содержащий концевой остаток N-ацетилглюкозамина. Как будет сказано ниже, этот углевод является важным промежуточным продуктом при сборке «сложных» гликанов, содержащих галактозу, фукозу и сиаловую кислоту. Подобные гликаны обнаружены в иммуноглобулинах и других гликопротеинах.

Рис. 2.9. Строение гликопептидов миеломного иммуноглобулина G человека и продукты их расщепления под действием экзогликозидазы. R — glcNAcß1→4 (fuca1→6) glcNAc. Asn.
На рис. 2.9 [10] показано строёние углеводных компонентов гликопептидов, выделенных из проказного гидролизата иммуноглобулина G. Этот белок был получен из сыворотки больного множественной миеломой. Разделение гликопептидов проводили с помощью хроматографии на смоле дауэкс-50. Первым выходил кислый гликопептид (А), а затем элюировалась смесь нейтральных гликопептидов (Б и В), которую в свою очередь можно было разделить для последующего структурного анализа. Последовательная обработка всех этих гликопептидов нейраминидазой (только для А), ß-галактозидазой и ß-N-ацетилглюкозаминидазой приводила к образованию одного и того же олигосахарида (Г), содержащего два остатка a-маннозы, связанных с коровой областью. Очевидно, что содержащийся в овальбумине олигосахарид с высоким содержанием маннозы в иммуноглобулине G в значительных количествах не содержится. Однако к двум остаткам а-маннозы присоединены остатки N-ацетилглюкозамина и галактозы, причем в некоторых случаях теми же связями, что и у гликопептидов овальбумина (например, в фракции I). Асимметрия гликопептида А иммуноглобулина является его интересной особенностью. К боковой цепи, присоединенной (a1→3)-связью к центральному остатку ß-маннозы коровой области, присоединен единственный остаток N-ацетилнейраминовой кислоты. Наличие подобной структуры поднимает вопрос о специфичности гликозилтрансфераз, прикрепляющих остатки сиаловой кислоты к концевой галактозе подобных углеводных цепей (этот вопрос рассматривается в следующей главе). Такая асимметрическая структура имеет особое значение, поскольку служит субстратом для специфических гликозилтрансфераз. Обработка кислого гликопептида А ß-галактозидазой с последующей обработкой ß-N-ацетилглюкозаминидазой, а затем и нейраминидазой дает углеводную цепь Д. Обработка последней ß-галактозидазой приводит к появленню цепи Е. Обычно структуры Д и Е не встречаются в нативных иммуноглобулинах М, однако, как указывалось выше, углевод, аналогичный Е, был обнаружен в иммуноглобулине М. Еще одной особенностью этих N-гликанов является наличие остатка фукозы, присоединенного к хитобиозе коровой области связью a1→6(к первому остатку в цепи). Важно отметить, что описанные гликопептиды входят в состав иммуноглобулинов G, секретируемых той конкретной миеломой, которая была использована в этих опытах [10, 11]. Каждая из миелом отличается от других, причем все они образуют довольно различные наборы гликанов иммуноглобулинов.