Гликопротеины - Хьюз Р. 1985
Строение
Строение N-гликанов
Орозомукоид
Некоторые структурные особенности этого важного сывороточного белка уже обсуждались выше. Его единственная полипептидная цепь содержит пять гликозилированных остатков аспарагина, локализованных, как показано на рис. 2.10. К настоящему времени описаны полные последовательности десиалированных N-гликанов орозомукоида. Установлено также их место прикрепления к полипептидной цепи. Прежде чем осуществить разделение озоромукоида на отдельные гликопептиды под действием химотрипсина, производят удаление сиаловой кислоты. Поскольку химотрипсин обладает довольно узкой специфичностью, то в результате описанной процедуры образуется смесь гликопептидов, каждый из которых имеет одну из пяти уникальных аминокислотных последовательностей, локализацию которых в пептидной цепи легко установить. Для улучшения последующего разделения шестнадцати гликопептидов с помощью ионообменной хроматографии проводится удаление сиаловых кислот, что позволяет использовать различия в общем заряде пептидов и в размерах их углеводных цепей. Для выяснения строения гликопептидов использовался метод ЯМР высокого разрешения. В каждом случае для определения было необходимо всего 2—3 мг гликопептидов, что лишний раз указывает на большую ценность этого аналитического метода [14].
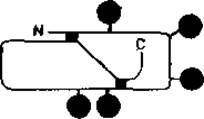
Рис. 2.10. Участки гликозилирования (черные кружки) полипептидной цепи орозомукоида. Черные квадратики — две внутрицепочечные дисульфидные связи.
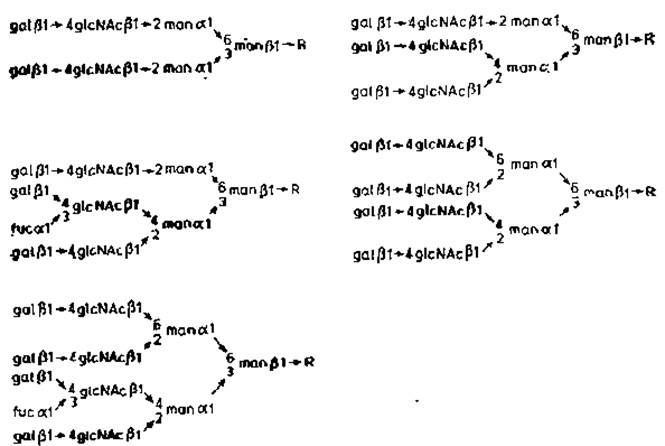
Рис. 2.11. Строение N-гликанов орозомукоида. R — glcNAcß→4glcNAc. Asn.
В результате описанных опытов у различных гликопептидов были обнаружены некоторые ранее неизвестные свойства. Кроме того, в этих же опытах были подтверждены данные, полученные ранее при расщеплении интактных гликопротеинов (разд. 2.2.1). Остатки сиаловой кислоты преимущественно присоединены к N-ацетиллактозаминовым звеньям, расположенным на концах разветвленных олигосахаридов. В орозомукоиде отсутствуют олигоманнозидные цепи, и углеводные компоненты относятся к «сложному» типу, содержащему много звеньев neuNAc.gal.glcNAc, которые присоединены к общей центральной области, состоящей из двух остатков а-маннозы, одного остатка ß-маннозы и одного остатка хитобиозы. Как и у сложных цепей иммуноглобулина G, здесь тоже имеется четкая асимметрия в структурах, содержащих три или более концевых остатков N-ацетил- лактозамина. Один из остатков cc-маннозы, связанных с С-3 остатка ß-маннозы, замещен при С-2 и С-4, тогда как другой — при С-2 и С-6. Причиной такой асимметрии, вероятнее всего, является субстратная специфичность разных N-ацетилглюкозаминилтрансфераз, ответственных за присоединение в ходе сборки цепи каждого из остатков N-ацетилглюкозамина к цепи-предшественнику. Имеющиеся данные о субстратной специфичности двух таких ферментов обсуждаются в гл. 3.
Другой характерной особенностью N-гликанов орозомукоида оказалось присутствие фукозы, присоединенной (а1→3)-связью к определенному остатку N-ацетил- глюкозамина. Тот факт, что замещенными являются строго определенные остатки N-ацетилглюкозамина в разветвленных цепях, еще раз указывает на наличие очень узкой специфичности у a1→3 — фукозилтрансфераз. В отличие от иммуноглобулина G в орозомукоиде фукоза не присоединяется к хитобиозе.
Из приведенного краткого обзора наших знаний о строении N-гликанов можно сделать следующие выводы; 1) сборка N-гликанов осуществляется в результате согласованного действия многих гликозилтрансфераз, каждая из которых имеет очень узкую субстратную специфичность; 2) активность этих ферментов заметно изменяется в зависимости от того, какой участок полипептидной цепи подвергается гликозилированию. В ходе изучения биосинтеза N-гликанов были получены подтверждения приведенным выше выводам. Эта проблема будет обсуждаться в следующей главе.