Гликопротеины - Хьюз Р. 1985
Строение
Эндогликозидазы
Как уже кратко обсуждалось в разд. 2.2,1, эндогликозиды гидролизуют внутренние связи углеводной цепи, что приводит к высвобождению олигосахаридов из гликопротеинов или гликопептидов, полученных в результате протеолиза из гликопротеинов. Сейчас уже известно много эндогликозидаз (табл. 2.4) [8]. Чтобы охарактеризовать их специфичность, необходимо иметь олигосахариды или гликопептиды с известным строением, такие, например, как фрагменты овальбумина. В свою очередь специфические эндогликозидазы служат исключительно ценным инструментом для определения структурных особенностей углеводных цепей гликопротеинов. Эти ферменты способны реагировать с интактными гликопротеинами и даже с теми из них, которые расположены на поверхности неповрежденных клеток. Поэтому с их помощью, возможно, удастся непосредственно выяснить, какова биологическая роль углеводных компонентов гликоконъюгатов.
Таблица 2.4. Эндоглюкозидазы [8]
|
Фермент |
Источник |
|
Тип А Эндо-ß-N-ацетилглюкозаминидаза D |
Streptococcus pneumoniae |
|
Н |
Streptomyces plicatus |
|
СІ и СІІ |
Streptomyces griseus Clostridium perfringens |
|
Иижнр, почки, печень, селезенка млекопитающих, яйцевод кур |
|
|
Тип В Эндо-ß-N-ацетнлгалактозаминидаза |
Эмульсин миндаля Streptococcus pneumoniae Clostridium perfringens Streptococcus pneumoniae Escherichia freundii |
|
Эндо-β-галактозидаза |
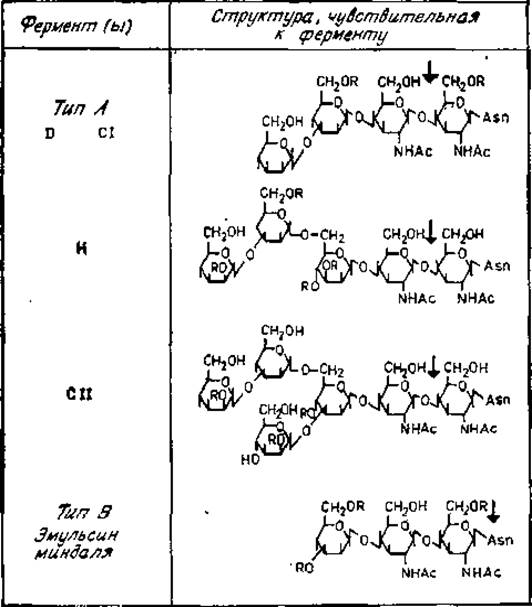
Рис. 2.12. Специфичность действия эндо-β-N-ацетилглюкозаминидаз. R — атом водорода или остаток сахара.
Все эндо-β-N-ацетилглюкозаминидазы типа А расщепляют гликозидную связь между двумя остатками N-ацетилглюкозамина, непосредственно присоединенных к аспарагиновому остатку полипептида (рис. 2.12). Ферменты D и СІ (но не Н или СII) гидролизуют эту связь, даже если хитобиоза замещена фукозой, как это имеет место в гликопептидах иммуноглобулина G (рис. 2.9). Эти ферменты обладают также и другими различиями по специфичности. Остаток 3а-замещенной маннозы, расположенной на нередуцирующем конце гликопептида, чувствительного к ферментам D и СІ, должен быть незамещенным, например как у гликопептидов VI или V овальбумина. Гликопептид IV не является субстратом для этих ферментов. Данные ферменты гидролизуют также олигосахариды, например продукты, получаемые при гидролизе эндо-β-N-ацетилглюкозаминидазой типа В. Для гликозидазы Н требуется более сложная цепь из остатков а-маннозы, присоединенных к С-6 ß-маннозильного остатка трисахаридной коровой области гликопептидов. Этот фермент неактивен, если к коровой области присоединена фукоза. Под действием гликозидаз Н и СII быстро расщепляются гликопептиды III А, ІІІВ, IV, V и VI овальбумина. Однако имеется два принципиальных различия между двумя этими ферментами. Во-первых, гликозидаза СІІ требует наличия разветвленной структуры, в которой как С-3, так и С-6 остатка ß-маннозы замещены остатками а-маннозы. Во-вторых, фермент СII не действует на цепи, содержащие 4-О-замещенный остаток маннозы, который присоединен а3-свяэью к коровой области, поскольку для проявления его активности гидроксильная группа в положении 4 должна быть незамещенной (рис. 2.12) [11].
Эндо-β-N-ацетилглюкозаминидаза типа В (например, из эмульсина миндаля [15]) способна действовать как на интактные гликопротеины, так и на гликопептиды. Расщепляемая при этом связь расположена между N-ацетилглюкозамином и аспарагином (рис. 2.12).
Эндо-β-N-ацетилгалактоэаминидаза стрептококка обладает высокой специфичностью в отношении дисахарида galß1→3galNAc, прикрепленного к серину или треонину полипептидной цепи, что характерно для многих О-гликанов гликопротеинов. Однако если этот дисахарид является замещенным, то фермент перестает действовать. Разумеется, это ограничивает его использование. Сходный фермент выделен из культуральной жидкости Clostridium perfringens, В результате катализируемой им реакции образуются свободный дисахарид galß1→3galNAc и полипептидная цепь.

Рис. 2.13. Субстратная специфичность эндо-β-галактозидаз. R1 — атом водорода или остаток сахара. R2 — атом водорода, остаток сахара или церамида.
Эндо-β-галактозидазы специфичны и в отношении протяженных углеводных последовательностей. Фермент из Е. freundii гидролизует внутреннюю галактозидную связь в углеводных цепях гликопротеинов, если галактоза соединена (ß1→4) -связью с N-ацетилглюкозамином, или же в гликолипидах, если галактоза соединена такой же связью с глюкозой, которая в свою очередь присоединена к церамидному звену. Расщепление таких внутренних связей происходит даже в случае очень длинных олигосахаридных цепей, образующихся при добавлении остатков сахаров к нередуцирующему концевому остатку N-ацетилглюкозамина (рис. 2.13). При замещении С-6 галактозного остатка, входящего в состав важного трисахаридного звена, чувствительность к ферменту полностью исчезает. Однако присоединение сульфата к N-ацетилглюкозамину на активность фермента не влияет. Такая сульфатированная структура, в частности, встречается в кератансульфате — компоненте проoтеогликанов. Последние гидролизуются ферментом, причем происходит накапливание свободных цепей neuNAc→galNAc(SO4)→gal. Сходной специфичностью обладает фермент из Ftavoblacter. Оба эти фермента были получены в гомогенном виде. Их молекулярная масса оказалась равной 35 000. Различие между обсуждаемыми ферментами заключается в том, что фермент из Ftavoblacter является конститутивным, тогда как синтез и секреция фермента из Escherichia freundii индуцируются 2—127 лишь при выращивании бактерии на среде с кератан-сульфатом или гликопротеинами, имеющими соответствующие связи в гликанах.
Эндо-β-галактозидаза стрептококка гидролизует разветвленные олигосахариды, показанные на рис. 2.13. Эти углеводы представляют собой антигенные детерминанты веществ группы крови А (с концевым остатком N-ацетилгалактозамина) или В (с концевой галактозой). Необходимой частью субстрата является N-ацетилглюкозамин, и соответственно фермент гидролизует связи galß1→4glcNAc, но не galß1→3glcNAc. Обе эти связи присутствуют в разных цепях, замещенных, во-первых, фукозой, а во-вторых, либо галактозой, либо N-ацетилгалактозамином. В результате получаются цепи с активностью антигенов групп крови А и В. Интересно, что фермент из стрептококка может не только различать эти антигенные структуры, но специфичность его даже выше, чем у соответствующих антител.